p62/SQSTM1在非小细胞肺癌细胞增殖和侵袭转移中的作用
2024-01-30马雪周世辉
马雪 周世辉
锦州医科大学附属第一医院急诊科(辽宁锦州 121001)
肺癌是全球范围内最常见的癌症死亡原因,占2018年所有癌症相关死亡人数的18.4%,位列所有恶性肿瘤之首[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的病理类型,占所有确诊肺癌病例的80%以上[2]。NSCLC的总体预后较差,这主要是由于大部分NSCLC 患者在发现时已处于晚期,失去了手术机会,而以铂类药物为基础的化疗也仅能将患者的5年生存率维持在15%左右[3]。因此,寻找新的NSCLC 治疗靶点已成为目前研究的热点。
自噬是一种细胞自我消化过程,在这个过程中,错误折叠和聚集的蛋白质以及受损的细胞器被称为自噬小体的双膜小泡所隔离。自噬小体被送到溶酶体形成自溶酶体后便会自行降解和回收。自噬既可以为癌细胞提供营养,也可以引起癌细胞死亡在动态平衡的条件下,自噬被认为是肿瘤进展所必须的[4-6]。自噬相关蛋白p62/SQSTM1 在选择性自噬中扮演着重要的角色,其能够结合泛素化蛋白质从而进入自噬小体内,降解功能异常的聚合蛋白和过剩的蛋白质以发挥作用[11]。研究显示,在多种肿瘤中均发现了p62 聚集,提示了高水平的p62 可能与肿瘤的形成密切相关[12-13]。值得注意的是,UMEMURA 等[14]报道了p62 可以通过激活Nrf2 介导的通路参与肺细胞癌的发生发展。然而,目前尚无研究全面系统地阐述p62 在NSCLC 中的具体作用。本研究旨在通过检测p62 在体内外NSCLC 中的表达和生物学功能,探究p62 在NSCLC 细胞增殖和侵袭转移中的作用,为p62 成为NSCLC 新的治疗靶点提供完整可靠的理论和实验依据。
1 材料与方法
在获得本院伦理委员会批准(伦理审查编号:KX2022037)和所有患者知情同意后开展本研究。
1.1 主要试剂及耗材正常人支气管上皮细胞(NHBE)和NSCLC 细胞系(NCI-H661、A549、NCIH1688、NCI-H1299 和NCI-H446)购买自中国科学院上海细胞研究所;DMEM 培养基、10%胎牛血清和胰蛋白酶-EDTA 购买自美国Gibco 公司;1%青霉素/链霉素购买自美国Hyclone 公司;TRIzol 细胞裂解液、RIPA 细胞裂解液、cDNA 逆转录酶和QuantiTect SYBR®Green PCR 试剂盒购买自美国Sigma 公司;Matrigel 基质胶和Transwell 小室购买自美国Becton 公司;CCK-8 试剂盒和BCA 蛋白浓度定量试剂盒购买自上海碧云天生物科技有限公司;ECL 增强化学发光试剂盒购买自北京安诺伦生物科技有限公司;si-p62 和si-NC 购买自广州锐博生物科技有限公司;pcDNA3.1 空载载体(pcDNA-NC)和p62 过表达载体(pcDNA-p62)购买自上海吉凯基因化学技术公司;p62、Bcl-2、Bax、ATG5、Becline1、GAPDH 一抗和HBR 标记的相应二抗购买自上海酶联生物技术有限公司;LipofectamineTM3000 及其他常见分子生物学相关试剂与耗材购买自美国Thermo Fisher Scientific 公司。
1.2 实验方法
1.2.1 临床组织样本和细胞培养选取本院经病理组织学确诊的和临床诊断为NSCLC 的30 例NSCLC患者手术切除的肺癌组织和正常癌旁组织。正常癌旁组织(NHBE)和肺癌组织细胞(NCI-H661、A549、NCI-H1688、NCI-H1299 和NCI-H446)均用含10%胎牛血清、100 U/mL 青霉素和100 mg/mL链霉素的DMEM/F12 细胞培养基进行培养。加湿培养箱条件为95%相对湿度,5% CO2和37 ℃。对数期生长的细胞被收集起来用于后续实验研究。
1.2.2 细胞转染与分组将p62 表达水平最高的A549 细胞作为转染对象。对数期A549 细胞按照4 × 105个/孔的密度接种在6 孔板中,并随机分为Control 组、pcDNA-NC 组、pcDNA-p62 组、si-NC 组和si-p62组。当A549细胞融合度达到80%以上时,利用脂质体3000 转染试剂将pcDNA-NC、pcDNAp62、si-NC 和si-p62 质粒分别转染到pcDNA-NC 组细胞、pcDNA-p62 组细胞、si-NC 组细胞和si-p62 组细胞,Control 组细胞不做任何处理。转染48 h 后,RT-qPCR 用于检测CYTOR 表达以验证细胞转染效率。
1.2.3 RT-PCR 实验使用TRIzol 处理的转染后的A549 细胞并提取总RNA。用cDNA 逆转录试剂盒将总RNA 逆转录为cDNA。使用QuantiTect SYBR®Green PCR 试剂盒对目标mRNA 进行PCR反应。反应条件如下所示:在94℃下初始变性30 s,然后94 ℃ 6 s,60 ℃ 30 s,总共40 个循环。GAPDH 为参照基因,使用2-ΔΔCq方法计算p62 的相对表达水平。引物序列如下所示:p62,正向5′-CACCAGACCATGCTTCAGTGAGA-3′和反向5′-GTTGCATGGCTGTTCACAGGA-3′和GAPDH,正向5′-CACCAGACCATGCTTCAGTGAGA-3′和反向5′-GTTGCATGGCTGTTCACAGGA-3′。
1.2.4 CCK-8实验将转染后的各组A549细胞按5×103个/孔的密度接种于96 孔板中。这些细胞分别培养0、24、48 和72 h 后,再加入10 μL 的CCK-8溶液继续混合培养2 h。用自动酶标仪检测各孔细胞在450 nm 处的吸光度以反映细胞增殖能力。
1.2.5 划痕实验通过划痕实验评估细胞的迁移能力。将转染后的A549 细胞按照2 × 105个/孔的密度接种在6 孔板中,37 ℃下过夜培养。当细胞形成大约90%的致密融合单层时,用200 μL 的无菌移液枪枪头穿过细胞表面形成一条宽度<1 mm的垂直伤口。加入1 mL 的不含胎牛血清的DMEM培养基继续培养48 h。用倒置光学显微镜观察0和48 h 后的细胞创面情况并拍照。
1.2.6 Transwell 实验通过Transwell 小室检测细胞的侵袭能力。将转染后的A549 细胞置于不含胎牛血清的DMEM 培养基中饥饿处理12 h 并将其调整为密度为2 × 105个/mL 的细胞悬液备用。在已接种Matrigel 胶的上室中加入100 μL 的细胞悬液,下室中加入含10%胎牛血清的DMEM 培养基500 μL。随后将细胞置于培养箱中进行常规培养。培养48 h 后,用4%多聚甲醛固定上室细胞后再用0.1%的结晶紫染色。最后在倒置光学显微镜下观察细胞侵袭情况并计算细胞侵袭数量。
1.2.7 Western blot 实验使用RIPA 细胞裂解液提取转染后A549 细胞中的总蛋白然后通过BCA蛋白定量试剂盒检测蛋白浓度。取30~40 μg的蛋白样品,经12% SDS-PAGE 分离后转移到0.22 μm的聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜中,置于5%的脱脂奶粉中封闭过夜。随后将PVDF 膜一抗p62(1 000;ab91526;Abcam)、Bcl-2(1∶1 000;ab32124;Abcam)、Bax(1∶1 000;ab32503;Abcam)、ATG5(1∶1 000;ab78073;Abcam)、Becline1(1∶1 000;ab207612;Abcam)和GAPDH(1∶1 000;ab32124;Abcam)在4 ℃下过夜。随后,与HBR 标记的二抗(1∶1 000;ab32124;Abcam)共孵育2 h。按照制造商说明书,通过ECL 增强化学发光试剂盒对蛋白条带进行显色并用Image J 软件分析条带灰度。以GAPDH 作为内参分析目标蛋白的相对表达。
1.2.8 裸鼠皮下成瘤实验将10 只3~4 周龄的雄性裸鼠随机分为sh-NC和sh-p62组,每组各5只。sh-NC 组和sh-p62 组小鼠分别在皮下注射由shRNA-NC 和shRNA-p62 慢病毒感染的A549 细胞(4 × 105个)。每隔7 d 观察1 次并记录裸鼠体质量和肿瘤大小。5 周后采用乙醚处死小鼠,剥离肿瘤,肿瘤组织经称重后用甲醛固定,石蜡包埋用于后续研究。
1.3 统计学方法本实验中所有实验都至少进行了3 次。采用GraphPad Prism 8 软件对实验数据进行统计分析。所有数据均采用均值±标准差表示。单因素方差分析(ANOVA)用于多组数据间的比较,studentt检验用于两组数据间的比较。以P<0.05 为差异有统计学意义。
2 结果
2.1 p62 在NSCLC 组织和细胞中高表达癌旁组织p62 表达低于肺癌组织,差异有统计学意义(P<0.05),见表1。
表1 两组p62 表达情况Tab.1 Expression of p62 in two groups ±s

表1 两组p62 表达情况Tab.1 Expression of p62 in two groups ±s
组别癌旁组织肺癌组织t值P值p62 1.01±0.08 2.81±0.17 52.474<0.001
2.2 敲低和过表达p62 对A549 细胞增殖、迁移和侵袭能力的影响将siRNA 和pcDNA 转染到A549 细胞中以下调和上调p62 的表达。p62 在si-NC、si-p62、pcDNA-NC、pcDNA-p62 组的表达水平分别为1.02±0.03、0.62±0.07、1.03±0.01、2.69±0.12。与si-NC 组细胞比较,si-p62 组细胞中的p62表达显著降低(P<0.05)。与pcDNA-NC 组细胞比较,pcDNA-p62 组细胞中的p62 表达显著升高(P<0.05)。接下来,分别通过CCK-8、划痕和Transwell实验检测p62 对A549 细胞增殖,迁移和侵袭能力的影响,结果见图1、图2 和表2、表3。转染si-p62后细胞增殖、迁移和侵袭能力显著降低(P<0.05),而转染pcDNA-p62 后细胞增殖、迁移和侵袭能力显著升高(P<0.05)。

图1 抑制和促进p62 表达对A549 细胞迁移的影响Fig.1 Effect of inhibition and promotion of p62 expression on A549 cells migration

图2 抑制和促进p62 表达对A549 细胞侵袭的影响(结晶紫染色,× 200)Fig.2 Effect of inhibition and promotion of p62 expression on A549 cells invasion(Crystal violet staining,× 200)
表2 抑制和促进p62 表达情况Tab.2 Effect of inhibition and promotion of p62 expression ±s
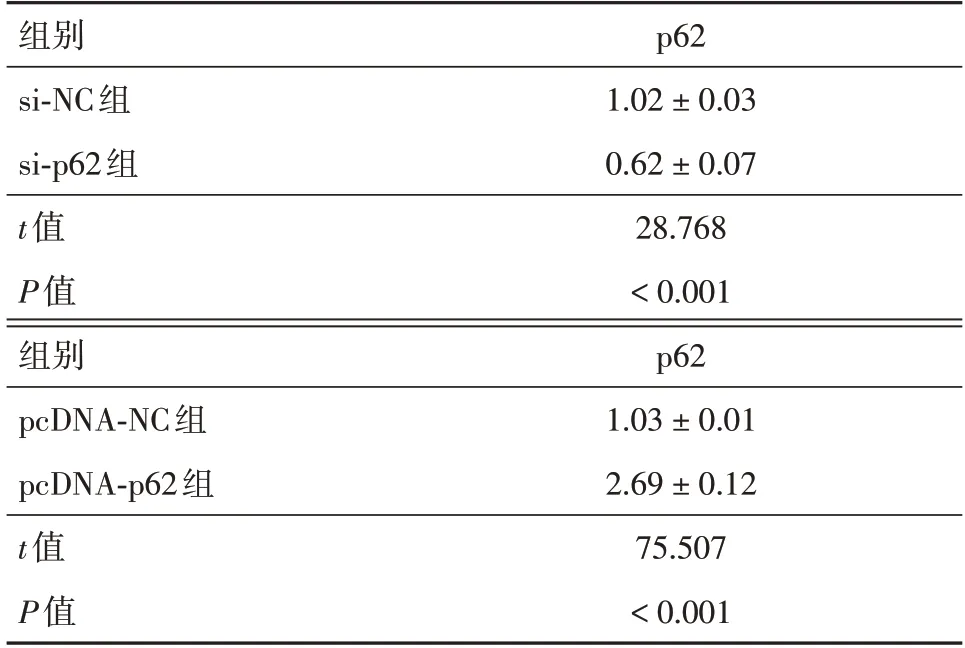
表2 抑制和促进p62 表达情况Tab.2 Effect of inhibition and promotion of p62 expression ±s
组别si-NC组si-p62组t值P值组别pcDNA-NC组pcDNA-p62组t值P值p62 1.02±0.03 0.62±0.07 28.768<0.001 p62 1.03±0.01 2.69±0.12 75.507<0.001
表3 抑制和促进p62 表达对A549 细胞增殖、迁移和侵袭的影响Tab.3 Effect of inhibition and promotion of p62 expression on A549 cells proliferation,migration and invasion ±s

表3 抑制和促进p62 表达对A549 细胞增殖、迁移和侵袭的影响Tab.3 Effect of inhibition and promotion of p62 expression on A549 cells proliferation,migration and invasion ±s
组别侵袭细胞数/个si-NC组si-p62组t值P值48 h 0.48±0.06 0.34±0.04 10.634<0.001 72 h 0.86±0.03 0.67±0.04 20.813<0.001 87.12±5.01 42.76±10.01 21.706<0.001组别侵袭细胞数/个pcDNA-NC组pcDNA-p62组t值P值OD值(450 nm)24 h 0.37±0.05 0.22±0.04 12.831<0.001 OD值(450 nm)24 h 0.31±0.04 0.41±0.05 8.554<0.001 48 h 0.55±0.02 0.71±0.06 13.856<0.001 72 h 0.98±0.02 1.23±0.04 30.619<0.001 85.22±4.54 124.29±8.21 22.810<0.001
2.3 敲低和过表达p62 对A549 细胞自噬和凋亡蛋白的影响转染si-p62 后,抗凋亡蛋白Bcl-2 自噬相关蛋白ATG5 和Becline1 表达水平明显降低,而促凋亡蛋白Bax 表达水平明显升高(P<0.05)。而转染pcDNA-p62 后,Bax 蛋白水平降低,而Bcl-2、ATG5 和Becline1 表达水平明显升高(P<0.05)。见表4。
表4 抑制和促进p62 表达对A549 细胞自噬和凋亡蛋白的影响Tab.4 Effect of inhibition and promotion of p62 expression on A549 autophagy and apoptosis ±s

表4 抑制和促进p62 表达对A549 细胞自噬和凋亡蛋白的影响Tab.4 Effect of inhibition and promotion of p62 expression on A549 autophagy and apoptosis ±s
组别si-NC组si-p62组t值P值组别pcDNA-NC组pcDNA-p62组t值P值Bcl-2蛋白0.58±0.01 0.31±0.04 35.867<0.001 Bcl-2蛋白0.63±0.04 0.79±0.07 10.870<0.001 Bax蛋白0.21±0.03 0.59±0.07 27.329<0.001 Bax蛋白0.18±0.02 0.12±0.02 11.619<0.001 ATG5蛋白0.68±0.02 0.48±0.02 38.730<0.001 ATG5蛋白0.65±0.03 0.93±0.07 20.137<0.001 Becline1蛋白0.58±0.07 0.37±0.03 15.103<0.001 Becline1蛋白0.71±0.02 0.96±0.04 30.619<0.001
2.4 敲低p62 抑制A549 细胞在小鼠体内的生长与sh-NC 组比较,sh-p62 组小鼠的移植瘤质量明显减小(P<0.05),见表5。体内实验结果表明,下调p62 表达后可以有效抑制A549 细胞在小鼠体内的生长。
表5 抑制p62 对裸鼠肿瘤生长的影响Tab.5 Effect of inhibition of p62 expression on tumor growth in tumor-bearing mice ±s

表5 抑制p62 对裸鼠肿瘤生长的影响Tab.5 Effect of inhibition of p62 expression on tumor growth in tumor-bearing mice ±s
注:与sh-NC比较,*P<0.05
组别Control组sh-NC组sh-p62组肿瘤质量(g)2.41±0.14 2.50±0.12 1.12±0.08*抑制率(%)--55.20
3 讨论
p62 作为一种自噬接头蛋白,其在肿瘤进展中的表达模式和具体作用尚不清楚。在本研究中,我们发现p62 在NSCLC 细胞和肿瘤组织中高表达。体外细胞功能实验结果表明下调p62 的表达能有效抑制A549 细胞增殖、迁移、侵袭和自噬,而诱导细胞凋亡。同时,上调p62的表达则对A549细胞的生长具有相反的生物学效应。此外,体内移植瘤小鼠实验结果表明沉默p62 能显著抑制小鼠体内肿瘤生长。这些结果揭示了p62可能作为致癌基因通过调控细胞自噬促进NSCLC 细胞生长。
之前多项研究表明,多功能蛋白p62 在多种肿瘤细胞中异常高表达并发挥促进肿瘤生长的作用[15-17]。例如,p62 在食管鳞状细胞癌中异常高表达,且p62 敲除后有效抑制了肿瘤细胞的恶性行为[15]。在结肠癌细胞中,沉默p62 能通过抑制活性氧(reactive oxygen species,ROS)的产生和自噬,缓解肿瘤细胞生长[16]。值得注意的是,临床研究已证实p62 在肺腺癌患者肿瘤组织样本中高表达,且高表达p62 的肺腺癌患者预后相对较差[17]。此外,DURAN 等[18]研究报道了在p62 敲除的小鼠中,肺腺癌细胞体内生长速度受到明显抑制,同时细胞内ROS 和凋亡水平显著升高,肺腺癌的发生率明显下降。在本研究中,p62 在NSCLC 组织和细胞中的表达显著升高,抑制p62 表达能有效抑制NSCLC 细胞的恶性行为,而过表达p62 表现出相反的效果,说明p62 在NSCLC 细胞的发生发展中发挥了重要的促癌作用。然而,p62 是通过什么途径来影响NSCLC 细胞行为,目前尚不明确。综合p62 的文献调研结果,本研究进一步从细胞自噬的角度对p62 在NSCLC 中的调控机制进行了相应的研究与探讨。
自噬在癌症的发病机制中起着重要作用,既可以作为肿瘤抑制途径,也可以作为肿瘤促进途径[19-20]。研究显示,在自噬缺陷的动物模型中,抑制自噬可以通过调控染色体的不稳定性来抑制肿瘤进展[21]。因此,自噬可以通过保护细胞内稳态防止肿瘤恶性转化[22-23]。然而,自噬也可以通过维持暴露在细胞内环境压力下的肿瘤细胞增殖,来促进肿瘤的生长和发展[24-25]。p62 是自噬的主要参与者,也是mTORC1 和Keap1-Nrf2 等多条重要信号转导通路的枢纽。研究显示,p62 蛋白泛素化后可以通过干扰UBA 结构域的聚化而启动选择性自噬。在选择性自噬中,p62 不仅可以作为泛素化蛋白的接头蛋白,也可以作为底物被自噬过程所降解[26]。在前列腺癌中,p62 可以通过诱导选择性自噬受损促进肿瘤细胞的上皮间质转化,进而增强细胞迁移和侵袭的能力[27]。最近的一项研究[28]发现,抑制p62 表达能够调控PDCD10 的选择性自噬降解而促进乳腺癌细胞的增殖转移能力。在NSCLC中,自噬可以通过调控细胞凋亡在NSCLC进展中发挥促进和抑制两种作用。一般来说,抑制自噬在多数情况下会限制NSCLC 肿瘤细胞维持稳态的能力[29]。本研究表明,与大多数情况保持一致,沉默p62 能通过抑制自噬来缓解NSCLC 细胞的恶性生长,而过表达p62 能通过上调自噬相关蛋白水平促进NSCLC 细胞的生长。
综上所述,敲除p62 能通过抑制A549 细胞的保护性自噬来发挥抑癌作用,本研究结果将有助于更好地理解p62 在NSCLC 发生中的作用机制,为其成为肺癌诊断和治疗的潜在靶点提供科学合理的依据。
【Author contributions】MA Xue performed the experiments and wrote the article.ZHOU Shihui performed the experiments.MA Xue and ZHOU Shihui revised the article.MA Xue designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
