miRNA-93-5p通过调控FBXW7基因参与宫颈癌进展
2024-01-30王江
王 江
(四川省南充市中心医院/川北医学院附属南充市中心医院妇科, 四川 南充 637000)
宫颈癌是导致妇女在癌症相关疾病中死亡的主要原因[1]。虽然近几十年来在宫颈癌的管理取得了技术进展,但宫颈癌的死亡率仍然很高。目前,宫颈癌发生和发展的相关致病机制尚未完全阐明。探索宫颈癌发展的分子机制对于建立宫颈癌的新治疗策略至关重要。微核糖核酸(miRNAs)可分为致癌miRNAs和抗癌miRNAs[2],恶性肿瘤的发生发展与肿瘤表达miRNAs的异常变化有关[3]。近年来,miRNAs的功能已成为近年来癌症靶向治疗研究的热点。miRNA-93-5p已被发现广泛参与结肠癌、胃癌、肝细胞癌等恶性肿瘤的进展,在癌细胞的的增殖、侵袭和迁移中发挥重要作用[4-5]。既往研究显示,miR-93-5p可能是治疗宫颈癌的潜在靶点[6]。FBXW7是一种重要的肿瘤抑制因子[7]。miRNAs可使癌症细胞中的FBXW7功能失活[8]。研究发现,FBXW7在调控宫颈癌的侵袭性中发挥重要作用[9]。然而,关于miR-93-5p是否可通过调控FBXW7影响宫颈癌的进展,未见报道。本研究通过调控宫颈癌细胞miR-93-5p与FBXW7的表达水平,探究miR-93-5p是否可通过调控FBXW7影响宫颈癌细胞的凋亡、增殖、迁移、侵袭水平,以期为临床中治疗宫颈癌提供新的研究思路。
1 材料与方法
1.1试剂与仪器:FBXW7抗体(武汉三鹰生物技术有限公司)、GAPDH抗体(美国Affinity生物技术公司)、细胞凋亡检测试剂盒(赛默飞世尔科技公司)、Transwell小室(上海康宁有限公司)、结晶紫染色液(美国Sigma-Aldrich公司)、酶标仪、Attune CytPix 成像型流式细胞仪(美国Thermo Scientific公司)。
1.2实验分组:收集20例临床宫颈癌患者组织,分组为癌旁组织、宫颈癌组织,并检测H8、Caski、HeLa、C33A,选择宫颈癌细胞C33A。分为对照组(正常培养)、miRNA-93-5p抑制组(转染低表达miRNA-93-5p),FBXW7激活组(转染高表达FBXW7)。
1.3实验方法
1.3.1RT-qPCR检测miRNA-93-5p 、FBXW7 mRNA水平:提取邻近正常宫颈组织、宫颈癌组织中及H8、Caski、HeLa、C33A细胞中总RNA量,逆转录miRNA-93-5p、FBXW7的RNA为cDNA。将miRNA-93-5p、FBXW7的cDNA扩增,内参为GAPDH。引物序列见表1。
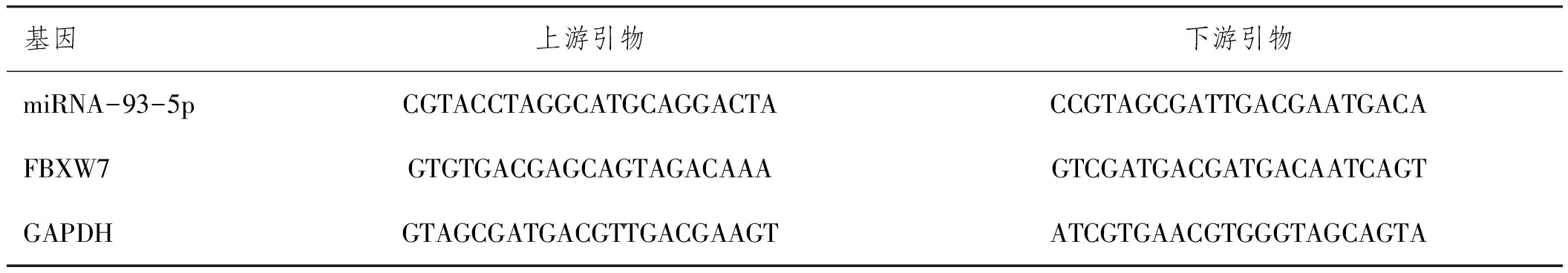
表1 引物序列
1.3.2转染低表达miRNA-93-5p 、过表达FBXW7:将C33A宫颈癌细胞接种到6孔板内,培养至细胞到80%,参考转染试剂(质粒,赛默飞世尔科技公司)说明书逐步操作将miRNA-93-5p、FBXW7分别转染到C33A细胞中,构建出低表达miRNA-93-5p 细胞株、过表达FBXW7细胞株。
1.3.3流式细胞术检测C33A细胞的凋亡率:收集各组C33A细胞制备成单细胞悬液,调整细胞浓度,离心后去掉上清再加入稀释的一抗重悬细胞,冰上避光孵育1h,再加入对应的二抗溶液,冰上避光孵育30min,使用抗体稀释液洗涤稀释两次,离心去除上清液后,加入抗体稀释液重悬细胞,最后使用流式细胞仪检测分析。
1.3.4平板克隆检测C33A宫颈癌细胞增殖能力:将C33A宫颈癌细胞接种到6孔板中,干预结束后继续培养细胞至克隆团数大于50个后,使用PBS清洗反复清洗,加入甲醛溶液将细胞固定,加入Giemsa溶液浸染克隆团,最后使用PBS清洗后,拍照分析。
1.3.5细胞划痕实验检测C33A宫颈癌细胞迁移能力:将C33A宫颈癌细胞接种到6孔板,培养细胞至85%左右,使用灭菌后的枪头在各孔正中央垂直划一条直线使用无血清的培养基继续培养,分别在0h和24h时将各孔用PBS清洗后在显微镜下拍照观察,使用ImageJ软件测量迁移距离。
1.3.6Trallswell检测C33A细胞侵袭能力:将200 μL无血清培养基加入(5×104个细胞)Transwell室上腔中的细胞进行培养,下腔中的细胞加入完全培养基,培养24h,使用4%的多聚甲醛细胞固定10min,去除固定液,加入结晶紫染色25min,使用PBS清洗3次后直接在倒置显微镜下观察拍照。
1.3.7Western blotting 检测C33A细胞中FBXW7蛋白表达水平:收集各组C33A细胞并提取总蛋白,将各组蛋白浓度使用BCA试剂盒检测盒,配置合适的体系,高温将蛋白变性处理,置于-20℃备用。提前配置合适浓度的凝胶块,将样品加入对应的孔道中电泳一定时间,结束后将凝胶进行转膜、封闭,孵育一抗FBXW7(1∶1000),对应的二抗,每个步骤的间隙将条带浸入PBST溶液中清洗30min,使用发光液进行曝光,最后使用ImageJ软件分析。

2 结 果
2.1miRNA-93-5p、FBXW7在宫颈癌组织、细胞中的表达:与癌旁组织相比,宫颈癌组织中miRNA-93-5p mRNA水平显著增加、FBXW7 mRNA水平显著减少(图1A-B,F=173.65,P<0.001)。与H8相比,Caski(F=8.65,P<0.05)、HeLa(F=9.21,P<0.05)、C33A(F=82.41,P<0.01)细胞中miRNA-93-5p mRNA水平增加、FBXW7 mRNA水平减少(图1C-D)。

图1 miRNA-93-5p、FBXW7在宫颈癌组织、细胞中的mRNA水平
2.2抑制miRNA-93-5p对宫颈癌细胞凋亡、增殖、迁移、侵袭的影响:与对照组相比,miRNA-93-5p抑制组miRNA-93-5p mRNA水平显著降低(图2A,F=164.82,P<0.001),C33A宫颈癌细胞的细胞凋亡率增加(图2B,F=192.01,P<0.001),C33A细胞的克隆能力下降(图2C,F=74.02,P<0.01),C33A细胞迁移距离减少(图2D,F=82.75,P<0.01),C33A细胞侵袭能力下降(图2E,F=67.25,P<0.01)。


图2 C33A细胞中的miRNA-93-5p mRNA水平及细胞的凋亡、增殖、迁移、侵袭能力
A.RT-qPCR检测细胞中miRNA-93-5p mRNA水平;B.流式细胞术检测细胞凋亡率;C.平板克隆检测细胞增殖能力;D.划痕实验检测细胞迁移能力;E.Trallswell检测细胞侵袭能力;与对照组比较,**P<0.01、***P<0.001。
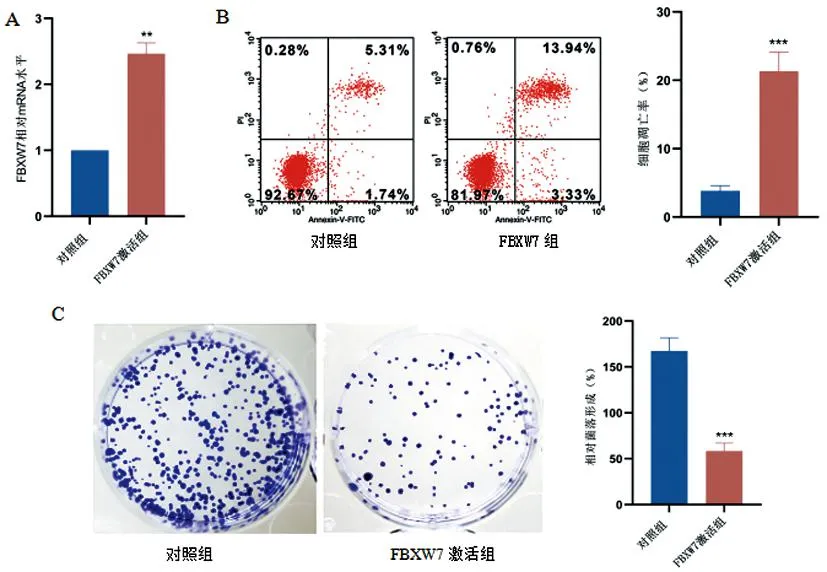

图4 C33A细胞中的FBXW7 mRNA水平及细胞的凋亡、增殖、迁移、侵袭能力
A.Western blotting检测细胞中FBXW7蛋白水平;B.RT-qPCR检测细胞中FBXW7 mRNA水平。与对照组比较,**P<0.01。
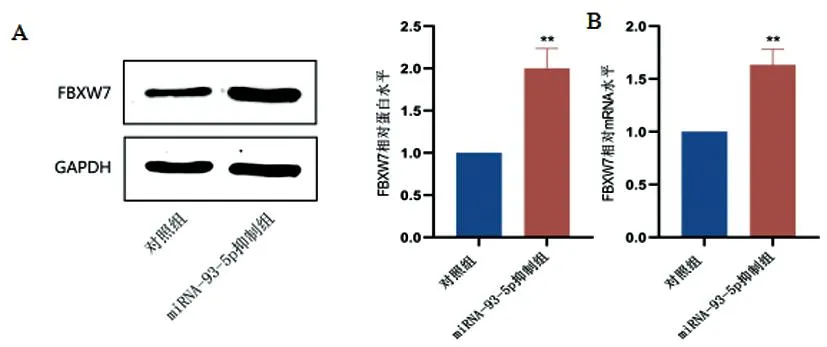
2.3miRNA-93-5p调控宫颈癌细胞中FBXW7的表达:与对照组相比,miRNA-93-5p抑制组FBXW7蛋白(F=65.81,P<0.01)、mRNA(F=69.24,P<0.01)水平显著增加(图3A-B)。
2.4过表达FBXW7对宫颈癌细胞凋亡、增殖、迁移、侵袭的影响:与对照组相比,FBXW7激活组FBXW7 mRNA水平显著增加(图4A,F=72.11,P<0.01),C33A细胞凋亡率增加(图4B,F=187.31,P<0.001),克隆能力下降(图4C,F=172.60,P<0.001),迁移距离减少(图4D,F=80.25,P<0.01),侵袭能力下降(图4E,F=65.72,P<0.01)。
3 讨 论
宫颈癌是一种子宫颈上皮性恶性肿瘤,是最常见的妇科恶性肿瘤之一[10]。人乳头瘤病毒(HPV)感染是宫颈癌发作的主要原因[11]。研究显示,HPV感染后致癌性相关的基因组改变是癌症进展的关键步骤。因此,对致癌基因以及抑癌基因的研究尤为重要。据统计,全球每年约有50万患者患有宫颈癌,这些病例大多数发生在发展中国家,且每年约有27万人死于宫颈癌。早期宫颈癌患者经标准化治疗后,5年生存率为80~90%。然而,伴有淋巴结转移的宫颈癌患者的5年生存率低于50%[12]。因此,深入研究宫颈癌的可能有效治疗策略至关重要。
随着对各种肿瘤中miRNAs的深入研究,发现miRNAs的表达谱可以作为多种肿瘤的重要分子生物标志物和治疗靶点。目前,所有关于miRNAs的研究都集中在筛选肿瘤组织和正常组织(或癌旁组织)之间具有差异表达的miRNAs的表达谱上。研究学者们认为,下调的miRNAs的功能与抑制基因相似,表现出抗癌作用,上调的miRNAs的功能与致癌基因相似,显示出致癌作用。近年来,miRNAs的功能已成为癌症靶向治疗的研究热点。miRNA-93-5p在多种癌组织中高表达,具有致癌作用,且在癌细胞的的增殖、侵袭和迁移中发挥重要作用。值得关注的是,已有研究显示,miR-93-5p可能是治疗宫颈癌的潜在靶点。FBXW7是一种重要的肿瘤抑制因子。miRNAs可使癌症细胞中的FBXW7功能失活。既往研究显示,FBXW7在调控宫颈癌的侵袭性中发挥重要作用。然而,关于miR-93-5p是否可通过调控FBXW7影响宫颈癌的进展,未见报道。本研究初步在宫颈癌组织及癌旁组织中检测发现,宫颈癌组织中miR-93-5p mRNA水平显著增加,FBXW7 mRNA水平显著减少。通过选择不同的宫颈癌细胞系进行检测,也得出同样的结果,其中C33A宫颈癌细胞中二者变化最为显著,因此我们选择该细胞系进行后续研究。为了验证miR-93-5p是否可通过调控FBXW7 影响宫颈癌的生物学行为,我们将miR-93-5p低表达后发现,宫颈癌细胞中FBXW7的低水平改善,且宫颈癌细胞的凋亡率增加,增殖、迁移、侵袭能力下降。进一步高表达FBXW7也得出同样的结果。
综上所述,宫颈癌组织中miR-93-5p高表达,FBXW7低表达,低表达miR-93-5p可上调FBXW7水平,阻碍宫颈癌的发病进展,将宫颈癌细胞中FBXW7高表达,结果与低表达miR-93-5p对宫颈癌细胞的影响保持一致。本研究初步初步阐明miRNA-93-5p可通过调控FBXW7基因影响宫颈癌细胞的凋亡、增殖、迁移、侵袭水平,将为临床中宫颈癌的治疗提供新思路。
