症状性颅内动脉粥样硬化性狭窄的血管重构模式与斑块特征的高分辨磁共振研究
2024-01-30焦萌,李昂
焦 萌,李 昂
脑卒中是中国居民首要的致死致残因素,其中缺血性脑卒中约占脑卒中的80%[1],而颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)是亚洲人群缺血性脑卒中的首要因素,约占全部脑卒中和短暂性脑缺血发作(transit ischemic attack,TIA)的33%~50%[2]。 目前临床对ICAS 卒中的治疗方案和疗效评估主要依据血管的狭窄程度,传统的腔内造影技术,如CT 血管造影(CT angiography,CTA)、磁共振血管造影(magnetic resonance angiography,MRA)、数字减影血管造影(digital subtraction angiography,DSA)等,无法评估血管重构和斑块的形态学特征。 高分辨磁共振成像技术(high-resolution ma-gnetic resonance imaging,hr-MRI)是目前唯一可在活体进行血管壁及斑块成像的无创检查技术, 有利于识别脑血管病的病因、 发病机制或预测今后发生缺血性脑卒中的风险,已在ICAS 的诊疗中得到了广泛应用[3,4]。 在粥样硬化性疾病中,受累动脉可通过血管重构的模式改变其形态以适应病变的发展,不同血管重构模式的产生机制和临床意义不同,症状性ICAS 患者中正性重构更多,且与下游梗死的关联更大[5~7];不同重构模式还被证实与不同的梗死模式相关[8,9]。血管正性重构还是隐源性脑卒中的重要机制之一[10],研究表明,在MRA未见狭窄的脑卒中和TIA 患者中,hr-MRI 对颅内斑块的检出率约为50.6%[11],这说明因血管正性重构而被忽视的颅内高危斑块比以往认识的更为普遍,并与缺血性脑卒中和不良预后相关。 因此,笔者研究旨在利用多序列hr-MRI 探索症状性ICAS 患者的临床特征及斑块形态与血管重构之间的关系。
1 资料与方法
1.1 临床资料
选择2015 年1 月至2019 年1 月于东部战区总医院神经内科因缺血性脑卒中或TIA 就诊的ICAS患者80 例,其中男性27 例,女性53 例;年龄39 ~67岁,平均年龄53.2 岁(标准差12.1 岁);身体质量指数 (body mass index,BMI)22 ~29 kg/m2, 平均BMI 25.75 kg/m2(标准差2.87 kg/m2);既往高血压史53例,糖尿病14 例。
选择标准:①年龄>18 岁;②3 个月内因ICAS导致的缺血性脑卒中或TIA;③经CTA、MRA、DSA 证实颅内动脉段(颈内动脉颅内段、大脑中动脉、椎动脉颅内段、基底动脉)狭窄≥50%;④最少一项动脉粥样硬化危险因素如高血压病、糖尿病、吸烟、高脂血症等。
排除标准:①同时存在颅外段大动脉狭窄>50%;②由非动脉粥样硬化的其他原因导致的脑卒中,如心房颤动、血管炎、烟雾病(moya-moya disease,MMD)、动脉夹层、可逆性血管收缩综合征等;③图像质量差,无法分析。 具体纳排流程图详见图1。
图1 患者选择和排除流程图Fig.1 Flow chart of patient enrollment and exclusion
1.2 方法
1.2.1 高分辨MRI 方法
使用德国GE HDXT 3.0 T MRI 配64 通道头部线圈对患者进行扫描检查。检查序列包括弥散加权成像(diffusion weighted imaging,DWI)、三维时间飞跃法磁共振血管造影(three dimensional time of flight-magnetic resonance angiography,3D TOF-MRA):层厚1.4 mm,层数136,重复时间(time of repetition,TR)25 ms,回波时间(echo time,TE)3.5 ms,视野(field of view, FOV)24 cm × 21.1 cm; 平扫和增强的血管横断面液体衰减反转恢复序列(fluid-attenuated inversion recovery,FLAIR)T1、T2加权成像 (T1weight imaging,T1WI;T2weight imaging,T2WI)(四反转恢复序列,quadruple inversion recovery):TE 57 ms,TR 3400 ms,层厚2 mm,层数12;3D-cube 序列:TE 3.4 ms,TR 20 ms, 层厚1.4 mm,FOV 20.4 cm×18.4 cm。 增强的3D-cube 和T1WI 序列在静脉注射钆喷酸葡胺(0.1 mmol/kg,3 mL/s 注射。 北陆药业,中国)后立刻扫描,整体扫描时间约40 min。
1.2.2 图像分析
由2 名独立中级影像医师使用RadiAnt DICOM Viewer 软件分别在二维(two dimensional,2D)-T2序列血管最狭窄层面(maximal lumen narrowing,MLN)和参考血管层面(reference site,RS)手动勾画颅内动脉管腔、管壁,由软件生成得到血管面积(vessel area,VA)和管腔面积(lumen area,LA)。 参考血管定义为狭窄血管近端正常血管节段、远端正常节段或者对侧血管相对应血管节段,记录血管最狭窄处最大、最小管壁厚度; 选取并记录血管斑块处和临近脑实质处T1平扫信号值及增强扫描后的信号强度值;在血管最狭窄处记录斑块的分布象限,根据斑块表面形态将其分为规则和不规则。上述指标数值取2 名测量伏特加的平均值为最终值;分歧较大时引入第3 名高年资影像医师讨论后确定。
计算得到以下参数:管壁面积(wall area,WA)=VA-LA。 重构指数=VAMLN/VARS(VAMLN:血管最狭窄层面血管面积;VARS: 参考血管层面血管面积)。 斑块负荷=WAMLN/VAMLN(WAMLN:血管最狭窄层面管壁面积)。偏心指数=(血管狭窄处最大壁厚- 血管狭窄处最小壁厚)/血管狭窄处最大壁厚,偏心指数≥0.5 定义为偏心斑块。 强化指数=T1增强序列中斑块处信号值/临近脑组织信号值, 斑块内出血(intraplaque hemorrhage,IPH)定义为T1序列中斑块信号值高于临近脑组织的1.5 倍。
1.2.3 血管重构模式的评价标准
在既往研究中,通常根据不同重构指数将血管重构模式分为3 类,重构指数≥1.05 定义为正性重构,重构指数≤0.95 定义为负性重构,0.95 ~1.05 定义为无重构[5]。 在该研究中,根据重构指数是否≥1.05将患者分为正性重构组和非正性重构组。
1.2.4 观察指标
①临床资料: 收集患者的人口统计学资料如年龄、性别等;既往史及血管危险因素如高血压、糖尿病、高脂血症、吸烟等;临床实验室检查结果如血压、血糖、低密度脂蛋白等。②影像学参数:如管腔狭窄程度、偏心指数、斑块负荷、最小LA 等。
1.3 统计学方法
采用SPSS 26.0 软件进行统计学分析。 连续变量使用均数± 标准差或中位数[四分位数间距]表示,分类变量采用例数(%)表示。分类变量的组间比较使用χ2检验或Fisher 精确概率检验,连续性变量的组间比较采用独立样本t 检验和Mann-Whitney U 检验。 将单因素分析中P <0.1 的自变量纳入多因素Logistic回归分析(向前法)。 P <0.05 为差异有统计学意义。
2 结果
2.1 分组及两组临床资料比较
80 例患者, 根据重构指数最终分为正性重构组48 例和非正性重构组32 例(负性重构24 例和无重构8 例)。
两组临床资料组间比较结果显示,正性重构组患者的年龄更大[(58.04±9.78)岁vs(45.97±11.72)岁。P <0.05],其余指标差异无统计学意义(P >0.05)。 见表1。
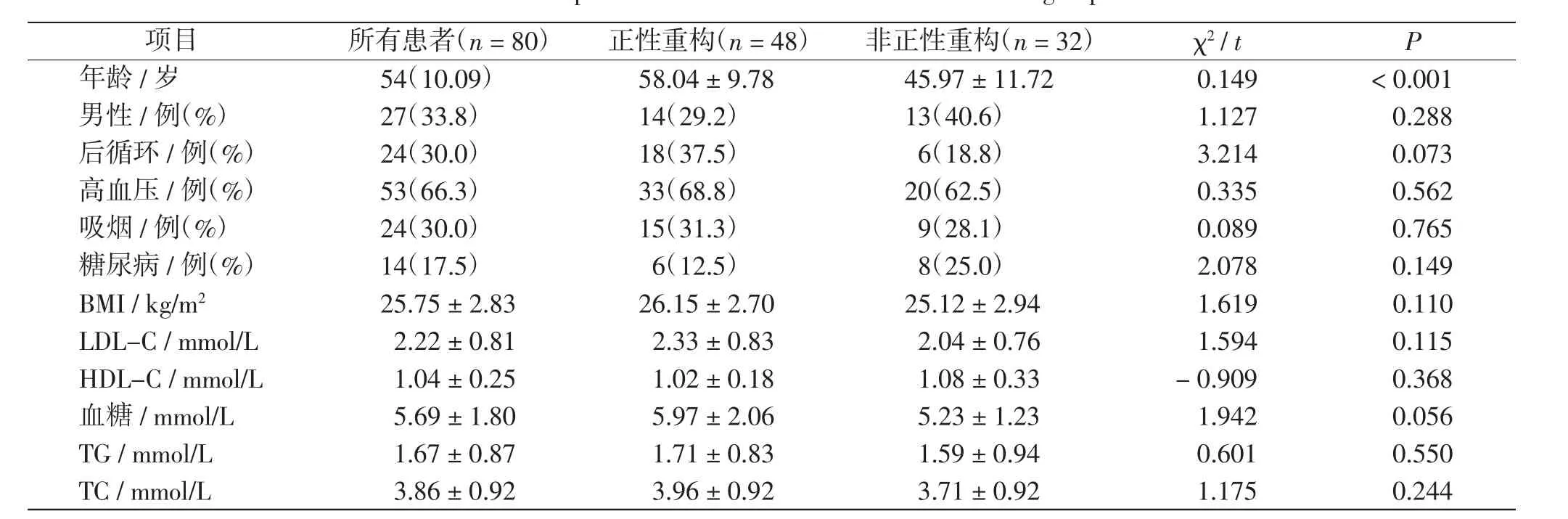
表1 两组患者的临床资料比较Tab.1 Comparison of clinical characteristics between 2 groups
2.2 两组影像学参数比较
hr-MRI 对颅内动脉管壁及斑块形态参数单因素分析显示,正性重构组强化指数更低(0.83 ± 0.54 vs 1.12 ±0.57。 P=0.021), 斑块面积更大[(7.95 ±4.56)mm2vs(2.91±2.66)mm2。 P <0.001],两组间斑块规则度及累及象限数差异无统计学意义(P >0.05)。见表2、图2。
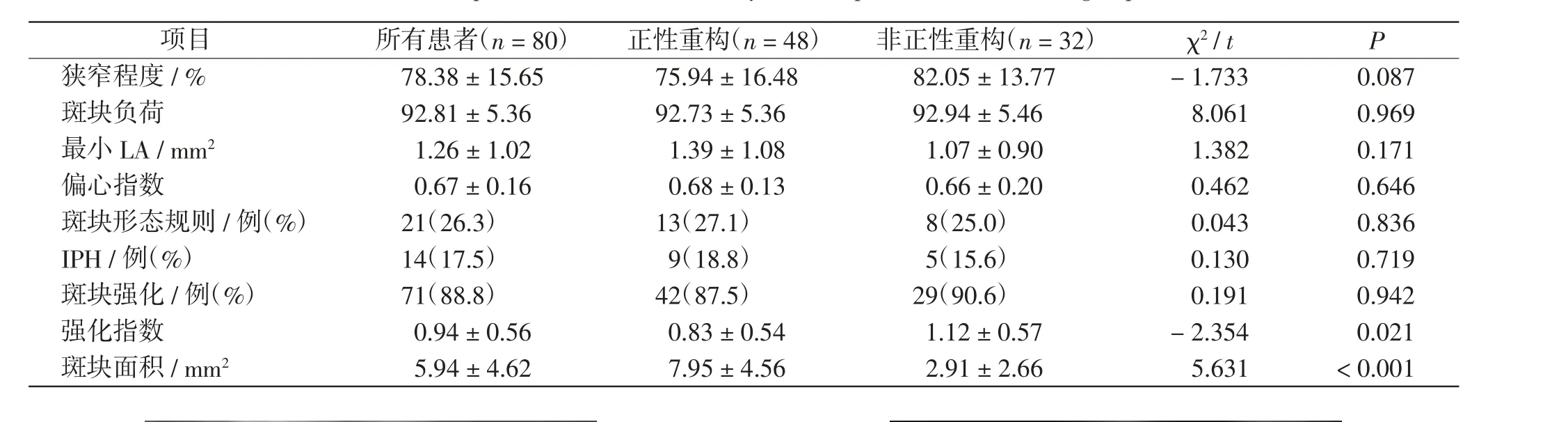
表2 两组颅内动脉hr-MRI 参数比较Tab.2 Comparison of intracranial artery hr-MRI parameters between 2 groups
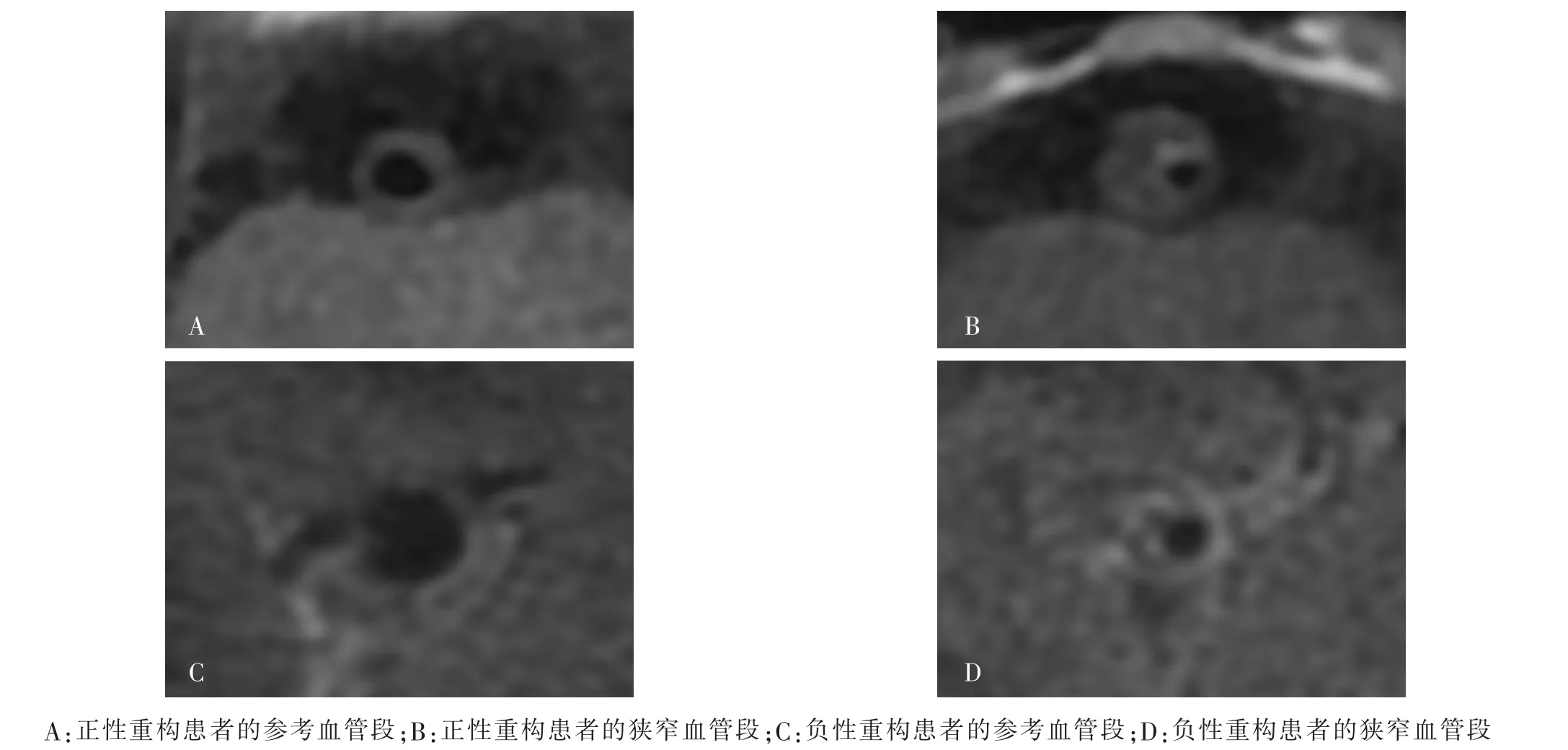
图2 2 例后循环梗死患者狭窄的基底动脉在2D-T2 序列下的血管重构模式Fig.2 Images of vascular remodeling pattern of stenotic basilar artery by 2D-T2 sequence in 2 patients with posterior circulation infarction
2.3 颅内动脉hr-MRI 参数与正性重构相关的Logistic 回归分析
将单因素分析中P <0.1 的自变量纳入多因素Logistic 回归分析(向前法)。多因素Logistic 回归分析显示(表3),校正混杂因素后,年龄[校正比值比(odds ratio,OR)=1.092,95%可信区间(confidence interval,CI)1.014 ~1.176,P=0.02] 和狭窄程度 (校正OR=0.932,95%CI 0.887 ~0.980,P=0.006) 均与正性重构独立相关。
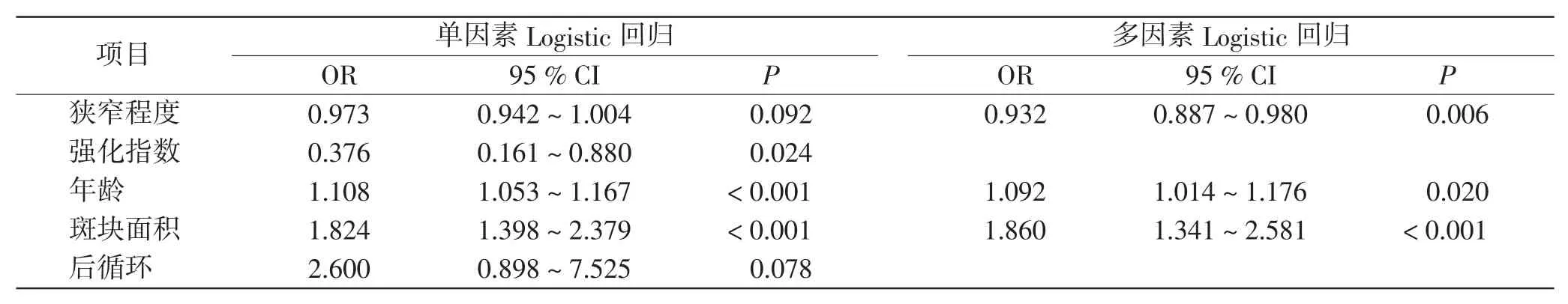
表3 颅内动脉hr-MRI 参数与正性重构相关的多因素分析Tab.3 Multivariate analysis of correlation between intracranial artery hr-MRI parameters and positive remodeling
3 讨论
在动脉粥样硬化性疾病中,受累动脉可通过血管重构的模式改变其形态以适应病变的发展,不同血管重构模式的产生机制和其背后的临床意义不同,笔者旨在探究症状性ICAS 患者中不同血管重构模式的hr-MRI 斑块特征差异, 有助于更准确地评估血管的功能状态和病变程度,推动ICAS 的个体化诊疗。
血管重构的概念最早在冠状动脉粥样硬化中被发现并描述,是血管发生粥样硬化改变时做出的适应性变化。 既往研究表明,年龄因素是影响血管重构模式的重要因素。而心脑血管疾病常见的危险因素也会影响血管的重构方式。笔者研究结果显示正性重构组患者的年龄更大,强化指数更低,斑块面积更大,狭窄程度更低,且更容易发生在后循环。笔者研究结果显示,正性重构组患者的年龄更大,表明重构方式可能与患者的年龄存在相关性,与梁汉祥等[12]研究结果一致。主要原因是因为老年患者动脉血管壁的结构、组成及血管内皮细胞的结构和功能均发生改变,这种变化特点可能是影响重构方式的重要因素。 通过hr-MRI 技术可无创清晰观察活体细小动脉壁结构,且1 次轴位扫描可将颅内主要血管全部覆盖,并可与任意层面对血管壁结构进行清晰观察,可确保最狭窄面和参考层面图像均垂直于动脉长轴,使测量数据更为准确。 因此可作为评价动脉粥样硬化特点的重要手段。针对笔者研究中年轻患者负性重构比例较大的结果,一个可能的假说为:颅内动脉狭窄/闭塞/MMD 可能有着相似的疾病模式和遗传背景,MMD 的hr-MRI 表现为管壁缩窄、不强化或向心性强化、管腔外径变短、大脑中动脉(middle cerebral artery,MCA)消失,部分表现为负性重构的早发的ICAS 可能是MMD 和烟雾综合征的早期表现,MMD 的易感基因无名指蛋白213(ring finger protein 213,RNF213) 的单核苷酸突变(single nucleotide polymorphism,SNP)p.R4810K 也被报道与前循环ICAS 中颅内动脉的负性重构相关[13~16],这可能提示前后循环的血管重构具有不同的机制,针对较为年轻的表现为负性重构的ICAS 患者,应更加注重临床随访,观察动态变化。通常认为,血管的正性重构代表了更高的脑卒中风险,更大的正性重构比例可能是高龄患者脑卒中风险升高的原因之一。针对高龄患者,应进行更加全面的脑卒中风险评估和更加严格的二级预防。
既往研究比较了不同脑卒中患者hr-MRI 增强序列中的强化等级,首次脑卒中患者较慢性脑卒中患者相比强化等级更高,再发脑卒中患者的强化等级则更高[17]。 笔者研究中,非正性重构组患者的强化指数更高,这表明该部分人群仍有着较高的脑卒中复发风险。虽然血管通过正性重构的方式一定程度上维持管腔的大小,减轻了狭窄的进展,但因其斑块更大,富含脂质,炎性细胞广泛浸润,是易损斑块的特征[18],因此正性重构患者斑块更不稳定,发生缺血事件的概率也更高,在后循环中正性重构的概率更高,也与文献报道一致。 正性重构血管的斑块负荷更大,冠状动脉介入治疗相关研究表明,正性重构的病灶血管进行介入治疗后发生管腔内再狭窄比例更高,可能与正性重构病变的不充分扩张或支架尺寸过小相关,在介入治疗前可进行hr-MRI 检查明确靶血管重构状况,针对正性重构的病变选择更大的支架尺寸。
目前观点认为血管重构是机体对血流动力学长期改变而发生的一种适应性反应。研究已证实血管剪切力(wall shear stress,WSS)对血管内皮细胞力学感受器的作用同血管的重构模式相关,正性重构更容易发生在WSS 较低的区域, 并且还会进一步加剧该区域的内皮剪切力持续降低,同时伴有显著的动脉粥样硬化斑块进展[19,20]。除生物力学因素外,重构模式还与局部的氧化应激反应、 炎症信号通路等多种因素相关[21]。 未来借助计算流体力学(computational fluid dyna-mics,CFD)或体外实验可以进一步证实明确不同血管重构的发生机制, 帮助医生更好地理解这一变化,为ICAS 脑卒中的防治指明新的方向。
笔者探讨并描述了不同血管重构模式患者临床及hr-MRI 影像特征的差异,发现了正性重构与非正性重构患者的年龄分布及斑块特征均存在差异。随着影像学技术的不断发展,不同血管重构其具体机制还会得到不断揭示。如何在早期对颅内动脉重构进行有效干预, 利用hr-MRI 指导对ICAS 进行精准化介入治疗,都将是未来需要关注的问题。
