NBI-ME 技术、CTC 及血清PGⅠ检测应用于早期胃癌诊断的临床价值
2024-01-30马金鑫冯谢敏
马金鑫,冯谢敏
胃癌是指起源于胃黏膜上皮细胞的恶性肿瘤,也是威胁中老年人群生命和健康的常见肿瘤性疾病。中国是胃癌高发地区,临床发病率和病死率分布位居所有恶性肿瘤的第2、3 位[1]。 早期胃癌(early gastric cancer,EGC)预后较好,5 年生存率可超过90%,而进展期胃癌的5 年生存率仅为20%~30%[2]。但胃癌起病隐匿,缺乏典型的临床表现,早期诊断率不足10%,多数患者就诊时已处于进展期或晚期,预后较差[3]。因此,胃癌早期诊断、早期治疗对于提高生存率、改善预后至关重要。 内镜是胃癌最常用的检查方法,随着内镜诊断设备和技术的日益进步,窄带内镜放大成像技术(narrow band imaging magnification endoscopy,NBIME)在上消化道疾病诊断中逐渐应用,可清晰显示胃黏膜表层形态,辨别病灶轮廓,尤其在微小病灶的区分方面具有优势[4]。 胃蛋白酶原(pepsinogen,PG)Ⅰ是主要由胃底腺主细胞和颈黏液细胞分泌的一种胃蛋白酶前体, 可反映胃黏膜腺体的萎缩程度和病变状态,在早期胃癌的预测中具有重要价值[5]。外周血循环肿瘤细胞(circulating tumor cell,CTC)是逃过机体的免疫监视,自原发灶进入血液循环的肿瘤细胞[6]。研究表明[7,8],包括胃癌在内多种恶性肿瘤在发病早期外周血中CTC 即可呈阳性表达,检测CTC 有助于EGC 的诊断。笔者研究探讨NBI-ME 技术、CTC 及血清PGⅠ检测在EGC 诊断中的应用价值,旨在提高ECG 的诊断率。
1 资料与方法
1.1 临床资料
选择2019 年1 月至2021 年9 月在延安大学附属医院消化内科收治的胃黏膜病变患者212 例,分为胃良性病变108 例(良性组)、癌前病变63 例(癌前病变组)、EGC 41 例(EGC 组)。 良性组男性71 例,女性37 例;年龄29 ~74 岁,平均年龄51.8 岁(标准差10.6岁);胃溃疡27 例,慢性萎缩性胃炎46 例,胃息肉29例,肥厚性胃炎11 例。癌前病变组男性41 例,女性22 例;年龄32 ~73 岁;平均年龄53.3 岁(标准差9.9岁)。EGC 组男性26 例,女性15 例;年龄34 ~74岁,平均年龄54.1 岁(标准差10.4 岁)。 3 组性别及年龄分布差异无统计学意义,具有可比性(P >0.05)。
诊断标准:参照《中国早期胃癌筛查流程专家共识意见(草案2017 年,上海)》[9]中相关诊断标准,良性病变,有一定发生胃癌危险的良性疾病,如胃溃疡、胃息肉、 慢性萎缩性胃炎等; 癌前病变, 上皮内瘤变;EGC,病灶局限于黏膜层或黏膜下层,不考虑淋巴结转移情况。
选择标准: ①所有患者均取得组织病理材料,明确诊断为胃良性病变、癌前病变或EGC;②首次确诊为该病,诊断与治疗的相关资料完整;③年龄>18岁;④该研究内容患者知情同意,并签署协议书。
排除标准:①进展期胃癌;②合并身体其他部位恶性肿瘤;③既往有其他胃肠道疾病史或手术史;④拒绝内镜检查;⑤心肝肾等脏器严重功能障碍、血液病、自身免疫系统疾病等;⑥神经、精神系统疾病未有效控制。
1.2 方法
1.2.1 内镜检查
患者禁食水>8 h,检查前30 min 予以盐酸达克罗宁胶浆10 mL 口服;内镜检查均由科室相关专家评估小组进行。 首先用普通白光内镜检查,观察病灶的部位、大小、胃黏膜形态、色泽等。 之后行NBI-ME 检查,逐级放大所发现的病灶,观察病灶与正常胃黏膜之间分界是否清楚,进一步观察病灶与正常组织界限的形态和病灶黏膜表层微血管形态,并夹取病灶组织作为组织病理标本。①胃黏膜结构消失或表现为不规则胃黏膜;②胃黏膜下微血管消失或微血管形态不规则。 符合上述任何一条即可诊断为EGC。
1.2.2 外周血循环肿瘤细胞检查
采集患者上午空腹静脉血8 mL,置于含有上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)抗体的预处理管内,加入6.5 mL 枸橼酸钠缓冲溶液,混匀后以2000 r/min 的转速离心10 min。 之后依次加入藻红蛋白标记的细胞角蛋白(cytokeratin,CK)81、CK9 抗体、 异藻蓝蛋白标记的白细胞共同抗原(leukocytecommonantigen,CD45)抗体和4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI),避光下孵育20 min, 此时细胞核会着色。 最后应用Analyzer 系统扫描处理过的标本,Cell Search 系统自动对具备癌细胞形态特点、CK+标记阳性的细胞进行判读,如有CK+DAPI+CD45-的细胞则认为CTC 阳性。
1.2.3 血清胃蛋白酶原Ⅰ检测
采集患者上午空腹静脉血5 mL, 以4000 r/min转速离心10 min, 分离血清置于-20 ℃冰箱内待测;应用荧光免疫层析法测定血清PGⅠ含量并记录。 试剂盒购自武汉菲恩生物科技有限公司(中国)。以血清PGⅠ≤71.85 μg/L 为阳性判别标准。
1.2.4 幽门螺杆菌检测
对所有患者进行13C 呼气试验。 检查前空腹8 h,服药前将基线呼气样本吹入500 mL 集气袋; 之后口服13C 尿素胶囊,30 min 收集第2 次呼气样本。 用红外光谱仪测定服药前后呼出气体中13C/12C 浓度比的变化量,即超基准值(delta over baseline,DOB)。 DOB值≥4 为阳性判别标准。 根据检查结果将所有患者分为幽门螺杆菌(helicobacter pylori,Hp)阳性组和Hp阴性组。
1.2.5 病理组织学检查
内镜检查时对病灶部位进行多点、多区域胃黏膜组织活检。对胃黏膜标本予以10%甲醛溶液固定、石蜡包埋,并做成5 μm 厚的切片,经过苏木精-伊红染色,在光学显微镜下进行病理组织检查。 参照世界卫生组织消化系统肿瘤分类标准[10]作出病理诊断。
1.2.6 观察指标
比较良性组、癌前病变组、EGC 组NBI-ME、外周血CTC 和血清PGⅠ检查的阳性率, 比较Hp 阳性组和Hp 阴性组各项检查的阳性率,绘制受试者工作特性(receiver operating characteristic,ROC)曲线,评价NBI-ME、CTC、PGⅠ分别单独检测和联合检测对EGC 的诊断效能。
1.3 统计学方法
应用SPSS 25.0 软件分析统计数据。 计数资料以频数表示, 组间比较应用χ2检验。 ROC 曲线评价NBI-ME、CTC、PGⅠ单独检测和联合检测对EGC 的诊断价值。 P <0.05 为差异有统计学意义。
2 结果
2.1 3 组检查方式对胃良性病变、癌前病变、早期胃癌的诊断结果
病理诊断胃良性病变108 例, 癌前病变63 例,EGC 41 例。 NBI-ME 诊断良性病变90 例,癌前病变44 例,EGC 35 例,其中正确169 例,错误43 例。 CTC诊断良性病变92 例, 癌前病变41 例,EGC 33 例,其中正确166 例, 错误46 例。 PGⅠ诊断良性病变87例,癌前病变39 例,EGC 29 例,其中正确155 例,错误57 例。
2.2 3 组NBI-ME、CTC、PGⅠ检查阳性率比较
NBI-ME、CTC、PGⅠ检查阳性率在良性组、 癌前病变组、EGC 组逐级增加 (P <0.01);EGC 组高于良性组、癌前病变组(P <0.01),癌前病变组高于良性组(P <0.01),差异均有统计学意义。 见表1。
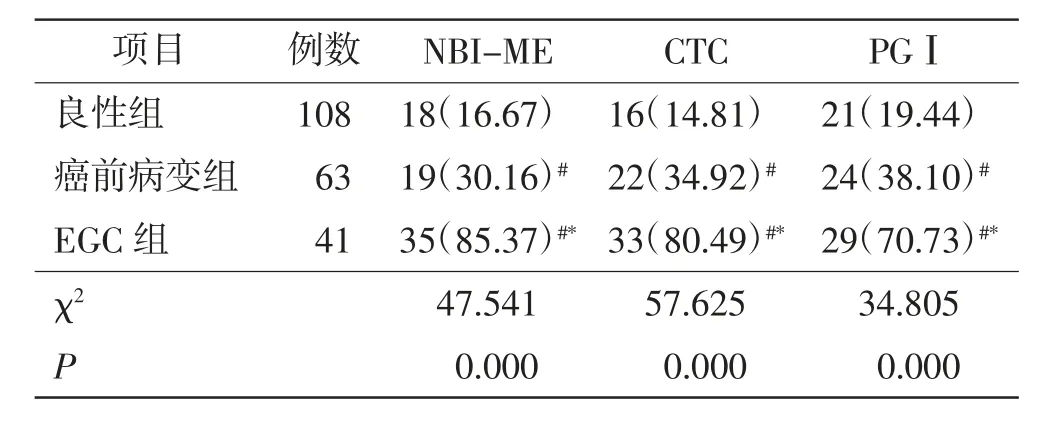
表1 3 组NBI-ME、CTC、PGⅠ检查阳性率例 例(%)Tab. 1 Comparison of positive rates of NBI-ME, CTC and PGⅠin 3 groups cases(%)
2.3 NBI-ME、CTC、PGⅠ对EGC 的诊断效能
绘制NBI-ME、CTC、PGⅠ诊断EGC 的ROC 曲线,NBI-ME、CTC、PGⅠ联合诊断EGC 曲线下面积为0.918[95 %可信区间(confidence interval,CI)0.846 ~0.989],此时的灵敏度和特异度0.920 和0.721,曲线下面积和灵敏度均高于3 项单独诊断;NBI-ME、CTC、PGⅠ单独诊断EGC 的ROC 曲线下面积差异无统计学意义,3 项指标联合诊断EGC 的ROC 曲线下面积分别大于各指标单独诊断 (Z = 4.186、4.791、5.370,P <0.05),差异均有统计学意义。 见图1、表2。
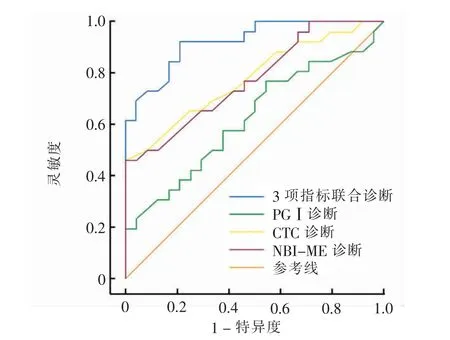
图1 NBI-ME、CTC、PGⅠ单独和联合诊断EGC 的ROC 曲线Fig. 1 ROC curves of NBI-ME, CTC, PGⅠalone and combined diagnosis of EGC

表2 NBI-ME、CTC、PGⅠ单独和联合诊断EGC 的价值Tab. 2 Comparison value of NBI-ME, CTC and PGⅠalone and combined diagnosis of EGC
2.4 Hp 阳性和阴性患者NBI-ME、CTC、PGⅠ检查阳性率比较
212 例胃黏膜病变患者中,Hp 阳性116 例(Hp阳性组),阴性96 例(Hp 阴性组)。 Hp 阳性组NBIME、CTC、PGⅠ检查阳性率均高于Hp 阴性组(P <0.05),差异均有统计学意义。 见表3。
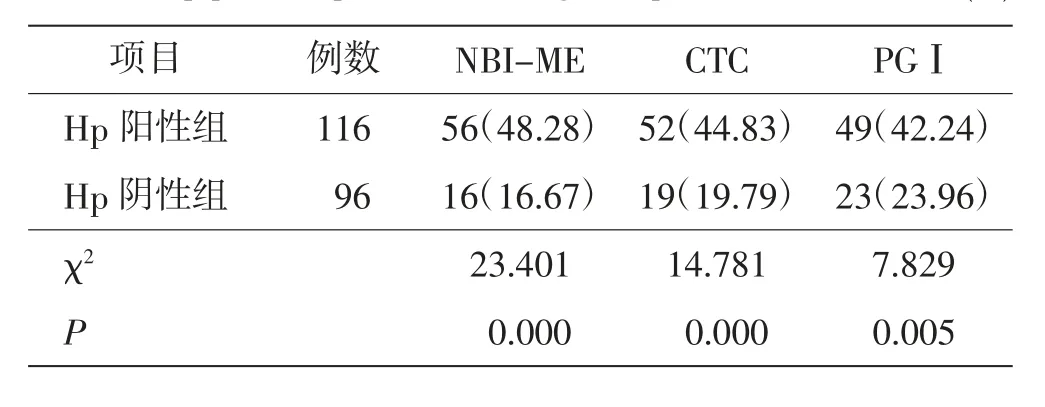
表3 Hp 阳性和阴性患者NBI-ME、CTC、PGⅠ检查阳性率比较 例(%)Tab. 3 Comparison of positive rates of NBI-ME, CTC and PGⅠbetween Hp positive patients and negative patientscases(%)
3 讨论
胃癌是发病率和死亡率较高的恶性肿瘤,对人类生命和健康产生严重威胁。虽然近年来随着中国预防保健和医疗卫生水平的提高, 中国胃癌发病率趋于稳定,但随着人口老龄化的加剧,胃癌的总发病人数还会显著增加[11]。 尽管根治性手术可切除肿瘤、清扫腹部淋巴结, 但患者的预后与临床分期密切相关[12],有报道显示Ⅰ期胃癌患者接受根治性切除手术后,5 年生存率可达到91.8%,而Ⅱ、Ⅲ期患者仅为80.2%、39.5%[13]。 尽管目前有癌胚抗原、糖类抗原等多种肿瘤标志物应用于胃癌的临床诊断, 但在EGC 的诊断方面灵敏度和特异度尚有待提高[14]。
NBI-ME 是近年来应用于临床的内镜检查新技术,这项技术应用短波长和窄频带照明,明显提高了血红蛋白的窄波蓝光作用,使医师能够更清晰地观察病灶。 与传统的胃镜比较,NBI-ME 可更好地显示病灶轮廓、胃黏膜表层和微血管的形态,并对正常胃黏膜和微小病灶能够较好地区分。 但NBI-ME 技术无法观察深层微血管结构,因此对于微血管侵及深层的胃黏膜、病情进一步发展时不能得到及时诊断。另外,内镜检查仅可尽量靠近病灶,但不能触及,一旦不小心触及病灶,可能造成黏膜损伤、出血,并对检查结果产生影响[15,16]。 因此,单纯应用NBI-ME 对早期胃癌的诊断存在一定局限性。CTC 是逃过机体免疫监视系统,由原发灶进入血液循环的肿瘤细胞。 研究表明当肿瘤直径在1 mm 左右时,患者的血液循环内即可检测出CTC 的存在,这是CT、正电子发射计算机体层摄影术(positron emission tomography,PET)等影像学检查方法所无法实现的[17]。 外周血CTC 的存在与肿瘤的临床分期、复发、转移密切相关,检测CTC 可早期发现转移的肿瘤细胞, 有利于患者的早期治疗,改善预后[18]。 胃癌患者早期即存在血液运行转移,外周血CTC 检测可作为EGC 诊断的重要指标。 Kang HM等[7]研究对比分析了116 例胃癌患者和31 例健康志愿者的临床资料,发现外周血CTC 检测对EGC 检测的灵敏度和特异度可达到85.3%和90.3%, 表明外周血CTC 可作为EGC 诊断有效的生物学指标。
PG 是胃蛋白酶的前体, 其血液含量可反映胃黏膜的功能,可作为胃癌发生、进展的肿瘤标志物。根据其免疫活性可分为PGⅠ和PGⅡ两类,PGⅠ主要由胃黏膜主细胞和颈黏液细胞分泌, 当胃体部萎缩,主细胞和颈黏液细胞数量减少时,PGⅠ分泌量下降,其血液含量降低, 故血清PGⅠ水平可反映胃体萎缩的严重程度;PGⅡ受胃黏膜萎缩影响较小,在病变早期阶段,PGⅠ水平会明显降低, 而PGⅡ多正常或轻度代偿性升高,故检测PGⅠ的血清含量可反映EGC 黏膜腺体的萎缩程度和分泌功能, 可作为EGC 有效的诊断指标之一。笔者研究发现,NBI-ME、CTC、PGⅠ检查阳性率在良性组、 癌前病变组、EGC 组逐级增加,组间两两比较差异也有统计学意义,表明3 项检查对EGC 病变具有较高的阳性率, 可用于EGC 的诊断。ROC 曲线分析3 项指标联合诊断EGC 曲线下面积最大, 表明NBI-ME、CTC、PGⅠ联合诊断对EGC 诊断价值最大,联合诊断可弥补NBI-ME 诊断局限性、PGⅠ检查的特异度不足和CTC 灵敏度的不足, 提高了EGC 诊断准确率。
Hp 感染是胃癌发生的重要因素,与胃溃疡、非萎缩性胃炎、萎缩性胃炎、胃癌的发生密切相关,Hp 可加剧胃黏膜炎症,并持续破坏胃上皮,诱发胃黏膜萎缩和肠化生,促进胃癌的形成,Hp 阳性患者腺体萎缩可更明显,并可抑制PGⅠ的合成和分泌[19]。 笔者研究发现,Hp 阳性组NBI-ME、CTC、PGⅠ检查阳性率均高于Hp 阴性组, 表明Hp 感染可导致PGⅠ合成减少,并加重胃黏膜损伤,成为胃癌发病的促进因素,并增加NBI-ME、CTC 的阳性率。抗生素、铋制剂及一些具有抗菌活性的中药均可在一定程度上抑制Hp 生长,影响Hp 的活性,可能导致检测结果呈现假阴性,并对研究结果产生一定影响,进一步的研究中应将具有服用上述药物的患者排除,避免药物对Hp 检测的影响。
综上所述,NBI-ME 技术、CTC 及血清PGⅠ联合检测在EGC 诊断中具有较高的临床价值, 可为EGC的早期诊断和临床干预提供参考依据。 另外,EGC 的发生与Hp 感染密切相关, 上述3 项指标联合Hp 有望在胃癌风险评估、EGC 诊断方面发挥更大的作用。
