生物质炭对土壤解磷菌分布及磷转化的影响研究进展
2024-01-30邢肖毅尹丹红张亚丽卿如冰倪绯
邢肖毅 尹丹红 张亚丽 卿如冰 倪绯
邢肖毅,尹丹红,张亚丽,等. 生物质炭对土壤解磷菌分布及磷转化的影响研究进展[J].江苏农业学报,2023,39(8):1784-1792.
doi:10.3969/j.issn.1000-4440.2023.08.019
收稿日期:2022-12-12
基金项目:湖南省自然科学基金项目(2022JJ50225、2022JJ50196、2022JJ50228);湖南省教育厅自然科学基金项目(20B529)
作者简介:邢肖毅(1988-),女,陕西西安人,博士,讲师,主要研究方向为微生物生态学。(E-mail)357903295@qq.com
通讯作者:倪 绯,(E-mail)121525036@qq.com
摘要:中国农田普遍缺磷,而磷肥易于被土壤颗粒固定,利用率低,导致土壤中留存大量固定态磷。激活土壤解磷菌是解决土壤有效磷缺乏与固定态磷素过量累积矛盾的关键。近年来,在生物质炭施用对土壤解磷菌群落影响方面的研究取得了一系列进展。本文综述了生物质炭施用对土壤解磷菌数量、群落组成、多样性、互作关系以及土壤磷酸酶活性的影响。最后,本文分析了目前生物质炭施用与解磷菌关系研究中的局限,并进行了研究展望,可以为科学施用生物质炭、活化土壤磷库提供理论基础和应用依据。
关键词:生物质炭;解磷菌;农田土壤;解磷效应
中图分类号:X172 文献标识码:A 文章编号:1000-4440(2023)08-1784-09
Research progress of the effect of biochar on distribution and phosphorus transformation of soil phosphorus-solubilizing microorganism
XING Xiao-yi1 YIN Dan-hong1,2 ZHANG Ya-li1 QING Ru-bing1 NI Fei1
(1.Department of Agroforestry Ecology, Shaoyang College, Shaoyang 422000, China;2.School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China)
Abstract:Phosphorus (P) deficiency exists widely in agricultural soils of China. However, the utilization rate of P fertilizer was low due to the P fertilizer was easily fixed by soil particles, so there retained a lot of fixed P. Activating soil phosphorus-solubilizing microorganism (PSM) was the key way to resolve the contradiction between available P deficiency and excess accumulation of fixed P in agricultural soils. In recent years, a series of research progresses about the influences of biochar application on the community structure of soil PSM have been made. This article comprehensively summarized the effects of biochar application on the population, community composition, diversity and community interaction, as well as soil phosphatase activity of soil PSM. Finally, the limitations of the current research on the correlation between biochar application and PSM were analyzed, and the future research was discussed. The study can provide theoretical basis and application basis for scientific application of biochar and activation of soil phosphorus pool.
Key words:biochar;phosphorus-solubilizing microorganism;agricultural soil;phosphate-solubilizing effect
土壤有效磷缺乏現象在全球范围内广泛存在,严重制约了农业的发展。活化土壤磷库是解决土壤有效磷不足的关键。生物质炭为土壤中解磷微生物创造了良好的生存环境,可能影响磷的活化。本研究拟通过对生物质炭施用对土壤解磷菌分布及磷转化的影响进行综述,旨在揭示生物质炭在调控土壤解磷菌与土壤磷转化关系中的作用,为生物质炭的科学施用提供依据。
1 土壤磷素缺乏与盈余共存
磷素是植物生长必需的大量元素之一,对植物的新陈代谢和生长发育具有重要作用。土壤中总磷含量较为丰富,但是磷素在土壤中易被固定,有效性低,目前全球70%的耕地有效磷含量无法满足作物正常生长发育,尤其是中国南方红壤区[1]。一般认为,土壤有效磷含量低于10 mg/kg的土壤即为缺磷土壤。而在中国湖南、江西、广西、云南等典型红壤区,土壤有效磷含量多数为5 mg/kg左右[2-5],远低于世界平均水平。磷素缺乏严重制约农业生产,影响作物产量和品质。据研究,农业耕地中2/3的中低产田属于土壤有效磷含量小于10 mg/kg的农田。以大豆为例,土壤有效磷含量10 mg/kg的土壤与30 mg/kg的土壤相比,大豆产量减少了约20%,脂肪含量和蛋白质含量降低了约25%[6]。
为补充土壤有效磷不足,磷肥被大量施用。然而,磷肥利用率很低,当季利用率仅为10% ~25%,其余75% ~90%被土壤中的钙、铁、铝等矿物离子吸附[7-8],导致土壤中蓄积大量固定态磷。中国自20世纪70年代中期,土壤中的磷素开始盈余[9]。截至1992年,土壤磷累积量达6×107 t[10]。针对土壤固定态磷过量累积及有效磷不足的现实,探究土壤中磷的高效利用途径,活化土壤磷库,是土壤磷营养管理的重点。
2 生物质炭对土壤磷活化的影响
生物质炭是在氧气受限的环境中热解生物质(例如作物茎叶、木材、畜禽粪便等)时获得的一种芳香族和富含碳的固体副产物[11]。生物质炭本身富含磷元素,全磷和有效磷含量较高。例如350 ~550 ℃炭化温度下制备的玉米秸秆和小麦秸秆生物质炭全磷含量分别为8.37 g/kg和2.47 g/kg[12],400 ℃制备的稻壳生物质炭和玉米秸秆生物质炭有效磷含量分别为287.12 mg/kg [13]和15.80 mg/kg[14]。因此,生物质炭施入土壤后可直接补充外源有效磷。很多研究者已发现生物质炭施用可显著提高土壤有效磷含量[4,12-18]。值得注意的是,生物质炭施入土壤后,土壤增加的有效磷的量高于生物质炭本身含有的有效磷的量。例如Zhai等[14]将有效磷含量为15.80 mg/kg的玉米秸秆生物质炭以8%的含量(即80 g/kg)施入酸性红壤和碱性潮土中,土壤有效磷含量分别从3.00 mg/kg和13.00 mg/kg显著增加至 46.00 mg/kg和137.00 mg/kg。Liu等[18]将有效磷含量为287.12 mg/kg的稻壳生物质炭以40 t/hm2(即17.8 g/kg)的含量施入红壤、盐渍土中,土壤有效磷含量分别从2.47 mg/kg和3.77 mg/kg 显著增加至 16.18 mg/kg和21.58 mg/kg。因此生物质炭对土壤有效磷的增加不仅来自生物质炭自身磷的直接释放,还包括土壤固定态磷的活化[4,15]。
3 解磷菌是磷活化的主要驱动者
土壤中分布着大量解磷菌,可分别作用于无机磷、有机磷或同时作用于二者,将无效磷转化为生物有效态磷,是土壤磷活化的主要承担者[19]。解磷菌的研究始于1903年,距今已近120年[20]。大量研究结果表明,土壤中解磷菌丰度和组成与解磷性能显著相关[21-26]。例如Fraser等[22-23]发现phoD解磷微生物的丰度与催化土壤有机磷矿化的碱性磷酸酶活性显著相关。易艳梅等[26]研究发现,盐渍土中解磷细菌数量与土壤有效磷含量显著相关,假单胞杆菌属(Pseudomonas)、芽孢杆菌属(Bacillus)和黄单胞杆菌属(Flavobacterium)是磷活化的主要驱动者。王敦刚等[27]针对茶园土的研究发现,土壤有效磷含量与phoD解磷微生物中Betaproteobacteria的相对丰度呈显著正相关。除了基于大田采样证明解磷菌对于磷活化的重要作用外,还有很多研究通过外源接种解磷菌,证明了解磷菌对土壤磷素供应的积极作用[28-30]。例如Rafique等[28]分别接种解磷菌Bacillus subtilis strain 18MZR 和Lysinibacillus fusiformis strain 31MZR于土壤中进行盆栽试验,发现土壤中有效磷含量增加15% ~25%。Wu等[30]发现接种解磷菌Bacillus aryabhattai和Pseudomonas auricularis可显著提高油茶叶片及根际土壤中有效磷含量。生物质炭可以为微生物提供碳源及其他营养元素[31],创造大小不一的孔隙供微生物定殖及免于被取食[32-33],提高土壤持水力,为微生物创造更有利于生存的环境[34]等,因此有利于解磷菌的生长。
4 生物质炭对解磷菌的影响
4.1 土壤中解磷菌群落的研究方法
尽管土壤中解磷菌极为丰富,但解磷菌在自然状态下,多处于休眠或潜在活跃状态,解磷效率较低[35],激发其生长和活性,是提高土壤供磷能力的关键。土壤中解磷微生物群落分布的研究方法主要有培养基分离计数法[17,21,36],常用的分离培养基有磷酸三钙无磷培养基、无机磷发酵培养基、有机磷培养基、Piskovskaya琼脂培养基等;对土壤细菌16 S rRNA进行测序,分析其中典型解磷菌(例如Microbacteriaceae、Rhizobiaceae)的相对丰度[16,18,29 ],以及采用特定引物扩增特定类群解磷菌,例如对Brevundimonas进行扩增计量[37]等。更重要的是,近年来,随着分子生物学技术的发展,解磷菌編码基因成为研究解磷菌的重要方法。目前,国内外有关有机解磷菌解磷基因的研究主要集中在碱性磷酸酶编码基因,包括phoA、phoD和phoX 3种类型[38]。其中phoD由于分布广泛,活性强,多样性高,研究相对深入。无机磷解磷菌的研究主要集中在与葡萄糖酸、柠檬酸合成有关的基因[39],相关的编码基因有gcd、pqqC、gltA等。除此之外,与磷的吸收利用有关的其他基因,例如C-P键断裂酶基因(phnJ)也受到了部分研究者的关注[36]。近二三十年的研究结果表明,生物质炭施用可从多个方面影响解磷菌的分布,从而提高土壤供磷能力[16-18,40]。
4.2 生物质炭对解磷菌数量的影响
生物质炭施用可显著提高土壤中解磷菌的数量,提升率甚至可高达数百倍。例如赵学通等[17]采用无机磷发酵培养基筛选法进行试验,发现常规施肥配合30 t/hm2生物质炭相较于常规施肥,解磷菌数量提升了291.74%。郑慧芬等[41]采用磷酸三钙无磷培养基對10 t/hm2、20 t/hm2、40 t/hm2生物质炭施用条件下茶园红壤的无机磷解磷菌进行了计数,结果显示,随施用量的增加,解磷菌数量增加,相对于不施用生物质炭,解磷菌数量的增幅为150.0% ~337.3%。目前更多的研究针对解磷菌功能基因开展,例如对phoD、pqqC等进行定量PCR,同样发现生物质炭可显著提高其基因拷贝数[42-44]。例如,Yang等[42]发现生物质炭施用显著提高了酸性红壤中phoD的丰度。Pu等[43]发现生物质炭施用显著提高了黑土中pqqC的丰度。但也有研究者发现,生物质炭施用对解磷菌数量的影响较小[43,45-46],甚至导致其丰度降低[47]。例如,Gao等[45]和Pu等[43]均发现生物质炭施用未显著改变土壤中phoC、phoD、gcd的拷贝数。上述矛盾的试验结果主要是因为生物质炭施用量与土壤解磷菌增加量的关系受土壤性质的影响,对于有效磷更为缺乏、pH较低的红壤,生物质炭施用对解磷菌的影响更为强烈。当土壤自身具有较高的有效磷含量,或者随生物质炭引入了较多有效磷时,缓解了微生物的磷饥饿,无需增加对磷酸酶的分泌,因此相应编码基因的丰度不发生大的变化,甚至当有效磷含量过高时,会抑制磷酸酶活性以及相应基因的丰度[47]。因此,对于低磷土壤,生物质炭施用对解磷菌丰度的积极影响更加显著[46]。但值得注意的是,“低磷”的定义需要因地域、作物而改变,而不能以磷含量简单划分。例如在Pu等[43]的研究中,磷投入量为33 kg/hm2,按照以往的报道[46]可认为属于低磷投入,但此时生物质炭并没有提高解磷菌丰度,这是因为尽管磷投入量较低,但是已经可以满足作物和微生物的需求。而Gao等[45]发现生物质炭没有显著改变解磷菌丰度一方面是因为土壤本身有效磷含量较高(约350 mg/kg),另一方面,可能也与土壤酸碱度接近中性(pH=6.45)有关。另外,编码有机酸及磷酸酶合成的基因众多,研究所选择的基因可能并不能真实反映解磷菌的数量[48]。最后,也可能是因为并非所有的解磷菌都是具有生物活性的[49],而生物质炭可能更多地作用于有活性的解磷菌,因此在DNA水平上未表现出明显变化。生物质炭影响解磷菌数量,并最终影响土壤有效磷含量,但土壤有效磷含量的增加程度往往不及解磷菌。在赵学通等[17]、陈敏等[21]及郑慧芬等[41]的研究中,生物质炭处理条件下,土壤有效磷含量的增加量均远低于解磷菌数量增加量。其中在郑慧芬等[41]的研究中,解磷菌数量增幅为150.0% ~337.3%时,有效磷含量的增幅为61.0% ~153.9%。这可能是因为有效磷含量的增加滞后于解磷菌数量。
自从解磷菌的功能被证实以来,很多研究者将高效解磷菌接种于土壤以提高有效磷含量,取得了良好的效果[50]。但是外源解磷菌接种存在定殖率低的问题。近年来的研究发现,生物质炭施用不仅有助于增加土壤土著解磷菌的数量,还会促进外源解磷菌的定殖。例如杜慧婷[51]发现施用水稻秸秆生物质炭可促进外源接种解磷菌的生长,胶质芽孢杆菌和巨大芽孢杆菌的数量分别增加了27.5%和9.5%。Zheng等[29]通过将6种不同原料制成的生物质炭与解磷菌群落(7种不同属典型解磷菌混合)配合施入土壤,结果显示生物质炭施用显著提高了解磷菌的存活率,相对于不施用生物质炭处理,增幅在6.86% ~24.24%。因此,生物质炭和解磷菌共同施用往往可以实现更好的解磷效果。
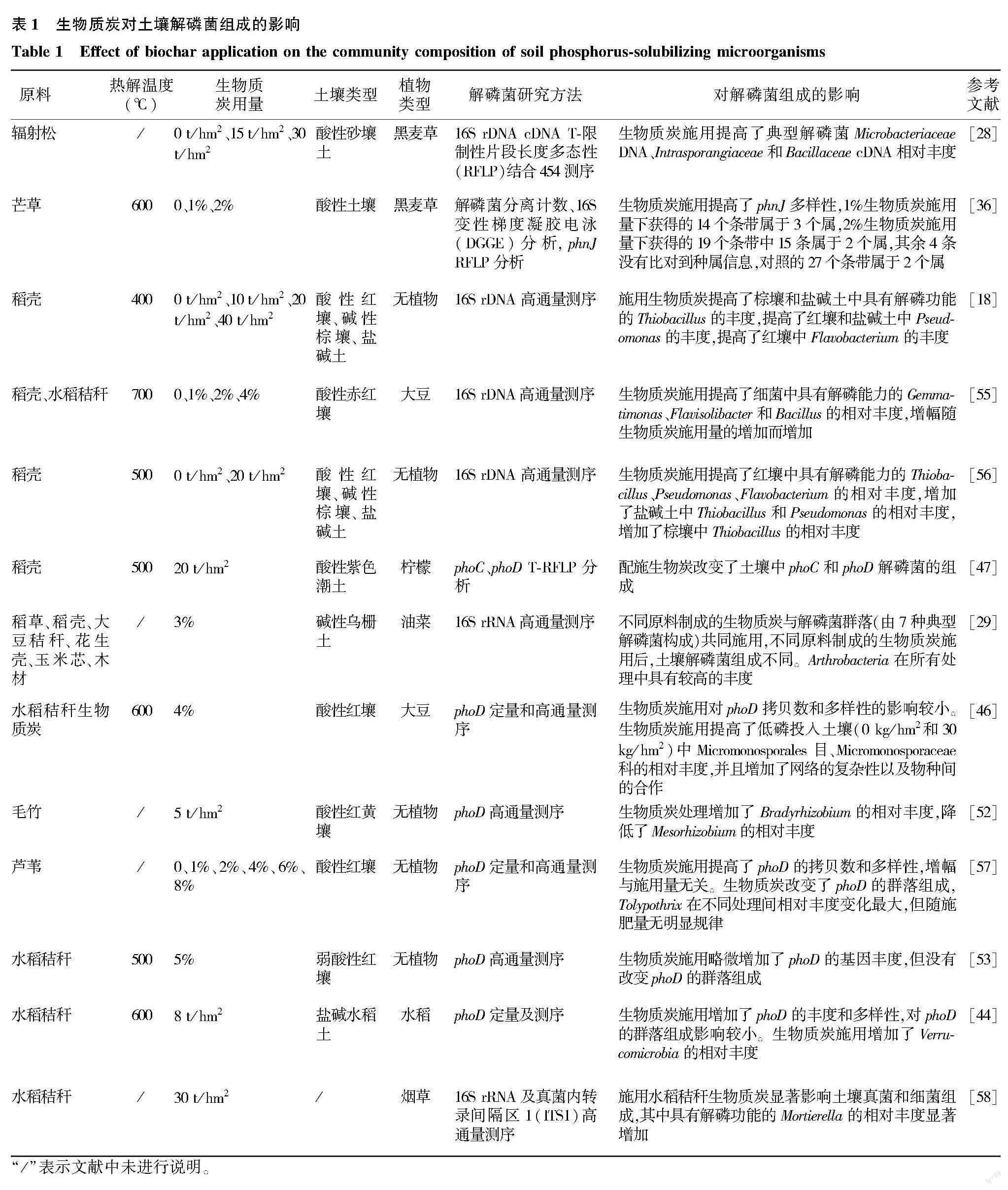
4.3 生物质炭对解磷菌组成的影响
解磷菌在土壤中的种类丰富,在细菌、真菌、放线菌中均有分布。目前已经报道的解磷菌有30多个属,例如属于细菌的芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、硫杆菌属(Thiobacillus)、黄杆菌属(Flavobaccterium)、微杆菌属(Microbacterium)、短波单胞菌属(Brevundimonas)等,属于真菌的青霉属(Penicillium)、曲霉属(Aspergillus)、链格孢属(Alternaria)、被孢霉属(Mortierella)等,以及属于放线菌的链霉属(Streptomyces)[8,50]。尽管以往的研究认为解磷真菌的解磷能力超过细菌[19],但土壤中解磷真菌的数量远不及解磷细菌,目前生物质炭对解磷菌组成影响的研究主要集中于解磷细菌(表1)。有研究通过对土壤总细菌进行测序,分析典型解磷菌的相对丰度,从而判断施用生物质炭对土壤解磷菌组成的影响。例如Liu等[18]将稻壳生物质炭施用于3种不同类型的农田土壤,对土壤总细菌进行高通量测序,发现具有解磷功能的Thiobacillus、Pseudomonas和Flavobacterium的相对丰度、磷酸酶活性以及相应土壤有效磷含量不同程度地增加。也有研究者选用某个属的特异性引物,分析特定类型解磷菌对生物质炭的响应。例如Fox等[37]采用特异性引物对土壤典型解磷菌Brevundimonas进行了扩增,发现1%和2%生物质炭施用条件下Brevundimonas丰度相较于不施用生物质炭处理分别提高了5.32倍和189倍。现在越来越多的研究直接对磷酸酶编码基因(例如phoD、phoC等)进行测序以分析群落组成。不同土壤中解磷菌的种类差异巨大,对生物质炭响应的类群也各不相同。例如Tian等[46]基于高通量测序技术分析了土壤phoD解磷菌组成特征,发现施用生物质炭显著增加了酸性红壤中Micromonosporaceae的相对丰度。朱青和等[52]同样基于高通量技术发现施用生物质炭增加了酸性红黄壤中Bradyrhizobium的相对丰度,降低了Mesorhizobium的相对丰度。值得注意的是,解磷菌组成对施用生物质炭的敏感度不及解磷菌丰度[44,53],但前者与磷转化的关系似乎更为密切[46]。例如Lu等[53]发现施用生物质炭略微增加了酸性红壤中phoD的基因丰度,但没有改变phoD群落组成。Tian等[46]则发现,生物质炭施用后,碱性磷酸酶活性的增加与phoD丰度无关,而受其组成的影响。但目前对解磷菌组成的研究还不多,上述推测还有待进一步研究。
4.4 生物质炭对解磷菌多样性的影响
生物质炭富含直径>200 nm的大孔隙,能够满足多数细菌的栖息需求[32],为微生物提供了栖息地和庇护所[31],因此生物质炭施用往往可提高土壤解磷菌的多样性[36,44,54]。例如杨文娜等[54]采用T-限制性片段长度多态性(RFLP)技术分析了解磷菌phoC和phoD基因的多样性,发现化肥配施生物质炭相较于单施化肥,phoC和phoD基因丰富度、均匀度、多样性均显著上升。其他研究也得出了相似的结论[44]。其他类型解磷菌对生物质炭也有相似的响应。例如,Fox等[36]采用RFLP结合454测序对phnJ基因进行了研究,发现未施用生物质炭的土壤中获得了27个条带,其中17个条带属于Bradyrhizobium,10个条带属于Acidophilium multivorum。施用1%生物质炭的土壤获得的14个条带除属于上述2个属之外,还有2个条带属于Rhizobiales。而施用2%生物质炭的土壤得到19个条带,除4个条带未比对上明确种属信息外,有10个条带和5个条带分别从属于Bradyrhizobium和Acidophilium multivorum,即相较于对照,解磷菌各种属的占比更加均匀。但是也有研究发现生物质炭施用对解磷菌多样性影响较小[52],甚至导致多样性降低[29]。例如朱青和等[52]发现施用毛竹生物质炭对酸性红黄壤phoD功能菌的Chao1指数、Simpson指数和Shannon指数均没有显著影响。Zheng等[29]基于16S rRNA高通量测序,参照以往文献中报道的典型解磷菌的分类信息,将30个属(包括Rhizobium leguminosarum、Paenibacillus panacisoli、Rhodococcus opacus等)视为解磷菌群落加以分析,发现未施用生物质炭的土壤解磷菌群落Shannon指数不同程度地高于施用6种不同原料制成的生物质炭的处理。这可能是因为,该研究除了施用生物质炭外,还接种了7种不同的外源解磷菌(包括在所选择的30个属中),这些解磷菌快速生长成为优势类群,因此降低了多样性指数。总体而言,目前对生物质炭施用条件下解磷菌多样性的研究还较缺乏,有待于进一步研究。
4.5 生物质炭对解磷菌互作关系的影响
如前文所述,外源解磷菌接种过程中,菌群定殖率比较低,这可能是由于土著解磷菌的排斥作用。以往的研究发现,将解磷菌接种于灭菌土壤中,其存活数量和解磷效果均好于接种于非灭菌土壤[59-60]。由于外源解磷菌与土壤土著解磷菌生态位高度重叠,因而产生了竞争作用。而土著解磷菌由于“先天优势”,在竞争中更易获胜[61],从而影响外源解磷菌的定殖。施用生物质炭被认为可以降低来自土著微生物的竞争,因此可能成为解决外源菌定殖困难的有效措施[32]。例如Saxena等[62]对比了仅接种解磷菌Bacillus和Bacillus+生物质炭处理下土壤中Bacillus的数量,发现后者相较于前者,数量增加了62.1%。Zheng等[29]通过将6种不同原料制成的生物质炭与解磷菌群落(7种不同属典型解磷菌混合)配合施入土壤,发现施加生物质炭显著提高了解磷菌的存活率,增幅为6.86%~24.24%。一般认为,出现上述现象的原因主要在于生物质炭为微生物提供了养分、栖息地、庇护所等。另外,丰富的土壤养分有助于缓解环境微生物之间的竞争关系,甚至激发更广泛的合作[63]。虽然现阶段直接观测复杂微生物体系间的种间互作关系仍无法实现,但生态网络分析为探索互作关系提供了一种有力的工具[49]。通过生态网络中的拓扑学特性分析,可在一定程度上揭示解磷菌之间的协作或竞争程度。目前生物质炭对微生物互作关系影响的研究,主要是基于土壤总微生物群落开展的。例如Chen等[64]发现施用生物炭改变了土壤细菌和真菌的竞争关系。马泊泊等[65]进一步证实,施用生物质炭会诱发土壤细菌-真菌群落之间更加复杂的网络关系,增强细菌内部以及细菌与真菌之间的积极作用。因此,我们推测施用生物质炭可能会促进土壤中解磷菌间的合作。近期有研究报道施用生物质炭提高了酸性红壤中含phoD基因解磷菌的网络复杂性和连接紧密性[46]。但尚未有文献报道生物质炭对解磷菌之间竞争或合作关系的探讨,还有待于进一步研究。
4.6 生物質炭对磷酸酶活性的影响
磷酸酶活性是反映土壤有机磷矿化潜力的重要指标,根据其适宜的pH分为酸性磷酸酶和碱性磷酸酶。其中碱性磷酸酶主要由土壤解磷菌分泌,而酸性磷酸酶由植物根系和解磷菌共同分泌[46],因此,碱性磷酸酶活性与磷的矿化能力的关系更加密切,并且对生物质炭施用更敏感。一般而言,生物质炭对酸性磷酸酶活性影响较小[41,46,58],甚至导致酶活性降低[14]。这主要是因为生物质炭多为碱性,施入后会提高土壤pH,影响程度取决于生物质炭对土壤pH的提高程度。对于碱性磷酸酶,由于生物质炭可为解磷菌提供碳源、能源以及物理保护,因此一般认为施用生物质炭有助于提高土壤碱性磷酸酶活性[44,58,66]。但也有研究得出了相反的结果[53,67]。有效磷含量的差异是导致上述矛盾结果的最主要原因[46]。根据资源配置理论,当有效磷不足时,酶合成增加,而有效磷充足时酶合成则会下降。因此当有效磷(包括土壤本底有效磷以及外源输入有效磷)含量较高时,施用生物质炭对磷酸酶活性的影响很小,甚至导致酶活性降低[68]。例如Lu等[53]将有效磷含量为41.33 mg/kg的生物质炭以5%的量施入有效磷含量为33.45 mg/kg的土壤时,碱性磷酸酶活性降低。还有研究者发现生物质炭施用量也会影响生物质炭与碱性磷酸酶活性的关系。例如Bhaduri等[67]发现在生物质炭施用量较低时(2.5%),磷酸酶活性增强,而施用量较大时(5.0%和8.0%),酶活性反而有所降低。其他研究者也得出了相似的结论[53,68-69]。其主要的原因便是较高的生物质炭引入了较高的有效磷,缓解了磷缺乏。另一方面的原因在于生物质炭具有较强的吸附性能,导致酶被吸附,抑制了土壤酶的催化性能[53]。综上,在有效磷含量较低的土壤中,施用生物质炭可更显著地提高磷酸酶活性,最终提高有效磷含量[46]。
5 研究展望
综上所述,近二三十年,研究者围绕生物质炭调控有效磷含量的微生物机制开展了很多研究,初步证明生物质炭可对解磷菌数量、组成、多样性等产生积极的影响,甚至影响解磷菌间的互作关系。但是,生物质炭对解磷菌影响的研究仍很不足,仍有很多问题有待进一步研究。
(1)深化分子生物学技术在生物质炭-解磷菌关系研究中的应用。近几十年以核酸技术为核心的分子生物学技术的发展,为揭示解磷菌的群落结构提供了新的方法。但是,目前研究者对解磷基因的认识还不全面,仅有少数基因(例如phoD、phoX、phnJ、gcd等)被应用于解磷菌研究,而不同的生态环境下功能基因的作用差异较大。另外,解磷功能基因的研究主要集中在DNA水平,仅能揭示微生物的存在与否,不能揭示微生物的活性。因此,未来研究需继续探究解磷菌功能基因的种类及评价不同土壤环境下各功能基因的相对重要性,并针对mRNA更深入地分析对生物质炭敏感的类群。
(2)探索生物质炭与解磷菌接种之间的协同增效机制。生物质炭与解磷菌之间的关系较为复杂,一方面,解磷菌可激活生物质炭本身携带的大量非活性磷,另一方面,生物质炭可促进外源解磷菌的定殖。目前很多研究已证实二者在增加土壤有效磷含量方面的协同效应。未来的研究可进一步阐明生物质炭与解磷菌的协同增效机制,例如生物质炭对土著-外源解磷菌关系的调控。
(3)基于关键物种和群落关系调控解磷功能。微生物群落中存在着关键物种或类群,对生态功能至关重要[63]。另外,微生物群落之间存在高度复杂的相互作用,能够协作实现高效的代谢功能。未来的研究可采用生态网络分析等技术识别和探究解磷菌关键物种和种群互作方式及对生物质炭施用的响应方式,通过合理干预实现高效的解磷效应。
(4)针对不同缺磷状态的土壤建立生物质炭施用模式。生物质炭施用后对解磷菌和土壤解磷效应的影响受诸多因素的调控,而土壤本底有效磷含量被认为是最主要的因素[46,70]。因此可针对磷含量不同的土壤建立相應的生物质炭施用模式,包括生物质炭类型、施用量、施用时间等,为生物质炭的高效使用提供技术指导。
参考文献:
[1] 储成才,王 毅,王二涛. 植物氮磷钾养分高效利用研究现状与展望[J]. 中国科学:生命科学,2021,51(10):1415-1423.
[2]王一琨,蔡泽江,冯 固. 不同磷肥调控措施下红壤磷素有效性和利用率的变化[J]. 土壤学报,2023,60(1):235-246.
[3]胡云峰. 长期不同施肥措施对旱地红壤剖面磷素形态变化与累积的影响[D]. 合肥:安徽农业大学,2022.
[4]赵隽宇,潘 波,唐 健,等. 长期施用袋控缓释肥对南方红壤中磷素形态及有效性的影响[J]. 农学学报,2022,12(11):14-19.
[5]苏丽珍,赵红敏,侯贤锋. 玉米大豆间作对红壤磷库的活化作用及其磷肥响应[J]. 中国生态农业学报,2023,31(4):558-566.
[6]郭晓双. 磷素营养水平对大豆磷素积累和产量的影响[D]. 哈尔滨:东北农业大学,2014.
[7]张登晓,高 雅,介红彬,等. 生物质炭对农田磷有效性的影响研究进展[J]. 河南农业大学学报,2021,55(2):199-205.
[8]SHARMA S B, SAYYED R Z, TRIVEDI M H, et al. Phosphate solubilizing microbes: sustainable approach for managing phosphorus deficiency in agricultural soils[J]. Springer Plus,2013,2(1):587.
[9]鲁如坤,刘鸿翔,闻大中. 我国典型地区农业生态系统养分循环和平衡研究全国和典堺地区养分循环和平衡现状[J]. 土壤通报,1996,27(5):193-196.
[10]龚子同. 人为作用对土壤环境质量的影响及对策[J]. 土壤与环境,2000,9(1):7-10.
[11]LEHMANN J. Bio-energy in the black[J]. Frontiers in Ecology and the Environment,2007,5:381-387.
[12]高 雅,饶 伟,介红彬,等. 不同质地潮土施用小麦和玉米秸秆生物质炭对玉米养分吸收和根际土壤胞外酶活性的影响[J]. 植物营养与肥料学报,2022,28(5):933-945.
[13]LIU S N, MENG J, JIANG L L, et al. Rice husk biochar impacts soil phosphorous availability, phosphatase activities and bacterial community characteristics in three different soil types[J]. Applied Soil Ecology,2017,116:12-22.
[14]ZHAI L M, CAIJI Z M, LIU J, et al. Short-term effects of maize residue biochar on phosphorus availability in two soils with different phosphorus sorption capacities[J]. Biology and Fertility of Soils,2015,51:113-122.
[15]ZWETSLOOT J, LEHMANN J, BAUERLE T, et al. Phosphorus availability from bone char in a P-fixing soil influenced by root-mycorrhizae-biochar interactions[J]. Plant and Soil,2016,408:95-105.
[16]ANDERSN C R, CONDRON L M, CLOUGH T J, et al. Biochar induced soil microbial community change: implications for biogeochemical cycling of carbon, nitrogen and phosphorus[J]. Pedobiologia,2011,54:309-320.
[17]赵学通,包 立,康宏宇,等. 秸秆生物炭对亚热带葡萄园土壤性质的影响[J]. 中国农学通报,2015,31(6):104-108.
[18]LIU S N, MENG J, JIANG L L, et al. Rice husk biochar impacts soil phosphorous availability, phosphatase activities and bacterial community characteristics in three different soil types[J]. Applied Soil Ecology,2017,116:12-22.
[19]盛 荣,肖和艾,谭周进,等. 土壤解磷微生物及其磷素有效性转化机理研究进展[J]. 土壤通报,2010,41(4):1505-1510.
[20]STALSTROM V A, BOITRAG Z K, EIN W, et al. Steriler use in garung bofindlicher organischer stroffe auf dil loslichkeit der phosphorson des tricalcium phosphate[J]. Zel Bakt,1903(11):724-732.
[21]陳 敏,杜相革. 生物炭对土壤特性及烟草产量和品质的影响[J]. 中国土壤与肥料,2015(1):80-83.
[22]FRASER T, LYNCH D H, BENT E, et al. Soil bacterial phoD gene abundance and expression in response to applied phosphorus and long-term management[J]. Soil Biology and Biochemistry,2015,88:137-147.
[23]FRASER T, LYNCH D H, ENTZ M H, et al. Linking alkaline phosphatase activity with bacterial phoD gene abundance in soil from a long-term management trial[J]. Geoderma,2015,257/258:115-122.
[24]CHEN X D, JIANG N, CHEN Z H, et al. Response of soil phoD phosphatase gene to long-term combined applications of chemical fertilizers and organic materials[J]. Applied Soil Ecology,2017,119:197-204.
[25]LUO G W, SUN B, LI L, et al. Understanding how long-term organic amendments increase soil phosphatase activities: insight into phoD-and phoC-harboring functional microbial populations[J]. Soil Biology and Biochemistry,2019,139:107632.
[26]易艳梅,黄为一. 溶磷细菌Enterobacteria sp EnHy-401对盐渍土壤中小麦生长的影响[J]. 土壤通报,2011,42(6):1371-1375.
[27]王敦刚,张俏燕,曹文超,等. 不同土地利用方式对土壤磷有效性和溶磷细菌群落结构的影响[J]. 热带作物学报,2021,42(12):3646-3654.
[28]RAFIQUE M, SULTAN T, ORTAS I, et al. Enhancement of maize plant growth with inoculation of phosphate-solubilizing bacteria and biochar amendment in soil[J]. Soil Science and Plant Nutrition,2017,63(5):460-469.
[29]ZHENG B X, DING K, YANG X R, et al. Straw biochar increases the abundance of inorganic phosphate solubilizing bacterial community for better rape (Brassica napus) growth and phosphate uptake[J]. Science of the Total Environment,2019,647:1113-1120.
[30] WU F, LI J R, CHEN Y L, et al. Effects of phosphate solubilizing bacteria on the growth, photosynthesis, and nutrient uptake of Camellia oleifera Abel[J]. Forests,2019,10:348.
[31]WARNOCK D D, LEHMANN J, KUYPER T W, et al. Mycorrhizal responses to biochar in soil-concepts and mechanisms[J]. Plant and Soil,2007,300:9-20.
[32]QUILLIAM R S, GLANVILLE H C, WADE S C, et al. Life in the ‘charosphere’ -does biochar in agricultural soil provide a signifcant habitat for microorganisms?[J]. Soil Biology and Biochemistry,2013,65:287-293.
[33]SINGH H, NORTHUP B K, RICE C W, et al. Biochar applications infuence soil physical and chemical properties, microbial diversity, and crop productivity: a meta-analysis[J]. Biochar,2022,4:8.
[34]SIDDIQUI A R, NAZEER S, PIRACHA M A, et al. The production of biochar and its possible effects on soil properties and phosphate solubilizing bacteria[J]. Journal of Applied Agriculture and Biotechnology,2016,1(1):27-40.
[35]COLLAVINO M M, SANSBERRO P A, MROGINSKI L A, et al. Comparison of in vitro solubilization activity of diverse phosphate-solubilizing bacteria native to acid soil and their ability to promote Phaseolus vulgaris growth[J]. Biology and Fertility of Soils,2010,46:727-738.
[36]FOX A, KWAPINSHI W, GRIFFITHS B S, et al. The role of sulfur- and phosphorus- mobilizing bacteria in biochar-induced growth promotion of Lolium perenne[J]. FEMS Microbiology Ecology,2014,90(1):78-91.
[37]FOX A, GAHAN J, KWAPINSKI O, et al. Miscanthus biochar promotes growth of spring barley and shifts bacterial community structures including phosphorus and sulfur mobilizing bacteria[J]. Pedobiologia,2016,59:195-202.
[38]馬 凯,王效昌,谢嘉慧,等. 沉积物解磷菌的研究进展:分布、解磷能力及功能基因[J]. 农业资源与环境学报,2022,40(1):76-85.
[39]魏晓梦. 中国典型农田土壤解磷菌群落构建机制[D]. 长沙: 中国科学院亚热带农业生态研究所,2020.
[40]LIU X, ZHENG J, ZHANG D, et al. Biochar has no effect on soil respiration across Chinese agricultural soils[J]. Science of the Total Environment,2016,554:259-265.
[41]郑慧芬,吴红慧,翁伯绮,等. 施用生物炭提高酸性红壤茶园土壤的微生物特征及酶活性[J]. 中国土壤与肥料,2019(2):68-74.
[42]YANG C D, LU S G. Straw and straw biochar differently affect phosphorus availability, enzyme activity and microbial functional genes in an Ultisol[J]. Science of the Total Environment,2022,805:150325.
[43]PU J H, JIANG N, ZHANG Y L, et al. Effects of various straw incorporation strategies on soil phosphorus fractions and transformations[J]. GCB-Bioenergy,2023,15:88-98.
[44]LIU L, ZHANG S R, CHEN M M, et al. Femodified biochar combined with mineral fertilization promotes soil organic phosphorus mineralization by shifting the diversity of phoD harboring bacteria within soil aggregates in saline alkaline paddy soil[J]. Journal of Soils and Sediments,2023,23:619-633.
[45]GAO S, DELUCA T H. Wood biochar impacts soil phosphorus dynamics and microbial communities in organically-managed croplands[J]. Soil Biology and Biochemistry,2018,126:144-150.
[46]TIAN J H, KUANG X Z, TANG M T, et al. Biochar application under low phosphorus input promotes soil organic phosphorus mineralization by shifting bacterial phoD gene community composition[J]. Science of the Total Environment,2021,779:146556.
[47]杨文娜,余 泺,罗东海,等. 土壤phoC和phoD微生物群落对化肥和有机肥配施生物炭的响应[J]. 环境科学,42(2):1040-1049.
[48]RODRíGUEZ H, FRAGA R, GONZALEZ T, et al. Genetics of phosphate solubilization and its potential applications for improving plant growth-promoting bacteria[J]. Plant and Soil,2006,287:15-21.
[49]LENNON J T, JONES S E. Microbial seed banks: the ecological and evolutionary implications of dormancy[J]. Nature Reviews Microbiology,2011,9:119-130.
[50]池景良,郝 敏,王志学,等. 解磷微生物研究及应用进展[J]. 微生物学杂志,2021,41(1):1-7.
[51]杜慧婷. 生物炭對胶质芽孢杆菌(Bacillus Mucilaginosus)和巨大芽孢杆菌(Bacillus Megaterium)活性的影响及解磷机制[D]. 沈阳:沈阳农业大学,2020.
[52]朱青和,马 壮,裘 立,等. 竹炭和竹炭包膜复合肥对毛竹林土壤磷有效性的影响及其微生物学机理[J]. 植物营养与肥料学报,2022,28(3):450-459.
[53]LU H W, XU C X, ZHANG J C, et al. The characteristics of alkaline phosphatase activity and phoD gene community in heavy-metal contaminated soil remediated by biochar and compost[J]. Bulletin of Environmental Contamination and Toxicology,2022,109:298-303.
[54]杨文娜,余 泺,罗东海,等. 化肥和有机肥配施生物炭对土壤磷酸酶活性和微生物群落的影响[J]. 环境科学,2022,43(1):540-548.
[55]邓金环. 生物炭改良酸性土壤及提高大豆硅磷吸收转化的机理研究[D]. 广州:华南农业大学,2019.
[56]刘赛男. 生物炭影响土壤磷素、钾素有效性的微生物生态机制[D]. 沈阳:沈阳农业大学,2016.
[57]WANG Y Z, ZHANG Y P, ZHAO H, et al. The effectiveness of reed-biochar in mitigating phosphorus losses and enhancing microbially-driven phosphorus dynamics in paddy soil[J]. Journal of Environmental Management,2022,314:115087.
[58]ZHANG C S, LIN Y, TIAN X Y, et al. Tobacco bacterial wilt suppression with biochar soil addition associates to improved soil physiochemical properties and increased rhizosphere bacteria abundance[J]. Applied Soil Ecology,2017,112:90-96.
[59]闫庚戌,范丙全. 磷肥用量对土壤中溶磷青霉菌P8接种效果的影响[J]. 中国土壤与肥料,2020(1):82-90.
[60]梁利宝,谢英荷,胡建华. 土著微生物对解磷微生物解磷效果影响的研究[J]. 山西农业大学学报(自然科学版),2006,26(2):155-158.
[61]CORDERO O X, DATTA M S. Microbial interactions and community assembly at microscales[J]. Current Opinion in Microbiology,2016,31:227-234.
[62]SAXENA J, RANA G, PANDEY M. Impact of addition of biochar along with Bacillus sp. on growth and yield of French beans[J]. Scientia Horticulturae,2013,162:351-356.
[63]BANERJEE S, SCHLAEPPI K, VAN DER HEIJDEN M G A. Keystone taxa as drivers of microbiome structure and functioning[J]. Nature Reviews Microbiology,2018,16:567-576.
[64]CHEN L J, JIANG Y J, LIANG C, et al. Competitive interaction with keystone taxa induced negative priming under biochar amendments[J]. Microbiome,2019,77(7):129-135.
[65]馬泊泊,黄瑞林,张 娜,等. 秸秆生物质炭对根际土壤细菌-真菌群落分子生态网络的影响[J]. 土壤学报,56(4):964-974.
[66]MASTO R E, KUMAR S, ROUT T K, et al. Biochar from water hyacinth (Eichornia crassipes) and its impact on soil biological activity[J]. Catena,2013,111:64-71.
[67]BHADURI D, SAHA A, DESAI D, et al. Restoration of carbon and microbial activity in salt-induced soil by application of peanut shell biochar during short-term incubation study[J]. Chemosphere,2016,148:86-98.
[68]XU M, GAO P, YANG Z, et al. Biochar impacts on phosphorus cycling in rice ecosystem[J]. Chemosphere,2019,225:311-319.
[69]OLEZCZUK P, JOSKO I, KUSMIERZ M, et al. Microbiological, biochemical and ecotoxicological evaluation of soils in the area of biochar production in relation to polycyclic aromatic hydrocarbon content[J]. Geoderma,2014,213:502-511.
[70]DEB D, KLOFT M, LSSIG J, et al. Variable effects of biochar and P solubilizing microbes on crop productivity in different soil conditions[J]. Agroecology and Sustainable Food Systems,2016,40(2):145-168.
(责任编辑:陈海霞)
