基于微生物角度探讨“口-肠”轴与胃癌防治研究进展*
2024-01-29陈露露宋忠阳赵海宏刘瑜郝国雄张志明
陈露露,宋忠阳,赵海宏,刘瑜,郝国雄,张志明
1.甘肃中医药大学研究生院,甘肃 兰州 730000; 2.甘肃中医药大学附属医院肿瘤科,甘肃 兰州 730020;3.甘肃省中医院名医工作室,甘肃 兰州 730050
据2020年世界卫生组织国际癌症研究机构(IARC)发布的最新胃癌数据显示,全球每年胃癌新发病例超过100万例,死亡病例约76.9万例,相当于全球每13例死亡病例即有1例死于胃癌,而我国胃癌发病率及病死率位居所有癌症的第3位,远高于世界平均水平[1]。由于早期胃癌临床表现的不典型及非特异性,及患者面对胃镜等现代医学检查的疼痛不适、恐惧等因素,严重限制了胃癌的早期诊断及手术治疗,减弱了放化疗、靶向、免疫等治疗手段的效果。微生物群作为筛选多种消化道肿瘤及癌前病变的一种潜在、稳定、无创性的生物标志物,具有早期诊断的便捷优势。近年来,从微生物角度探讨胃癌的早期诊断及防治研究已成为研究热点。中西医结合特色诊疗的多靶点微生物调控作为一种新兴治疗方法,可通过快速调控微生物紊乱恢复微生态平衡,在维持正常肠道上皮屏障功能、减轻炎症反应、免疫调控等方面发挥双向调节作用,可防止癌变及控制胃癌进展,逐渐被大家认知。
1 中医“口-肠”轴与胃癌相关性的理论基础
中医对“口-肠”轴生理病理理论依据的认识首载于《难经》中的“七冲门”。《难经》曰:“唇为飞门,齿为户门,会厌为吸门,胃为贲门,太仓下口为幽门,大肠小肠会为阑门,下极为魄门,故曰七冲门也。”“口-肠”轴与胃癌之间的关系与“飞门-阑门-贲门”生理结构具有一致性,且与中医学中“三焦”生理特性相对应,即飞门-吸门(口、咽、食管)属上焦,主入水谷,宣五谷味;贲门-阑门(胃、小肠)属中焦,主升清降浊,腐熟运化;阑门-魄门(大肠、肛门)属下焦,主传化糟粕[2]。《素问·五脏别论》云:“水谷入口,则胃实而肠虚;食下,则肠实而胃虚”,故六腑以通为用,以降为顺。《素问·六微旨大论》云:“出入废则神机化灭,升降息则气立孤危。故非出入,则无以生长壮老已,非升降,则无以生长化收藏,是以升降出入,无器不有。”《素问·经脉别论》云:“引入于胃,游溢精气,上输于脾,脾气散精,上归于肺,通调水道,下输膀胱。”从生理上指出饮食从口而入,七道调和,冲透七门,亦更开更合,气机随之上下。病理上,若气机升降失司、水谷运化失常,则气机逆乱,五脏不安,血脉不利,精神不定;上焦出现口臭、口疮等症;中焦见脘痞、呕吐等症;下焦则见腹痛、腹泻等症。《四诊脉鉴大全·七冲门阴绝阳绝脉论》指出:“此七门者,一气贯通,无有壅遏,壅遏则气闭而绝矣。”即七冲门严重壅遏不通时,则气闭而绝。
2 西医“口-肠”轴与胃癌相关性的理论基础
2.1 口腔微生物与肠道微生物的联系口腔与肠道发育同源于中胚层,在解剖学上是通过胃肠道连接的连续区域,同时,口腔为消化道的门户,直接暴露在微生物等外界环境中,两者均为不同微生物提供了适宜的生长环境。据美国国立卫生研究院人类微生物组项目(HMP)显示,人体中超过一半的细菌驻留在胃肠道(29%)和口腔(26%)中[3]。除了物种丰富之外,口腔和肠道微生物群高度多样化,并显示出不同栖息地的独特特征[4],但环境和功能的差异使得口腔和肠道的驻留菌群组成在很大程度上存在不同。此外,研究发现,口腔-肠道屏障、物理距离、胃酸和胆汁酸等因素导致了肠道和口腔微生物的特殊性[5]。在疾病背景下,口腔与肠道之间的微生物存在密切联系,口腔微生物可下行至肠道,加剧各种胃肠道疾病,肠道微生物也可逆行上至口腔,影响口腔菌群结构。口腔为不同位点、不同层次的微生物定植提供了不同的生态位,其异质性与肠道微生态相比,存在显著差异[6]。研究表明,滞留在口腔中的细菌可侵入并存活于树突状细胞、巨噬细胞等免疫细胞中,劫持宿主免疫细胞,通过血行途径转移到肠道黏膜[7]。另一种口腔细菌传播途径是通过破坏健康肠道菌群,为口腔细菌在肠道内的定植和扩张提供生态位,重塑肠道微生物群落[8]。其次,肠道微生物可通过直接接触或间接接触受污染的液体和食物,经粪口途径传播,证实手部微生物区系与口腔和肠道微生物区系高度重叠,提示手部是粪便-口腔微生物传播的载体[9]。
2.2 口腔微生物与胃癌的联系研究发现,口腔微生物菌群的结构、丰度、多样性在胃癌患者及健康人群中存在显著差异。相较于健康人,胃癌患者中拟杆菌门、变形菌门、放线菌门等26种菌群显著减少[10]。口腔微生物群中存在多种具有抗胃癌和促胃癌活性的微生物,其机制主要与口腔中梭杆菌、链球菌、卟啉单胞菌等特定口腔微生物群失调有关,可触发多种炎症因子表达,从而影响成纤维细胞、上皮细胞、内皮细胞等,促进炎症反应,诱导氧化应激反应,损伤线粒体,影响胃癌细胞的侵袭和转移[11]。其次,口腔中的龈卟啉单胞菌、核梭杆菌等可调控非受体型蛋白酪氨酸激酶1(janus kinase 1,JAK1)/蛋白激酶B(protein kinase B,AKT)/信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3) 、核转录因子-κB(nuclear transcription factor-κB,NF-κB)、Toll样受体4(Toll-like receptor 4,TLR4)等信号通路,抑制P2X7、Bcl-2/Bax等相关凋亡分子活性,介导凋亡机制;同时,口腔中微生物菌群也可产生亚硝胺、乙醛等致癌物质[12-14]。
2.3 肠道微生物与胃癌的联系研究发现,胃癌患者与健康人肠道菌群的结构特征存在显著差异。与健康人比较,胃癌患者的肠道菌群多样性增加,主要以毛螺梭菌科等益生菌属的相对丰度减少和普雷沃菌属、脱硫弧菌等致病菌属的相对丰度增加为主,且差异细菌脱硫弧菌、大肠杆菌、双歧杆菌等可作为胃癌预测的生物标志物,准确率高达90%[15]。其次,肠道菌群的变化与胃癌的预后、转移密切相关,Yu等[16]利用16sDNA基因测序技术检测胃癌、胃癌伴肝转移患者粪便中差异菌群,发现链球菌具有预测胃癌和胃癌伴肝转移的潜在能力。研究表明,肠道微生物群在胃内定植可促进幽门螺杆菌、炎症等相关性胃癌,其失调被认为是宿主微生物持续偏离健康和稳态状态,以促进、维持各种癌症表型,其机制主要有:(1)激活炎症反应:微生态失调时,NF-κB、Wnt、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号途径活化,触发机体中白细胞介素-6(interleukin-6,IL-6)、白细胞介素-11(interleukin-11,IL-11)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症细胞因子高表达,从而抑制细胞凋亡和增强氧化应激,导致胃黏膜上皮细胞DNA损伤,异常的DNA甲基化引发炎症相关性胃癌[17];(2)免疫调节:肠道微生物群的失调会引发许多与胃癌形成过程有关的先天和适应性免疫反应,肠上皮细胞中抗菌蛋白识别细菌的结构成分,区分微生物分子和宿主分子,相应地调节微生物组成并激活炎症小体介导的免疫反应[18];(3)肠道菌群代谢产物:其代谢产物脂磷壁酸、次生胆汁酸和短链脂肪酸(short chain fatty acids,SCFAs)等具有双重致癌作用,通过活化IL-6/JAK/STAT3/NK-κB等信号通路及下游基因的表达促进胃上皮细胞过度增殖及炎症因子分泌,促进DNA损伤,诱导细胞衰老,导致衰老相关的分泌表型;同时通过调节性T细胞(regulatory T cell,Treg)介导免疫调节,共同调控胃癌的进程[19-20]。
3 基于“口-肠-胃”轴微生物为靶点干预胃癌的中西医研究现状
3.1 胃癌癌前病变预防有学者研究从慢性萎缩性胃炎、肠上皮化生、不典型增生等癌前病变到胃癌的级联演变过程发现,肠道菌群多样性、菌属丰富度呈减少趋势,乳酸菌、肺炎克雷伯菌、鲍曼不动杆菌数量显著增加,卟啉单胞菌、奈瑟菌、普雷沃特菌、链球菌数量显著减少[21-22]。在胃癌癌前病变患者口腔中,拟普雷沃菌属、罗氏菌属、艾肯菌属和聚集杆菌属的相对丰度显著增加,与脂质代谢的改变为主[23]。在临床研究中,口腔、肠道微生物检测可作为胃癌癌前病变检测的一种潜在的、无创的、灵敏的方法,对及早干预胃癌癌前病变、降低胃癌的发病率具有重大意义。同时,研究发现,除了手术治疗、常规中西医治疗手段外,从口腔-肠道微生态角度运用益生菌、益生元、中医药等手段均可不同程度上逆转胃黏膜病理状态(胃黏膜肠上皮化生、不典型增生),显著改善临床症状,大幅度降低胃癌发生率。
3.2 西医治疗胃癌
3.2.1 调控口腔微生物诸多研究证明,在防治胃癌的同时,保持口腔清洁、防治口腔疾病是必不可少的,其作用机制一方面为减轻炎症级联反应对胃黏膜刺激损伤;另一方面则是调控口腔菌群平衡,减少口腔菌群紊乱对肠道菌群稳态及正常功能维持的影响。对口腔健康与上消化道癌症之间相关性的前瞻性研究发现,在牙周病、牙齿脱落、蛀牙等口腔健康状况较差或不经常进行口腔清洁的人群中,患上消化道癌症的风险显著增加,保持口腔清洁及健康可预防及降低胃癌、食管癌等上消化道癌症发生的风险[24]。口腔优势菌群链球菌抑制剂能够显著刺激TLR4、TNF表达,刺激机体增强免疫力,消灭病原微生物,增强胃癌恶性腹水局部治疗疗效[25]。口腔铜绿假单胞菌提取物蓝色素具有较高的抗癌和抗菌活性,可作为一种有效的抗癌和抗菌剂,用于干预胃肠道肿瘤及相关细菌[26]。
3.2.2 调控肠道微生物
3.2.2.1 饮食干预饮食和饮食成分对肠道微生物群的组成有着深远的影响,是菌群结果和共能变化的关键因素之一。不同的饮食模式可通过影响有益菌、致病菌及恢复细菌易位等综合调控患者肠道菌群丰度及结构,从而影响机体免疫功能、炎症反应、细胞免疫逃逸、癌症的复发和转移等,影响癌症的发生率及总体死亡率[27-31]。
3.2.2.2 益生菌益生菌是一类对人体有益的活体微生物菌株,大多数益生菌产品开发都是以双歧杆菌、乳酸杆菌和其他乳酸菌合成的,种类繁多,大多分泌合成SCFA形式,其抗胃癌机制主要有:(1)直接抑癌:大量实验证明,肠道菌群如乳酸杆菌、布拉氏酵母菌、干酪乳杆菌及其代谢产物等,可通过干扰MAPK、SAPK、DAPK1/2、p21基因和类似的信号通路直接抑制胃癌细胞的增殖,诱导细胞自噬、凋亡,实现肿瘤抑制,其代谢产物SCFA可通过调节肠道pH值,改善宿主胃肠道的微生态环境,形成新平衡,参与氧化、脂质合成和能量代谢。其次,益生菌通过重新塑造胃肠道微生态、阻止宿主细胞的恶性转化,从而防治幽门螺杆菌相关性胃癌癌变[32]。(2)调节免疫系统:益生菌可通过激活树突状细胞、自然杀伤细胞和T淋巴辅助细胞等免疫细胞介导免疫反应,如乳杆菌、分段丝状细菌可以激活转化生长因子-β1(transforming growth factor-β,TGF-β1)、辅助性T细胞17(helper T cell,Th17),促进调节性树突细胞成熟并分泌IL-10、IL-17,同时,激活肠固有层淋巴细胞分泌IL-22,以抑制炎症,保护胃黏膜屏障[33]。临床试验进一步证明,双歧杆菌、乳酸菌和链球菌等益生菌可通过升高CD4水平、降低IL-6水平,从而降低胃癌相关炎症水平[34]。(3)间接抑癌:益生菌如大肠杆菌可通过干扰外源性CO信号通路参与新陈代谢从而提高药理活性,降低毒性,间接抑制癌细胞生长[35]。
3.2.2.3 益生元益生元作为一类不易被人体消化吸收的碳水化合物,可选择性地影响益生菌的生长,是宿主微生物选择性利用的底物,具有促进肠道有益菌代谢、增殖,防御病原体、免疫调节、矿物质吸收等功效。益生菌可通过影响有益细菌的繁殖产生有机酸,降低管腔pH值,抑制病原体生长,抑制定植,建立一个稳定的肠道微生态,诱导胃癌细胞凋亡。进一步临床研究证实,每天食用低聚半乳糖10周可增强吞噬、自然杀伤细胞活性,从而增强免疫功能[36]。同时,管腔中pH值的下降会增加钙的溶解度,且随着pH的增加而增加,食用低聚果糖、低聚半乳糖等混合物可以显著增加骨吸收和钙矿化,低聚半乳糖可以直接刺激肠上皮细胞系中紧密连接蛋白的表达,减少流动,但此假设仅有动物模型数据的支持,缺乏长期的临床试验研究[37]。另外一项研究表明,益生元代谢产物SCFA可与特定的脂肪酸受体FFAR2和FFAR3相互作用,调节肠道激素,促进肠蠕动,软化粪便,改善肠道功能[38]。
3.2.2.4 粪菌移植以治疗为目的操纵微生物种群已成为癌症研究的热门话题,而肠道微生物群最引人注目的操纵是从健康个体到患者的粪便微生物群移植(fecal microbiota transplant,FMT),即将供体的微生物群以胶囊或粪便微生物群悬液的形式移植到受体体内,恢复受体肠道菌群的平衡。FMT已被证明对艰难梭菌感染(clostridium difficile infection,CDI)具有显著的临床疗效,强烈推荐用于治疗复发性或难治性CDI。FMT可通过重建肠道微生物群、改善胆汁酸代谢和调节免疫等达到治疗胃癌的目的。研究显示,结直肠癌患者的粪便微生物群促进了肠道肿瘤的形成,并降低了给予致癌物质的实验小鼠的微生物丰度,移植了FMT的小鼠肠道微生物表现出更好的抵抗力和炎症的改善[39],这支持了FMT可能对胃肠道肿瘤具有潜在治疗效果的假设,但其有效性和安全性尚未报道。
3.3 中医药防治胃癌
3.3.1 中药复方中药复方成分复杂多样,当中药进入消化道时,可通过增加益生菌(双歧杆菌、乳酸杆菌、粪肠球菌等)及致病菌(肠杆菌、梭状芽孢杆菌等)数量和活性、抑制病原体和防止细菌移位调节肠道微环境,维持微生态的平衡。其次,肠道微生物群落可以促进中药成分的转化和代谢。中药复方干预显示出良好的抗氧化和抗炎活性,能够根除幽门螺旋杆菌及抑制癌症细胞的增殖和转移,从而改善患者临床症状,逆转癌前病变,提高机体免疫力,恢复患者胃肠功能,且具有较好的安全性。部分中药复方对肠道菌群影响及机制见表1。

表1 中药复方对肠道菌群影响及机制
3.3.2 单味中药或有效成分
3.3.2.1 调节肠道菌群中药丹参具有活血化瘀、行气止痛、清热消痈等功效,现代药理研究发现其可显著抑菌消炎、抗癌止痛,广泛用于胃癌、肝癌等多种实体恶性肿瘤中。有动物实验和细胞实验系统评估了丹参的抗胃癌活性,发现其主要成分丹参酮 ⅡA 可通过调控NF-κB信号传导通路阻碍胃癌细胞生长,并以剂量依赖的方式提高乳杆菌和拟杆菌丰度,降低大肠杆菌和念珠菌丰度,且肠道菌群失调状况可部分阻断丹参酮ⅡA刺激的抗肿瘤作用[45]。
密点麻蜥富含多种微量元素,在免疫调节、抗癌方面发挥着至关重要的作用。相关研究证实,密点麻蜥含药血清可通过抑制SIRT1、降低p53蛋白表达显著抑制胃癌细胞增殖,促进凋亡[46]。密点麻蜥复方可通过降低p53、PUMA表达从而改善胃黏膜缺血缺氧状态及胃黏膜病理变化,逆转癌变[47]。该团队进一步研究发现,密点麻蜥可基于SNAIL信号通路下调SNAIL、N-cadherin及上调E-cadherin蛋白表达,抑制上皮间质转化进程,干预胃癌浸润转移;增加厚壁菌门丰度,补充机体SCFA缺失,调节拟杆菌属、梭状芽孢杆菌属、副拟杆菌属等机体自身免疫相关菌属,降低致病菌幽门螺旋杆菌的丰度,从宏基因层面进一步揭示密点麻蜥多途径、多靶点对胃癌肝转移的抑制作用及机制[48]。
姜黄、白藜芦、石斛等中药及膳食均含有姜黄素、白藜芦醇、槲皮素等多酚有机化学物质,可作为益生元,具有抗癌等多种药理活性,促进宿主肠道中各种有益微生物产生和生长,有效调节肠道微生物群。临床研究也证实,补充多酚可以显著提高双歧杆菌、乳酸杆菌等有益菌物种丰度,抑制梭菌、大肠杆菌等有害细菌物种丰度[49]。根据细胞和动物实验及临床证据支持,常见多酚(绿茶多酚、姜黄素、白藜芦醇、槲皮素等)调节肠道菌群发挥抗胃癌主要可能机制见表2。
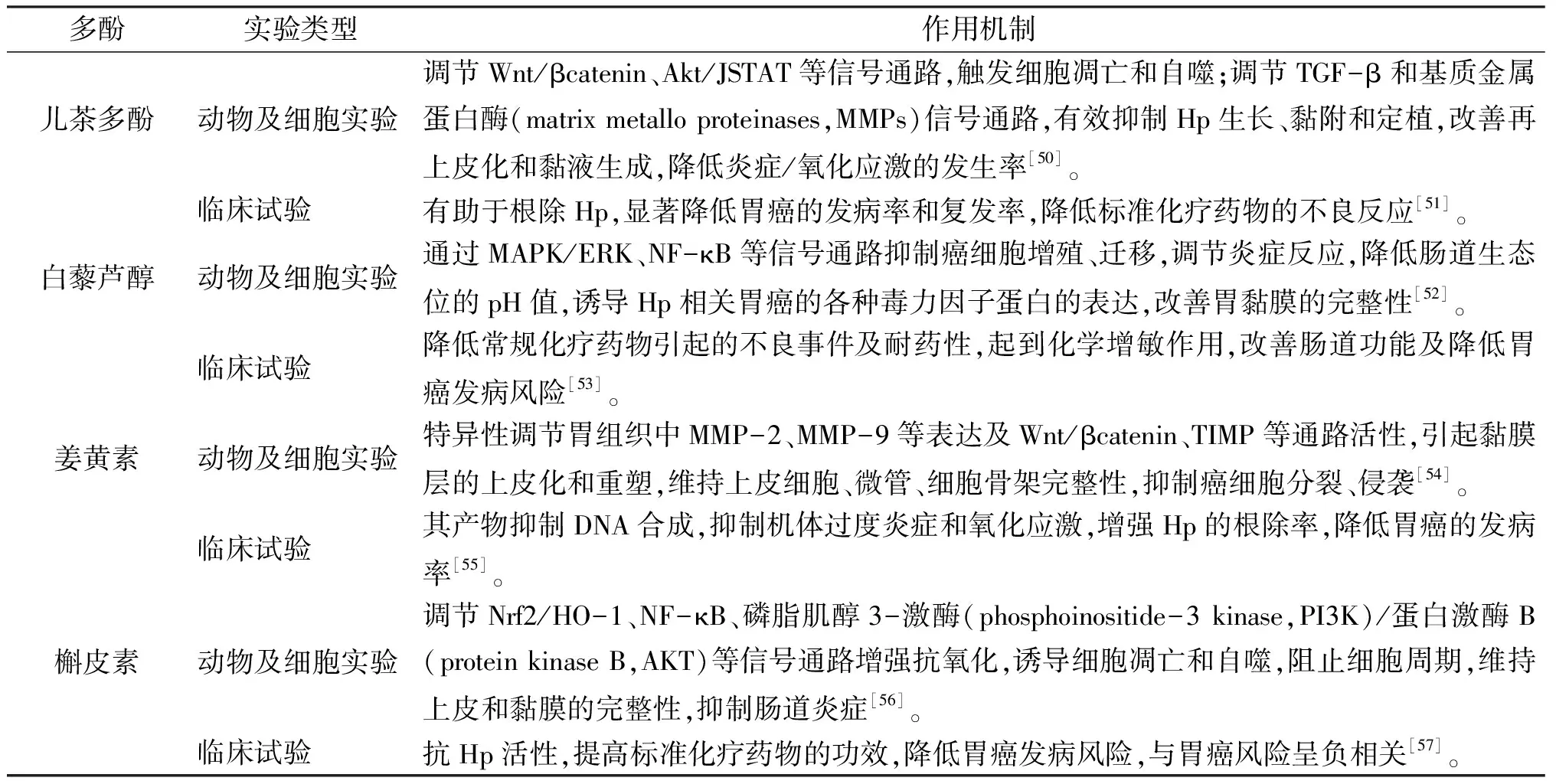
表2 常见多酚防治胃癌作用机制
中药苦参[58]、白花蛇舌草[59]、陈皮[60]、茯苓[61]、黄芪[62]等中草药及其多种有效成分均被证实可通过多靶点、多信号通路调控机体免疫功能、抗氧化,诱导肿瘤细胞凋亡,发挥抗胃癌功效。其次,这些中药及有效成分均可不程度地调控肠道菌群,增强肠道菌群有益菌,减少有害菌丰度,造成代谢途径的差异,从不同机制层面保护肠道屏障功能,调节代谢内毒素血症,抑制炎症反应,但这些中药均缺乏大量临床试验及动物、细胞实验以证实其能够直接调控胃癌肠道菌群,发挥抗胃癌功效。
3.2.2.2 调节菌群代谢产物肠道菌群在参与各种物质代谢中所释放的代谢产物是共生代谢产生的膳食成分的中间体和(或)最终产物,对宿主免疫和健康发挥不可或缺的作用,如SCFA、乳酸、色氨酸代谢产物、胆汁酸等。SCFA主要指乙酸盐、丙酸盐和丁酸盐等,丁酸盐、丙酸盐主要通过激活肠上皮细胞相关基因及蛋白表达,抑制炎症因子表达,诱导肠道黏液合成,改变肠道微生物群的组成和活性,塑造肠道免疫系统,抑制癌症细胞的增殖、迁移,发挥抗癌活性。色氨酸作为人体必需氨基酸,可到达结肠并被肠道菌群分解代谢,转化为各种分解代谢物,破坏抗肿瘤免疫系统[63]。中草药其及有效成分可直接干预肠道菌群代谢产物而发挥免疫调节作用,抑制炎症反应,加固黏膜屏障,减少胆汁反流,抗Hp,从而发挥抗癌活性。中药有效成分调节菌群代谢产物作用机制见表3。

表3 中药有效成分调节菌群代谢产物作用机制
其次,口服进入胃肠道的中药不能直接被完全吸收,长期残留的中药成分经胃肠道微生物群和相关酶的生物代谢,二次供机体使用,可有效提高中药生物利用度,增强抗肿瘤作用。Huang等[66]研究发现,由肠道微生物群转化的人参皂苷Rg3和Rh1可以减少含有2-羟基丁酸或苹果酸的有害化合物和炎症因子,增加亚麻酸并恢复微生物群结构。此外,Shu等[67]研究发现,当芍药通过β-葡萄糖苷酶代谢分解为芍药苷时,其作用更强,短乳杆菌和脆弱拟杆菌可以将芍药催化成芍药苷等活性物质,提高疗效。中药有效成分黄酮、多糖和生物碱等可通过胃肠道微生物群代谢,以提高药理活性,并减少不良反应,例如,双歧杆菌和粪大肠杆菌可以将葛根素转化为大豆黄酮[68];姜黄素[69]、黄芩苷[70]等的抗炎、抗氧化和抗肿瘤活性经胃肠道微生物群转化后显著增强。
4 结语
随着宏基因测序技术、微生物组学的进一步发展与应用,口腔、肠道微生物群在胃癌发病中的作用机制逐渐明确,为胃癌及癌前病变的防治模式提供了新思路、新方向。目前,基于口腔、肠道微生物角度的中西医治疗可通过增强免疫、抑制炎症反应、抗Hp等机制调控肠道菌群及代谢产物,发挥抑制胃癌细胞增殖、迁移等功效,疗效显著,安全性高,有望成为一种有前景的胃癌精准靶向治疗先导方法,为中西医治疗胃癌寻找新策略、中西医结合诊断提供客观化、标准化依据。基于调控口腔、肠道微生物的胃癌的中西医治疗虽取得巨大进步,但仍存在一定的局限性:(1)口腔、肠道微生物数量、种类繁多,结构复杂,影响因素众多,多数口腔、肠道微生物与肠黏膜上皮细胞之间的相互作用及中医药干预机制尚不明确,对细菌移位与定植、位点、细菌表位的识别多停留在动物实验阶段,亟需大样本的临床观察及研究加以证实。(2)其调控机制主要集中在炎症反应、免疫反应等方面,今后应加大对自噬、化疗药物耐药等机制的研究,多角度阐述通过打破口腔、肠道微生态平衡干预胃癌的机制。(3)微生物调控胃癌、癌前病变的相关研究主要集中在肠道微生物,鲜有“口腔-肠道微生态失衡”理论用于胃癌的中西医研究,探析正常及失调状态下口腔微生物变化,故今后应加大有关口腔微生物失衡对胃癌的干预治疗及机制研究,针对胃癌、癌前病变风险预测及中医药干预疗效评估建立口腔-肠道微生物数据库及模型。(4)筛选口腔-肠道微生物特异性、标志性菌群可作为预测胃癌、癌前病变潜在的、无创性、灵敏的检测方法,但目前未寻找到胃癌、癌前病变的特异性、标志性菌群,故今后可结合宏基因组学及中医药微生态理念筛选不同中医证型胃癌及癌前病变患者的标志性、特异性菌群,同时尝试开发更多微生态产品,为通过口腔、肠道微生物途径治疗胃癌寻找新策略提供重要依据。
