他克莫司、吗替麦考酚酯联合糖皮质激素治疗抗中性粒细胞胞质抗体相关性血管炎肾损害的效果
2024-01-27王建刚任东升
鲁 冰,王建刚,谷 裕,任东升
南阳市中心医院肾病内科,南阳 473000
抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibody,ANCA)相关性血管炎(ANCAassociated vasculitis,AAV)发病凶险,原发于小血管壁,随病情进展常导致多系统、多器官损害[1-2]。临床常用糖皮质激素加免疫抑制剂治疗以减轻症状,既往常使用环磷酰胺代免疫抑制剂[3-5]。吗替麦考酚酯(mycophenolate mofetil,MMF)、他克莫司(tacrolimus,TAC)均是常用的免疫抑制剂,MMF 对肝、肾的毒性较轻,常用于系统性红斑狼疮等的治疗[6];TAC 除具有免疫抑制作用外,还能抑制血小板聚集、减轻炎症反应等[7]。本研究比较TAC、MMF 联合糖皮质激素治疗AAV 肾损害的效果。
1 资料
1.1 一般资料
选取南阳市中心医院肾内科收治的AAV 患者80例,用随机数字表法分为A组(n=41)和B组(n=39),2组一般资料比较差异无统计学意义(P>0.05)。见表1。本研究经医院伦理委员会批准。
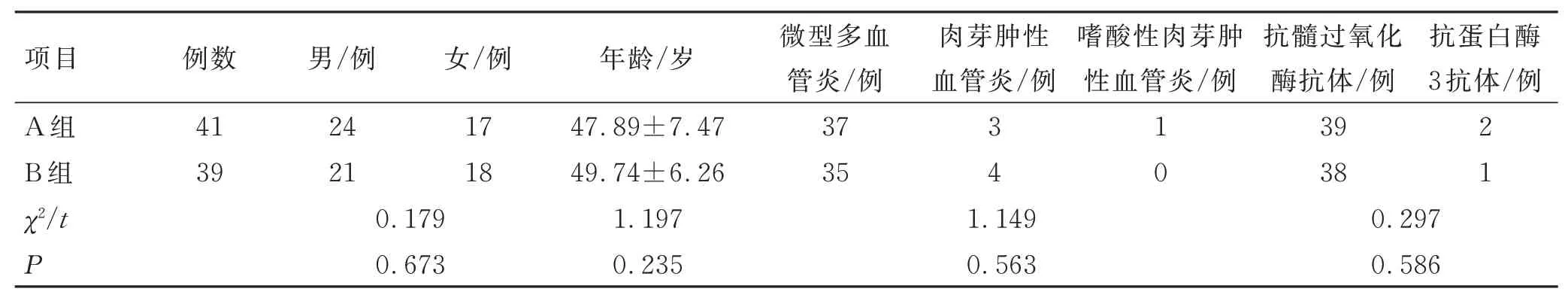
表1 2 组临床资料的比较 (xˉ±s)Tab.1 Comparison of clinical data between the 2 groups (xˉ±s)
1.2 纳入标准与排除标准
纳入标准:①符合AAV 诊断;②在本院住院,且ANCA 阳性;③明确肾脏受累;④患者认知正常;⑤患者及家属知情同意。
排除标准:①合并严重心脑血管疾病;②合并继发性血管炎;③存在用药(TAC、MMF、糖皮质激素)禁忌;④合并免疫功能缺陷;⑤合并脓毒症;⑥合并恶性肿瘤;⑦存在严重感染;⑧合并肾病综合征。
2 方法
2.1 分组
A 组予以TAC 联合糖皮质激素治疗:甲基泼尼松龙(静脉注射,0.5~1.0 g·d-1,连续用药3 d),再改为醋酸泼尼松(口服给药),起始剂量为0.6 mg·kg-1·d-1,4周后减至10 mg·d-1,维持;同时给予TAC(口服给药),起始剂量为0.05 mg·kg-1,每日2 次,连续用药12 周,再减至0.04~0.06 mg·d-1,共用药24 周。
B 组予以MMF 联合糖皮质激素治疗:甲基泼尼松龙(静脉注射,0.5~1.0 g·d-1,连续用药3 d),再改为醋酸泼尼松(口服给药),起始剂量为0.6 mg·kg-1·d-1,4周后减至10 mg·d-1,维持;同时给予MMF(口服给药,1.0~2.0 g·d-1),连续给药24 周。
2.2 观察指标
(1)ANCA、伯明翰血管炎活动性评分(Birmingham vasculitis activity score,BVAS):治疗前后用酶联免疫吸附试验检测血清ANCA 值;进行BVAS 评价,评价内容包含全身症状和皮肤表现等9 个方面,总分为63 分,BVAS≥15 分表明疾病处于活动期[8]。
(2)肾功能:治疗前后,收集患者24 h 尿液,用全自动尿液分析工作站(FUS-2000,迪瑞医疗科技股份有限公司)测定24 h 尿蛋白定量(24 h urinary protein quantitation,24 h UPQ),用全自动生化分析仪(TBA-40FR,日本东芝公司)测定血清尿素氮(blood urea nitrogen,BUN)、胱抑素C(cystatin C,CysC)水平。
(3)血管内皮功能相关指标:治疗前后用酶联免疫吸附试验检测血管内皮功能相关指标,包括:①可溶性血管内皮细胞生长因子受体1(soluble fms-like tyrosine kinase-1,SFlt-1);②溶酶体相关膜蛋白2(lysosome associated membrane protein-2,LAMP-2)抗体;③血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)。
(4)细胞免疫指标:治疗前后检测2 组患者CD4+、CD8+及CD19+水平。
(5)不良反应:统计患者胃肠道不适、转氨酶升高、白细胞下降、感染、血压异常等不良反应的发生情况。
2.3 统计学方法
数据分析使用SPSS 23.0,P<0.05 为差异有统计学意义。计数资料(ANCA、BVAS 等数据)用“例(%)”表示,行χ2检验。计量资料(不良反应总发生率等数据)符合正态分布,用(±s)表示,行t检验。
3 结果
3.1 2 组ANCA、BVAS 的比较
治疗后,2 组的ANCA、BVAS 较治疗前降低(P<0.05),且A 组较B 组更低(P<0.05)。见表2。
表2 2 组ANCA、BVAS 的比较 (±s)Tab.2 Comparison of ANCA and BVAS between the 2 groups (±s)

表2 2 组ANCA、BVAS 的比较 (±s)Tab.2 Comparison of ANCA and BVAS between the 2 groups (±s)
项目A 组B 组t P例数41 39 ANCA/(Ru·mL-1)治疗前131.42±42.11 138.86±45.84 0.757 0.452治疗后40.36±12.98 66.84±21.97 6.602 0.000 t 13.232 8.848 P 0.000 0.000 BVAS/分治疗前17.68±5.34 17.15±5.02 0.457 0.649治疗后13.09±3.05 14.73±4.14 2.024 0.046 t 4.779 2.323 P 0.000 0.023
3.2 2 组肾功能的比较
治疗后,2 组的24 h UPQ、BUN、CysC 较治疗前降低(P<0.05),且A 组较B 组更低(P<0.05)。见表3。
表3 2 组肾功能的比较( ±s)Tab.3 Comparison of renal function between the 2 groups( ±s)

表3 2 组肾功能的比较( ±s)Tab.3 Comparison of renal function between the 2 groups( ±s)
项目A 组B 组t P例数41 39 24 h UPQ/(g·24 h-1)治疗前3.74±0.58 3.82±0.53 0.643 0.522治疗后1.02±0.24 1.34±0.32 5.076 0.000 t 27.747 25.016 P 0.000 0.000 BUN/(mmol·L-1)治疗前13.03±3.34 13.45±3.43 0.555 0.581治疗后6.73±2.18 10.08±2.59 6.270 0.000 t 10.114 4.897 P 0.000 0.000 CysC/(mg·L-1)治疗前1.64±0.25 1.59±0.28 0.843 0.402治疗后0.73±0.18 1.14±0.22 9.143 0.000 t 18.915 7.892 P 0.000 0.000
3.3 2 组血管内皮功能相关指标的比较
治疗后,2 组的SFlt-1、LAMP-2 抗体、VEGF 较治疗前均降低(P<0.05),且A 组较B 组更低(P<0.05)。见表4。
表4 2 组血管内皮功能相关指标的比较 (±s)Tab.4 Comparison of endothelial function related indicators between the 2 groups (±s)
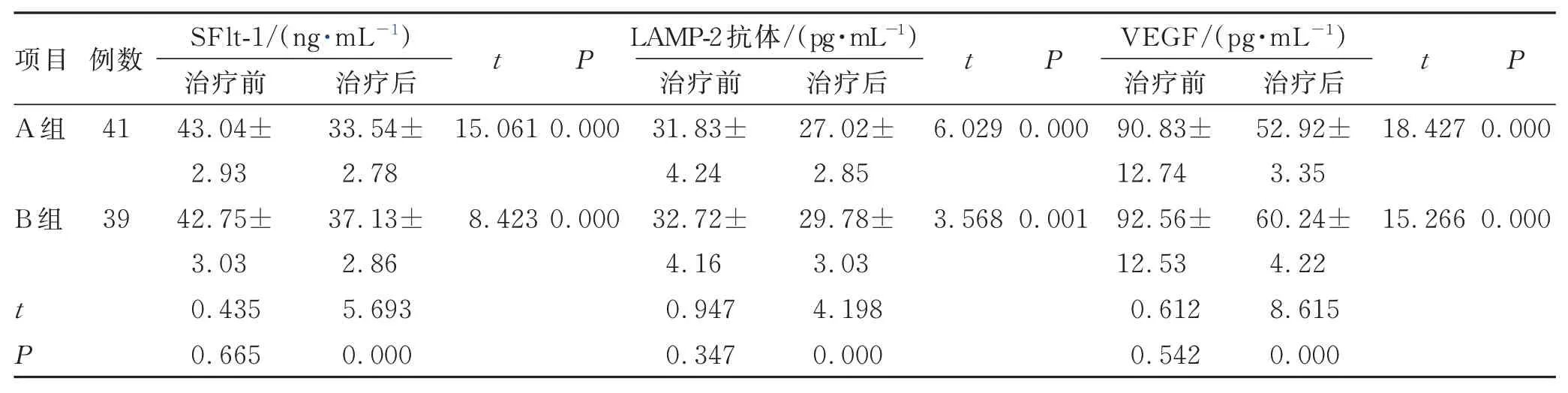
表4 2 组血管内皮功能相关指标的比较 (±s)Tab.4 Comparison of endothelial function related indicators between the 2 groups (±s)
项目A 组B 组tP例数41 39 SFlt-1/(ng·mL-1)治疗前43.04±2.93 42.75±3.03 0.435 0.665治疗后33.54±2.78 37.13±2.86 5.693 0.000 t 15.0610.000 8.4230.000 P LAMP-2 抗体/(pg·mL-1)治疗前31.83±4.24 32.72±4.16 0.947 0.347治疗后27.02±2.85 29.78±3.03 4.198 0.000 t 6.0290.000 3.5680.001 P VEGF/(pg·mL-1)治疗前90.83±12.74 92.56±12.53 0.612 0.542治疗后52.92±3.35 60.24±4.22 8.615 0.000 t 18.4270.000 15.2660.000 P
3.4 2 组细胞免疫指标的比较
治疗后,2 组的CD4+较治疗前升高(P<0.05),CD8+、CD19+较治疗前降低(P<0.05),且A 组CD4+较B 组高(P<0.05),CD8+、CD19+较B 组低(P<0.05)。见表5。
表5 2 组细胞免疫指标的比较 (±s)Tab.5 Comparison of cellular immune indicators between the 2 groups (±s)

表5 2 组细胞免疫指标的比较 (±s)Tab.5 Comparison of cellular immune indicators between the 2 groups (±s)
项目例数A 组B 组tP 41 39 CD4+治疗前31.42±3.19 30.63±3.68 1.027 0.307治疗后33.22±1.37 32.26±2.11 2.425 0.018 t 3.320 2.400 P 0.001 0.019 CD8+治疗前31.94±1.42 31.76±1.45 1.184 0.240治疗后29.52±1.38 30.31±1.41 2.532 0.013 t 7.826 4.477 P 0.000 0.000 CD19+治疗前23.36±1.63 23.09±1.58 0.752 0.454治疗后20.95±1.37 21.32±1.22 1.273 0.207 t 7.247 6.163 P 0.000 0.000
3.5 2 组不良反应的比较
A 组不良反应总发生率(9.76%)较B 组(28.21%)低(P<0.05)。见表6。

表6 2 组不良反应的比较Tab.6 Comparison of adverse reactions between the 2 groups
4 讨论
MMF 作为临床使用相对广泛的免疫抑制剂,其能直接作用于T 淋巴细胞、B 淋巴细胞,抑制其增殖过程,显示出较确切的免疫抑制作用。既往有研究将MMF 用于治疗肾小球疾病,发现其在肾功能改善、肾脏损害修复方面同样有效[9]。TAC 提取自链霉菌发酵物,被广泛用作免疫抑制剂[10]。此外,TAC还能直接作用于已聚集的淋巴细胞,抑制其功能发挥,阻断炎性细胞趋化过程,最终抑制B 细胞。其具有服用方便、起效快速、药效持久等多重优势,现已应用在肾脏疾病的治疗中,并显示出较好的疗效。
ANCA 是AAV 的常用血清标志物,其能为病情诊断、临床治疗提供重要依据[11]。BVAS 是目前公认评价AAV 活动度的可靠工具[12]。表2 结果显示,与MMF 联合糖皮质激素治疗方案比较,TAC 联合糖皮质激素治疗AAV 肾损害能更好地降低血清ANCA 值、血管活动度。肾脏作为AAV 最常累及的脏器,肾功能必然受到不利影响[13]。本研究通过观察24 h UPQ、BUN、CysC 检测结果的变化情况,评价MMF、TAC 在肾功能改善方面的有效性。表3 结果显示,与MMF 联合糖皮质激素治疗方案比较,TAC 联合糖皮质激素治疗AAV 肾损害更利于肾功能改善。
内皮损伤是AAV、AAV 肾损害的病理特征之一[14]。在血管功能调控中,血管内皮细胞发挥一定作用,但血管内皮细胞水平通常受多种蛋白因子综合调节[15]。SFlt-1 是VEGF 的受体拮抗剂,可抑制VEGF[16]。VEGF 直接作用于血管内皮细胞,可直接改变肾小球滤过膜的通透性,参与AAV 肾损害过程[17]。LAMP-2 抗体多表达于中性粒细胞、内皮细胞等,其具有致病性,有研究表明,LAMP-2 抗体可通过影响中性粒细胞、内皮细胞等,促使血管炎处于恶性持续状态[18]。因此,通过观察上述3 项指标变化情况,可较好地了解血管内皮功能。表4 结果显示,与MMF 联合糖皮质激素治疗方案比较,TAC 联合糖皮质激素治疗AAV 肾损害能更好地保护血管内皮功能。分析原因可能是,AAV 肾损害患者在服用TAC 后,其有效成分能快速进入细胞,结合相应受体,形成复合物,进而有效抑制T 细胞,修复肾损害。
细胞免疫紊乱参与AAV、AAV 肾损害过程,特别是T 细胞功能紊乱、Th2 细胞占优势的Th1/Th2失衡[19]。AAV 肾损害患者较正常生理状态下出现T细胞检测结果异常,例如,CD4+T 细胞检测值低、CD8+T 细胞检测值高。此外,Th2 过度表达将造成炎性细胞因子(白细胞介素4 等)释放增多,进而将促进B 细胞异常增殖、分化,机体处于免疫紊乱状态。CD19+主要分布于B 细胞中[20]。本研究将CD4+、CD8+、CD19+用于评价不同免疫抑制剂联合糖皮质激素治疗AAV 肾损害的细胞免疫调节作用。表5结果显示,与MMF 联合糖皮质激素治疗方案比较,TAC 联合糖皮质激素治疗AAV 肾损害有利于调节细胞免疫功能。分析原因可能是,TAC 能直接作用于已聚集的淋巴细胞,抑制其功能发挥,阻断炎性细胞趋化过程,最终抑制B 细胞。此外,TAC 还能直接阻断白细胞介素-2 等基因转录过程,以有效抑制T细胞。
表6 结果显示,与MMF 联合糖皮质激素治疗方案比较,TAC 联合糖皮质激素治疗AAV 肾损害的安全性更高。根据本研究以上分析结果,认为与MMF联合糖皮质激素治疗方案比较,TAC 联合糖皮质激素治疗方案更适用于AAV 肾损害患者。
综上所述,与MMF 联合糖皮质激素治疗方案比较,TAC 联合糖皮质激素治疗AAV 肾损害在降低血清ANCA 值、减小BVAS、改善肾功能、保护血管内皮功能、调节细胞免疫等方面的效果更显著,且安全性高。
