马氏珠母贝Perlucin基因序列特征及其SNP与耐低温性状的关系
2024-01-26赖卓欣宋欣霖钟如卓王庆恒
王 成,赖卓欣,宋欣霖,钟如卓,郑 哲,2,3,4,王庆恒,2,3,4
(1.广东海洋大学水产学院/2.广东省珍珠养殖与加工工程技术研究中心/3.广东省珍珠科技创新中心/4.广东省水产动物病害防控与健康养殖重点实验室,广东 湛江 524088)
C-型凝集素(C-type Lectins,CTL)是一类广泛分布于生物中的糖类结合蛋白,主要通过细胞黏附和聚集[1,2]、细菌清除[3]和酚氧化酶原激活[4,5]等参与先天性免疫应答,也是固有免疫系统中的重要模式识别受体。Perlucin 是一种典型的C 型凝集素蛋白,在水产动物先天性免疫过程中发挥重要作用:凡纳滨对虾(Litopenaeus vannamei)[6]、杂色鲍(Haliotis diversicolor)[7]、香港牡蛎(Crassostrea hongkongensis)[8]在病原菌感染后Perlucin表达量均显著升高,表明Perlucin 参与了三者的免疫应答;香港牡蛎重组蛋白ChPerlucin 有抑菌效果[8]。此外,Perlucin 还参与响应环境因子胁迫:在菲律宾蛤仔(Ruditapes philippinarum)、马尼拉蛤蜊(Costellipitar manillae)[9]、海螺(Panopea generosa)[10-11]、悉尼牡蛎(Crassostrea commereialis)[12]、紫贻贝(Mytilus galloprovincialis)[13]和墨西哥象拔蚌(Panopea abrupta)[14]等贝类中均发现Perlucin 参与海洋酸化胁迫响应,在近江牡蛎(Crassostrea ariakensis)中发现Perlucin参与高盐胁迫的适应调节过程[15]。
温度是限制动物生长、繁殖和分布的极为重要的环境因子。CTL 参与温度胁迫响应:菲律宾蛤仔(Ruditapes philippinarum)鳃组织中的CTL 在低温胁迫下表达量显著上升[16];高温胁迫会诱导大菱鲆(Scophthalmus maximus)肝脏中的CTL 同源基因SmLec1表达量上升[17];在盐沼贻贝(Geukensia demissa)中首次发现Perlucin 和Perlucin-like 蛋白在高温胁迫下表达显著上升[18];在菲律宾蛤仔中,高温和低温胁迫均会诱导Perlucin在鳃组织中的表达[19]。由此可见,Perlucin等CTL 可能在贝类的温度胁迫响应中发挥作用。
马氏珠母贝(Pinctada fucata martensii)是我国培育海水珍珠的主要养殖贝类之一,属于暖水性贝类,对低温的耐受能力弱,自然群体主要分布在深圳以南海域。除目前的主养殖区广东湛江、广西北海和海南等地外,广东北部和福建南部等历史分布区的耐低温种群已消失[20];主养殖区曾多次发生冬季寒潮,导致马氏珠母贝养殖群体大规模死亡,因此培育耐低温品系是马氏珠母贝抵御寒潮乃至北移养殖的前提。赖卓欣[21]通过继代选择构建了马氏珠母贝耐低温选育系,并通过基因组重测序发现,与北部湾野生群体相比,耐低温群体包括Perlucin在内的部分基因受到了选择压力。本研究从马氏珠母贝基因组中鉴定到Perlucin基因,通过RACE克隆技术获得马氏珠母贝Perlucin基因(PIN_GLEAN_10008410)cDNA 序列全长,对其序列特征、组织表达模式以及群体间SNP 位点进行分析,探究该基因在马氏珠母贝低温胁迫和耐受中的功能,为其耐低温群体培育和种群恢复提供理论基础。
1 材料和方法
1.1 材料
实验用马氏珠母贝均采自广东省雷州市后洪村海区,为外观正常、生长旺盛、规格基本相似[壳长(69.23±3.80)mm]的1.5 龄马氏珠母贝。将马氏珠母贝表面附着物清理干净,运回实验室,在22 ℃海水中暂养48 h。随机取马氏珠母贝8 只,剪取闭壳肌、鳃、性腺、肝胰腺、足和外套膜(8 个生物学重复),经液氮速冻后转移至—80 ℃冰箱,备用。另将100 只马氏珠母贝随机分成2 组,分别养殖于300 L实验桶中,以17 ℃为低温胁迫温度[22]、22 ℃为对照在空调房中进行温度胁迫实验:将室内温度分别设定为17、22 ℃,使环境温度一致。每天换水前将经过三层沙滤的海水温度分别调至17、22 ℃,并用控温器和冰盒进行温度保持,换水时使用相同温度海水以保证养殖温度的稳定。实验期间每天投喂等量的小球藻(Chlorella vulgaris),保持微充气。实验6、12、24、48、72 h 时,每组分别随机取8 个个体,剪取鳃组织,经液氮速冻,置于-80 ℃冰箱冷冻保存。
1.2 方法
1.2.1Perlucin基因全长克隆 参考刘雅[22]采用Trizol 法提取马氏珠母贝闭壳肌、外套膜、鳃、足、性腺和肝胰腺的总RNA,RNA 用20~40 μL DEPC 水(焦碳酸二乙酯处理并经高温高压灭菌的去离子水)溶解。用琼脂糖凝胶电泳检测RNA 完整性,用Nano DropND1000 紫外分光光度计检测RNA 的纯度及浓度。参照SMARTTM RACE cDNA Amplification Kit的说明书制备5ʹRACE、3ʹRACE模板。
利用巢式PCR 扩增获得Perlucin基因未知的3ʹ和5ʹ序列。反应体系(10µL):Ex Taq DNA 聚合酶0.1µL,10×Buffer 1µL,dNTPs 1.6µL,上下游引物各0.8 µL,cDNA 模板0.4 µL,去RNA 酶水5.3 µL。反应程序:95 ℃5 min;95 ℃30 s,60℃30 s,72℃40 s,40 个循环;72 ℃10 min。通过琼脂糖凝胶电泳检测PCR 产物片段长度,将与目的片段长度一致的PCR 产物连接到pMD19-T 载体,并转化到DH5α大肠埃希菌细胞中,用LA(含有氨苄)选择培养基培养,挑取阳性菌送往生工生物工程(上海)股份有限公司测序。用软件DNAMAN将测序获得的3ʹ和5ʹ序列与基因组中已知部分(已验证)[23]拼接,得到全长序列。根据文献[23]的基因组数据库Perlucin的部分序列,用软件Primer Premier5.0 根据引物设计要求设计引物(表1)。

表1 本研究的引物序列Table 1 Primers used in perlucin expression analysis
1.2.2Perlucin的生物信息学分析 用软件DNAMAN 推导Perlucin基因全长的氨基酸序列;用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder)找到Perlucin的开放阅读框;通过Pfam(https://pfam.xfam.org/search)预测该基因的保守结构域;用ExPASy-ProtParam tool 分析氨基酸的理化性质,SignalP5.1软件预测信号肽;TMHMM Server软件分析氨基酸的跨膜结构;采用NCBI COBALT(https://www.ncbi.nlm.nih.gov/tools/cobalt/)和DNAMAN9进行多序列比对,Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测蛋白的三级结构;用MegaX构建生物系统发育树。
1.2.3Perlucin的组织表达及温度胁迫下的差异分析 采用实时荧光定量PCR(qRT-PCR)分析Perlucin基因的mRNA 表达。以β-actin为内参基因[22-24],利用2-ΔΔCt法计算Perlucin基因在不同组织以及在实验温度下各时间点的相对表达量。qRTPCR 反应体系(10 μL):上下游引物各0.4 μL,cDNA模板0.4 μL,2×PerfectStart Green qPCR SuperMix 5 μL,灭菌ddH2O 3.8 μL。反应条件:95 ℃5 min;95 ℃10 s,60 ℃15 s,72 ℃15 s,45 个循环;熔解曲线为95 ℃10 s,65 ℃60 s,95 ℃1 s。每组各3个样本。使用SPSS 22.0 软件对各表达量数据均值进行单因素方差分析,如数据不符合正态分布,则对相对表达量数据进行对数(ln)转换,使数据符合方差齐性检验,再对数据进行邓肯分析,设定显著性水平为0.05。结果以平均值±标准差形式表示。
1.2.4Perlucin基因SNP 筛选及分析 外显子区SNP位点分析的耐低温选育系F3代(R)和北部湾野生群体(W)30 个个体的基因组重测序数据库参考文献[21]。根据文献[21]获得R 和W 的全基因组重测序数据,提取Perlucin的外显子SNP位点;分别利用软件Popgene32、PIC_CALC、HAP1loview4.2、SPSS22.0 计算SNP 的基因型、基因频率、多态信息含量(PIC)、观测杂合度(Ho)、期望杂合度(He)与哈迪-温伯格平衡(哈-温平衡,HWE)等遗传参数,进行群体R和W的卡方检验和SNP的差异统计分析。
2 结果与分析
2.1 Perlucin序列分析
马氏珠母贝Perlucin全序列总长为631 bp,5ʹ端非编码区(UTR)为55 bp,3ʹUTR为116 bp,开放阅读框(ORF)为459 bp,共编码152 个氨基酸(图1)。分析其蛋白序列的理化性质,发现其相对分子质量为17 137,分子式为C772H1158N220O206S10,等电点为9.50,具有10 个负电荷的残基(Asp+Glu)和20 个带正电荷的残基数(Arg+Lys);总平均亲水性为-0.184,属于亲水性蛋白。经预测,其保守结构域有1个C型凝集素结构域(Lectin-C),位 于24—149(图1)。Perlucin 还具有1 个信号肽,位于1—20,预测出1 个跨膜结构(图2),位于4—16。二级结构预测结果显示,Perlucin 蛋白序列由28.95%α 螺旋、25.66%延伸链、4.61%β转角和40.79%无规卷曲组成。
2.2 Perlucin多序列比对以及进化树构建
马氏珠母贝Perlucin 与紫贻贝(Mytilus galloprovincialisVDH90866.1)、长牡蛎(Crassostrea gigasXP_034311602)、棘冠海星(Acanthaster planciXP_022090740)、海星(Patiria miniataXP_038045941)、欧文虫(Owenia fusiformisCAH1798313.1)、圆毛好转虫(Dimorphilus gyrociliatusCAD5122556.1)、果蝇(Drosophila pseudotakahashiiKAH8352600.1),黑腹果蝇(Drosophila melanogasterNP_001137766)、剑尾鱼(Xiphophorus helleriiXP_032422573)、白梭吻鲈(Sander luciopercaXP_031150883)、拟鳄龟(Chelydra serpentineKAG6923368.1)、棱皮龟(Dermochelys coriaceaXP_038234280)、彩冠雉(Penelope pileataNXC48108.1)、鹊雁(AnseranassemipalmataNXI73468.1)Perlucin 的多序列比对结果(图3)显示,Perlucin 在不同物种间的N 端保守性较低,但结构域CLECT所在区域较为保守。

图3 Perlucin的多序列比对分析结果Fig.3 Multiple sequence alignment of Perlucin
上述15个物种的Perlucin蛋白序列的系统发育树和结构域分析(图4)显示,马氏珠母贝与长牡蛎、紫贻贝的Perlucin聚为一支。

图4 Perlucin的系统发育树和结构域Fig.4 Phylogenetic tree and domains of Perlucin
2.3 Perlucin三级结构预测
图5可见,马氏珠母贝Perlucin蛋白质三级结构与紫贻贝、白梭吻鲈和棱皮龟基本一致。
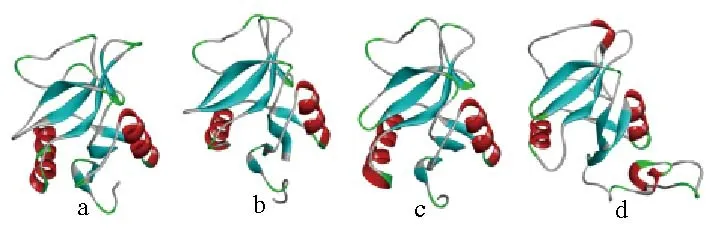
图5 马氏珠母贝(a)、紫贻贝(b)、白梭吻鲈(c)和棱皮龟(d)Perlucin蛋白三级结构Fig.5 Spatial structure of Perlucin protein in Pinctada fucata martensii(a),Mytilus galloprovincialis(b),Sander lucioperca(c)and Dermochelys coriacea(d)
2.4 Perlucin组织表达及低温胁迫下的差异表达
在分析健康组织表达数据及低温胁迫时鳃组织表达数据时,发现数据不符合正态分布,对数据进行对数(ln)转换后,数据均符合正态分布,组织表达、低温胁迫鳃组织表达数据的方差齐性检验显著性分别为0.053、0.352,均符合方差齐性检验。分析显示:Perlucin在马氏珠母贝闭壳肌、鳃、性腺、足、肝胰腺和外套膜中均有表达,在闭壳肌中表达量极低,在鳃中表达量显著高于除肝胰腺和足以外的其他组织(P <0.05)(图6);在低温17 ℃组,马氏珠母贝Perlucin的表达量先升高后下降,其中在12~48 h显著高于对照组(P <0.05)(图7)。
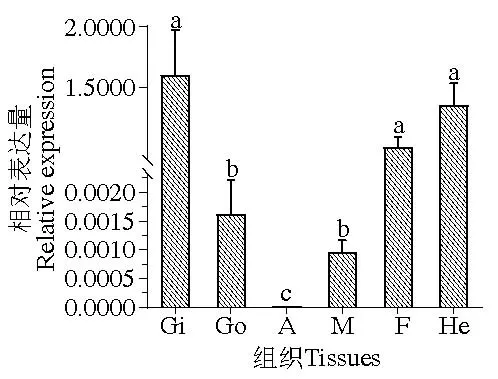
图6 Perlucin基因在马氏珠母贝不同组织中的表达Fig.6 Perlucin gene expression in different tissues of Pinctada fucata martensii
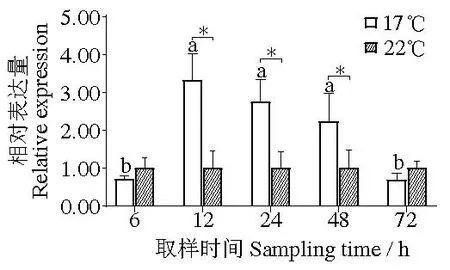
图7 17、22 ℃下马氏珠母贝鳃中Perlucin基因的时序表达Fig.7 Temporal expression of Perlucin gene in gills of Pinctada fucata martensii at 17 and 22 ℃
2.5 Perlucin基因SNP位点遗传多态性分析
Perlucin基因的外显子共发现30 个SNP 位点。这些SNP 位点PIC 为0.016 3~0.371 0,其中,21 个位点为低度多态性(PIC <0.25),9 个为中度多态性(0.25 <PIC <0.50);Ho为0.016 7~0.533 3;He为0.016 7~0.495 2(表2)。
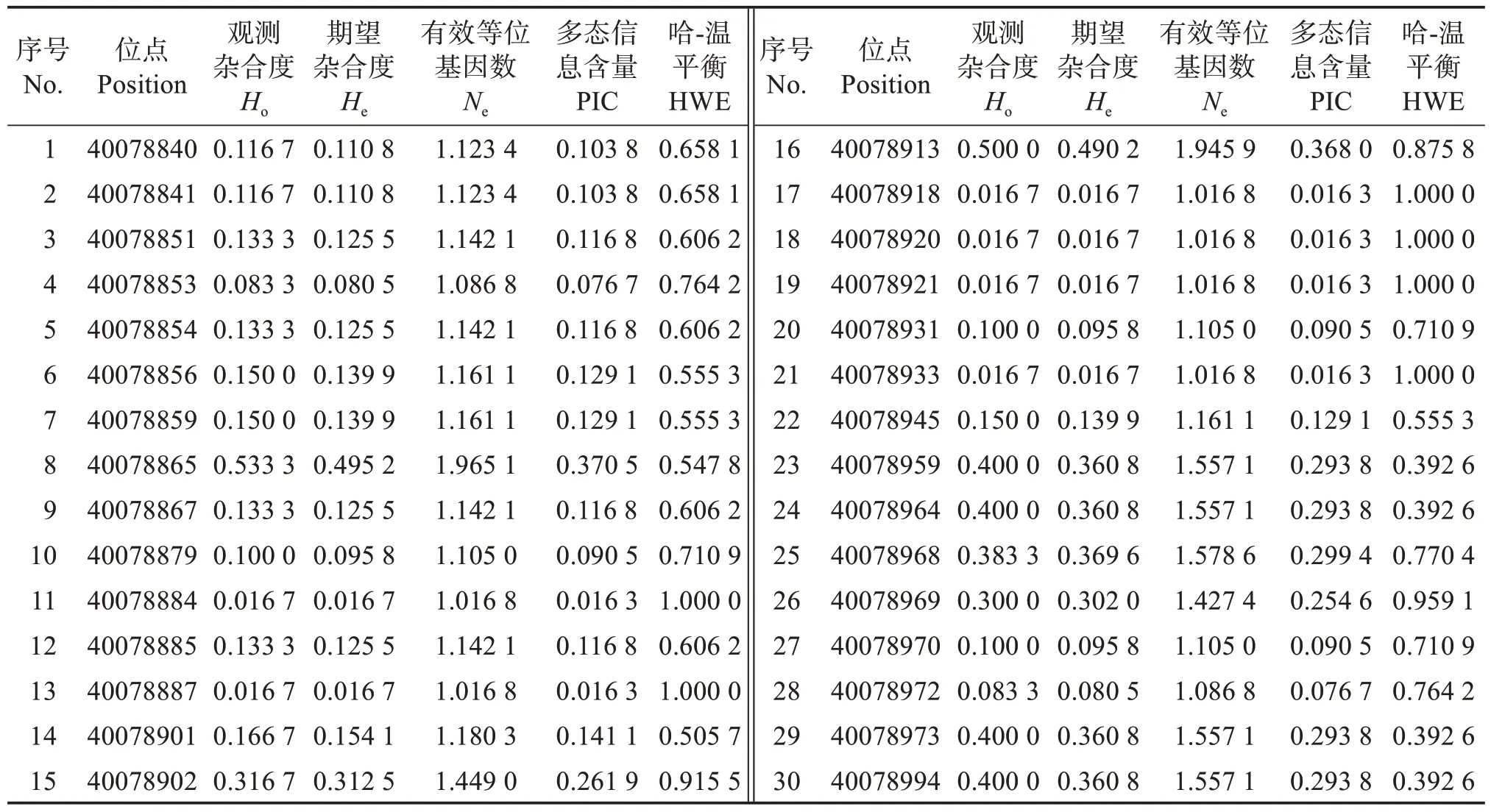
表2 Perlucin基因的SNP多态性Table 2 Haplotype of SNPs in Perlucin gene
2.6 Perlucin基因SNP位点与耐低温关联性分析
表3 表明,Perlucin外显子区域的30 个SNP 位点中,13个SNP位点在群体W 和R之间存在显著差异(P <0.05),表明这13 个SNP 与耐低温性状显著相关。频率差异最大的前2 个位点如下:g.40078865 的GT 基因型在群体R 和W 中的频率分别为76.7%和30.0%;g.40078913 的基因型CT 在两个群体中的频率分别为73.3%和26.7%;仅在R 群体被检测到的位点共2 个,分别是位点g.40078856、g.40078945。其中位点g.40078856 为同义突变,位点g.40078945 为非同义突变,在R 群体中AG 基因型,该位点处编码的氨基酸由精氨酸变为赖氨酸。
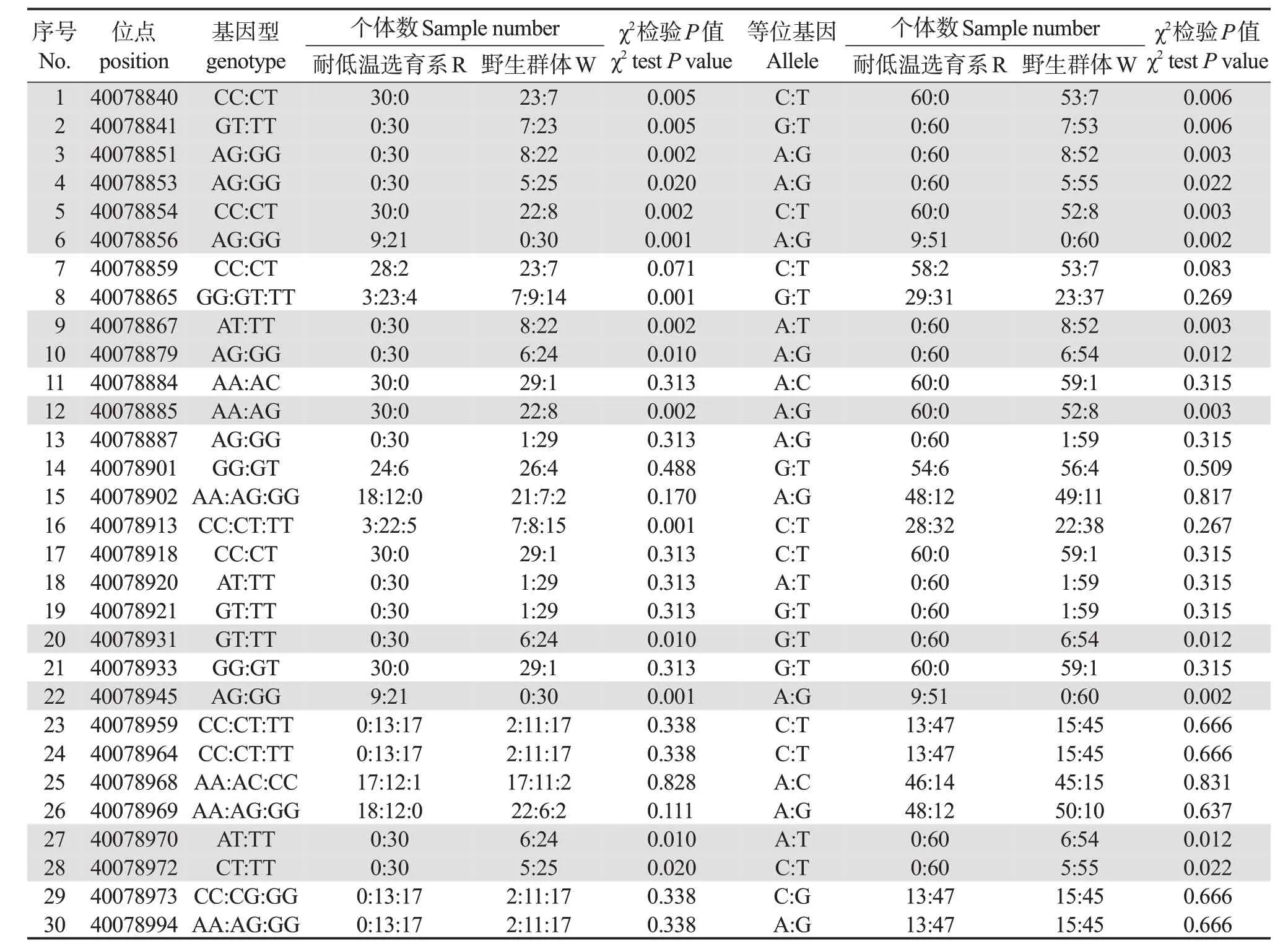
表3 Perlucin外显子SNP位点及其基因型在群体R和W间分布频率Table 3 Frequency distribution of Perlucin exon SNP loci and their genotypes in populations R and W
3 讨论
凝集素在无脊椎动物免疫防御反应中发挥作用,在软体动物的免疫识别和逆境应答中担任极重要角色。本研究扩增得Perlucin的全长序列,其具有1 个信号肽,1 个跨膜结构,属于跨膜蛋白;存在1 个典型的C 型凝集素结构域,说明它属于典型的C 型凝集素成员。C 型凝集素结构域包含多个糖识别域,可参与吞噬作用[25],细胞因子释放[26]、聚集[27],抗菌活性和细胞黏附[1,28-29]等多种免疫反应。马氏珠母贝Perlucin 氨基酸结构域序列部分与其他物种的Perlucin相似性较高,表明Perlucin的功能在物种间较为保守,且Perlucin系统发育树与长牡蛎、紫贻贝等软体动物聚为一支,区别于脊椎动物和其他无脊椎动物,表明Perlucin在物种分化过程中较为保守。
Dodenhof 等[30]研究发现,Perlucin基因是珍珠层有机基质的蛋白质之一,在生物矿化过程中发挥重要作用。本研究表明,Perlucin基因在与矿化有关的外套膜组织[31]中表达量极低,说明马氏珠母贝Perlucin基因可能不参与贝壳的钙化。Perlucin在马氏珠母贝的鳃和肝胰腺等组织中表达量较高。在香港牡蛎中有类似结果:在多种组织中均有表达,在唇瓣中表达量最高,其次是消化腺(包含肝胰腺)[8]。鳃组织是双壳贝类抵御外界刺激的第一道防线,是与外界环境接触的主要器官,在机体抵抗逆境时起重要作用[32]。菲律宾蛤仔通过调节鳃组织的脂肪酸代谢来响应低温的胁迫[16],高温下虾夷扇贝鳃组织结构变化明显[33],说明鳃是贝类响应温度胁迫的重要器官。本研究对马氏珠母贝进行低温胁迫,发现低温处理组在12 h 时,鳃组织中Perlucin基因的表达量显著高于对照组,说明低温胁迫下,Perlucin基因可能参与马氏珠母贝的低温胁迫应答。
作为最理想的DNA分子标记,SNP在水产动物的育种研究中有重要作用,陈晓敏等[34]和Du等[35]发现,凡纳滨对虾功能基因CAT、all-53308外显子SNP位点可能会发生改变,影响到机体的抗逆性。在功能基因转录过程中,前体RNA中的内含子区域剪除后留下的外显子区域转为成熟的mRNA,然后翻译成蛋白质。因此,外显子区域的SNP 位点不仅可作为分子标记,其多态性变化还会影响基因功能。其中,位于编码区的SNP 位点变化会产生同义突变和非同义突变两种效应。同义突变虽不引起编码氨基酸的改变,但可影响基因的转录和翻译等;非同义突变引起蛋白质序列发生改变,从而可能影响蛋白质的功能,导致生物性状的改变[36]。例如,在人类基因组中,多药耐药1 多肽是药物或其他外源性物质的多特异性外排转运体蛋白。编码该蛋白的基因外显子区域SNP 3435C >T 同义突变,影响了RNA 的二级结构,从而导致RNA 稳定性变化,进而导致mRNA 表达的差异[37]。此外,编码区SNP 多态性还会引发非同义突变,从而引起蛋白功能的变化。例如,在葡萄糖-6-磷酸酶(G6PC2)基因中的4 个非同义突变导致其酶活性降低[38]。本研究分析了马氏珠母贝群体R 和W 的Perlucin的外显子区域,共检测到30 个SNP 位点,其中13 个位点的基因型频率在群体W 和R 间差异显著,位点g.40078856和位点g.40078945的AG 基因型在群体R和W 中的频率分别为30%和0%,表明在三代的人工选育后形成选择压力,其位点基因型频率的改变可能与选育系低温耐受能力之间有密切关系,相似于陈琨等[24]和Lai 等[39]对马氏珠母贝PEPCK和PIAS基因的研究结果。此外,位于基因编码区的SNP 位点除作为分子标记以外,也可能会引起基因功能变化。本研究中,Perlucin基因有两个SNP 位点g.40078856(G >A)和g.40078945(G >A)仅在R 群体被检测到。位点g.40078856 为同义突变,提示其可能会影响该基因mRNA 的转录或稳定性,导致基因表达的变化。g.40078945在R 群体中出现的G 突变导致其发生非同义突变,由精氨酸变为赖氨酸。两种氨基酸均属于碱性氨基酸,但赖氨酸的碱性弱于精氨酸,且非同义突变位置在结构域内部,提示其可能会影响到蛋白质的功能,但对蛋白质功能产生的影响还需进一步的实验验证。以上研究结果可为进一步深入研究Perlucin基因在马氏珠母贝应对环境温度变化的作用机制提供重要参考。
4 结论
本研究通过基因克隆获得Perlucin基因,开展低温胁迫实验,发现马氏珠母贝Perlucin基因表达量在17°C 低温组先升高后下降,其中Perlucin的表达量在12~48 h 时比对照组显著升高。同时通过对马氏珠母贝R群体和W 群体Perlucin基因SNP分析显示,位点g.40078856、g.40078945 的基因型AG只在R 群体中被检测到,说明R 群体中该基因受到了选择压力。
