‘金湘玉’黄桃果实糖与类黄酮代谢及转录组测序分析
2024-01-26陈为峰王春发张良波
陈为峰,王春发,黄 佳,李 杜,张良波
(1.湖南省园艺研究所,湖南 长沙 410125;2.衡阳市农业科学院,湖南 衡阳 421100;3.衡南鸿祥种养专业合作社,湖南 衡阳 421125)
果实的甜酸风味主要由糖和有机酸的含量及比例决定,是影响水果感官特性的重要因素[1-2]。黄酮醇类化合物是重要的次生代谢物质,不仅能影响植物的生长发育,在植株抗菌防病方面也发挥了重要作用[3]。近年来,随着分子生物技术和生物信息学的发展,转录组学的应用越来越广泛,对果实品质的研究也已进入转录水平阶段[4-5]。例如:李文彬[6]在‘红阳’猕猴桃果实中发现与蔗糖相关的基因SPS、SPP以及与代谢相关的基因AI、NI、SuSy、FK和HK,这些基因的表达水平都随着果实糖含量的增加而升高。Zhang 等[7]从桃果实中克隆出蔗糖代谢酶及碳水化合物变化相关基因CINV1、CWINV1、CINV2、SUS1、SUT1及SPS1。周兰[8]的研究表明,CHI、F3H、PAL、FLS等基因在类黄酮化合物合成中起作用,但果实不同部位这些基因的表达量不同,在栽培型苹果的果肉中,类黄酮物质的含量远远低于果皮。这些与生物代谢相关的研究结果为探明果实生长发育过程有机物积累的机理奠定了坚实基础。
‘金湘玉’黄桃(Prunus persica'Jinxiangyu')是湖南省林业科学院最新选育出的湖南省首个自主知识产权的早熟黄桃新品种,为了探明该品种黄桃果实的糖成分及类黄酮物质的积累代谢规律,笔者分析了相关代谢关键基因的表达差异,以期挖掘出调控果实优良品质形成的关键基因,为实现黄桃分子育种,加快黄桃新品种更新提供参考。
1 材料与方法
1.1 试验材料
供试‘金湘玉’黄桃取自湖南省沅陵县太常安置区果园(110°21'8.09″E,28°28'7.15″N,海拔120 m)。采样是从桃树谢花后20 d 开始,每隔10 d 采摘1 次,果实开始成熟后5 d 采摘1 次,直到果实完全成熟。从树势健壮、栽培管理基本一致的3 棵‘金湘玉’果树树冠中部位置上分别采摘5 个大小均匀、无损伤、无虫害的果实,去皮切碎后用液氮速冻,置于-70℃超低温冰箱保存备用。
1.2 试验方法
1.2.1 果实可溶性糖含量的测定 可溶性固形物含量参照NY/T2637—2014 采用数显手持折光仪进行测定;可溶性总糖含量采用蒽酮硫酸法测定[9];果实中蔗糖、葡萄糖、果糖、山梨醇含量采用索莱宝科技有限公司的相关试剂盒进行测定。
1.2.2 果实黄酮类化合物含量的测定 称取0.25 g 果实样品,用1.5 mL 酚类提取液(水∶甲醇∶甲酸=25 ∶24 ∶1,体积比,下同)研磨混匀,10 400 r/min离心20 min;经0.22 µm 滤膜过滤上清液,然后用液相色谱检测类黄酮含量。流动相A(乙腈∶甲酸=9 ∶1)与流动相B(水∶甲酸=9 ∶1)的梯度洗脱程序设置为:95%A 0 min、85%A 25 min、78%A 42 min、64%A 60 min、95%A 65 min,最后平衡5 min,共70 min;流速为1 mL/min;分析柱和保护柱为ODS-3 色谱柱(5.0 µm,4.6 mm×250 mm),柱温35℃;在365 nm 波长下检测黄酮醇类化合物的含量。
1.2.3 转录组测序 根据‘金湘玉’果实发育过程糖分的积累规律,选取花后30 d(A2)、花后60 d(A5)、花后90 d(A9)3 个不同发育期的果实,作为RNA提取和转录组测序的材料。采用Nano Drop 2000 分光光度计检测RNA 浓度与纯度,RNA 条带完整性质量结果用1%琼脂糖凝胶电泳进行检验;RNA 质检合格后,用 Illumina Hiseq 测序平台进行高通量测序,该步骤委托广州基迪奥生物科技有限公司完成。参考基因组版本为Prunus_persica_genome_v2.0.a1(https://www.rosaceae.org/species/prunus_persica/genome_v2.0.a1)。
1.2.4 qRT-PCR 验证 取1µL 质检合格的RNA 样品按照M5 Super plus qPCR RT kit with gDNA remover试剂盒说明书反转录合成cDNA。利用Primer 3 Plus软件对7 个基因的CDS(Coding sequence)序列设计特异性引物,选择Pp RPL13作为内参基因。引物序列见表1,所有引物均由北京擎科生物科技有限公司合成。qRT-PCR 反应体系(20 µL):Template DNA 2 µL,2×M5 HiPer SYBR Premix EsTaq(withTli RNaseH) 10 µL,上下游引物各0.4 µL,ROX Reference Dye(50×)or ROX Reference Dye II 0.4 µL,ddH2O 6.8 µL。qRT-PCR 反应程序:95℃ 30 s 预变性;95℃ 5 s,60℃ 30 s,40 个循环。按照2-ct 法计算基因相对表达水平,每个样品进行3 次生物学重复。
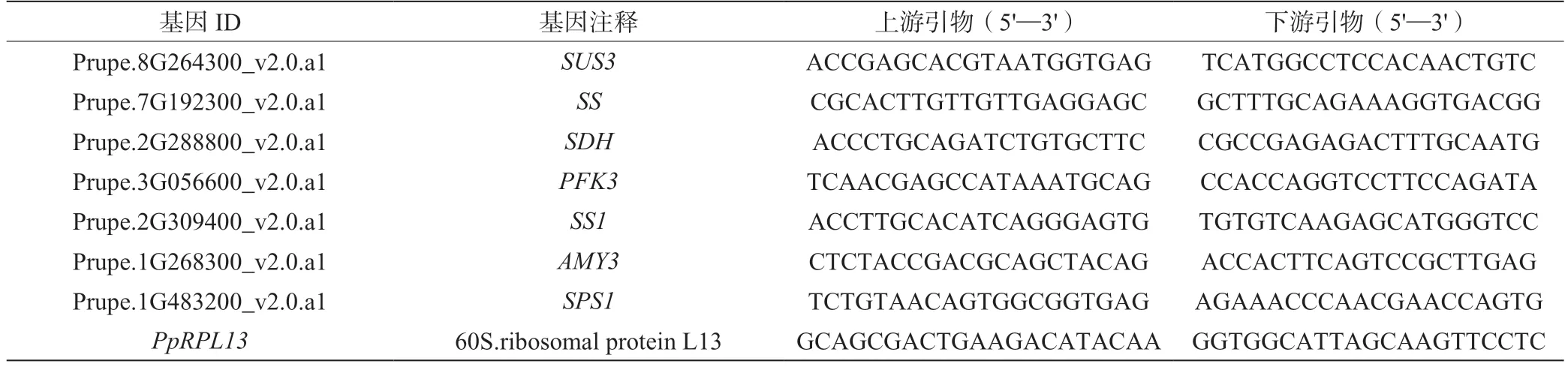
表1 基因引物序列
1.3 数据处理
采用Microsoft Excel 2010 软件处理原始数据,SPSS19.0 软件进行相关性分析,Primer3Plus 在线软件设计引物,Origin 2021 软件作图或进行图片处理。
2 结果与分析
2.1 ‘金湘玉’黄桃果实糖积累动态变化规律
由图1 可知,在花后20~90 d 期间,随着黄桃果实的不断发育,可溶性总糖含量总体呈上升趋势,可溶性固形物含量总体呈先降后升的趋势。花后20~50 d,黄桃果实的葡萄糖、蔗糖、果糖含量均呈先升后降的趋势;花后50~90 d,蔗糖和果糖含量均迅速上升,果糖含量在花后85 d 达到峰值,含量为54.38 mg/g,蔗糖含量在花后90 d 达到峰值;山梨醇含量随果实成熟整体呈现下降趋势,在花后85 d 含量最低。
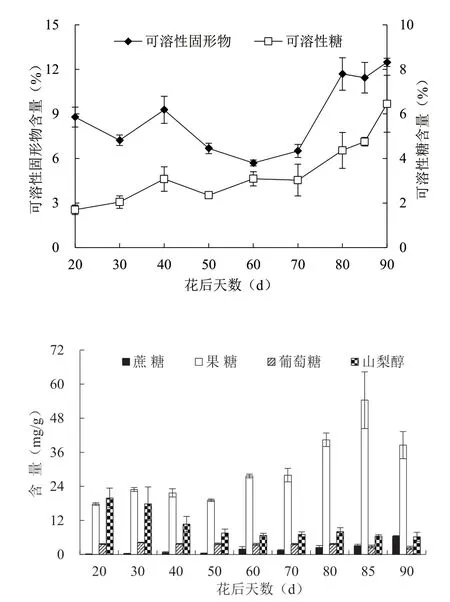
图1 ‘金湘玉’黄桃果实发育过程糖含量的变化
2.2 ‘金湘玉’黄桃果实类黄酮物质的积累动态变化
由图2 可知,‘金湘玉’黄桃果实中,槲皮素苷含量在花后20~50 d 含量较高,随着果实逐渐成熟其含量有所下降;山奈素苷含量总体上呈先升后降的变化趋势,但波动较为平稳,在花后80 d 达到最大值。

图2 ‘金湘玉’黄桃果实发育过程类黄酮物质含量的变化
2.3 ‘金湘玉’黄桃果实转录组测序数据的分析
对处于发育关键期(花后30、60、90 d)的‘金湘玉’果实样品进行转录组测序,结果如表2 所示,共获得3 612 万~ 4 489 万条Raw reads,单个样品平均获得40 173 908 条Raw reads,经质量过滤后平均得到39 969 440 个Clean reads,且碱基Q20 百分比在96.59%~97.97%之间,均超过了95%,Q30 的百分比在91.09%~93.97%之间,均超过了90%,核苷酸GC 含量在45.81%~47.56%之间,且数据整体测序错误率小于0.03%,说明转录组测序质量较好,测序结果可进行后面的数据组装。

表2 ‘金湘玉’黄桃果实转录组测序数据统计
2.4 ‘金湘玉’黄桃果实糖代谢关键基因的筛选
对3 个发育关键时期样品的转录组数据进行筛选,结果如图3 所示,共发现181 个基因参与果实果糖和甘露糖代谢(ko00051)、糖酵解/糖异生代谢(ko00010)、戊糖和葡萄糖醛酸的相互转化(ko00040)、半乳糖代谢(ko00052)、淀粉和蔗糖代谢(ko00500)。其中,有26 个差异基因参与果实果糖和甘露糖代谢,有34 个差异基因参与果实糖酵解/糖异生代谢,有30 个差异基因参与戊糖和葡萄糖醛酸的相互转化,有22、69 个差异基因分别参与半乳糖代谢、淀粉和蔗糖代谢。由此可知,在‘金湘玉’黄桃果实中参与淀粉和蔗糖代谢的差异基因数量最多,参与半乳糖代谢的差异基因数量最少。

图3 糖代谢途径差异表达基因个数统计
2.5 糖代谢关键基因在‘金湘玉’果实3 个发育关键时期的表达分析
进一步对‘金湘玉’果实3 个发育关键时期转录组数据进行两两对比,以3 个生物学重复的基因表达量求平均值,筛选满足|log2(fc)|>1、P<0.05、FDR<0.05 的显著表达的差异基因,结果如图4 所示,在淀粉与蔗糖代谢过程中INVA、INV*DC4和SUS3在果实发育的过程中表现为显著下调,SUS3、INVA基因在花后30 d 的表达量较高,随果实的成熟在花后90 d 几乎不表达;SS、SS1、SPS1基因在果实发育的过程中表现为显著上调,花后90 d 表达量较高,这与果实发育过程中蔗糖逐渐积累的结果一致。在果糖和甘露糖代谢过程中,PMI1在果实发育的过程中表现为显著下调;SDH、PFK3基因在果实发育的过程中表现为显著上调,其中SDH(Prupe.2G288800_v2.0.a1)基因在3 个时期的表达量都很高,FPKM 值分别为697.63、1 140.78、1 853.14。

图4 ‘金湘玉’果实3 个发育关键时期糖代谢基因的差异表达分析
2.6 类黄酮代谢关键基因在‘金湘玉’果实3 个发育关键时期的表达分析
由图5 可知,在类黄酮生物合成过程中,ANS、DFR、F3H及FLS基因的表达量在花后30~60 d 呈显著上调趋势,花后60~90 d 呈显著下调趋势,基因表达量的FPKM 值在花后90 d 很低;CHI基因的表达量在花后30~90 d 表现为显著下调。苯丙烷类物质生物合成中,4CL3基因的表达量在花后30~90 d 呈显著下调趋势,4CL1、PAL1基因的表达量在花后30~60 d 呈显著上调趋势,在花后60~90 d 呈显著下调趋势。
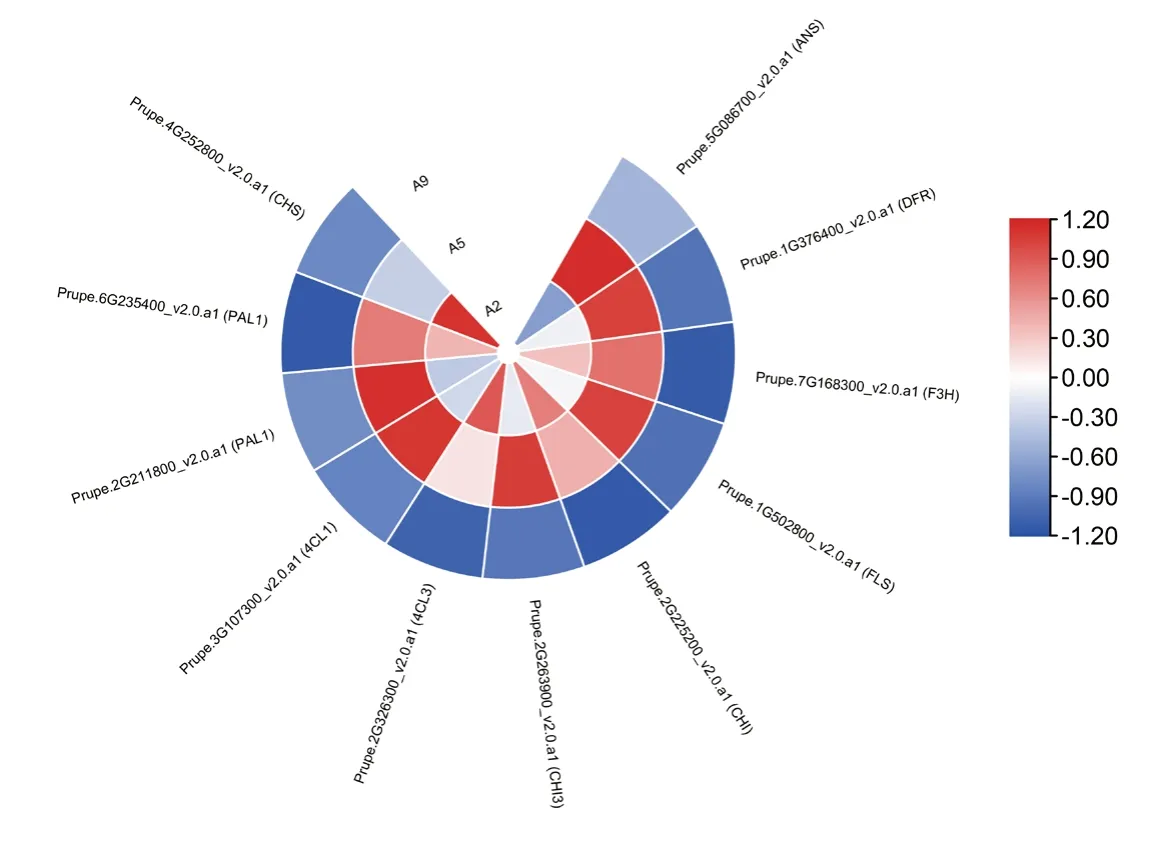
图5 ‘金湘玉’果实3 个发育关键时期类黄酮代谢基因的差异表达分析
2.7 qRT-PCR 验证测序结果
为了进一步验证‘金湘玉’果实转录组测序结果的准确性,从RNA-Seq 测序数据中挑取与糖代谢相关的7 个差异表达基因(SUS3、SS、SDH、PFK3、SS1、AMY3、SPS1),通过qRT-PCR 对基因的表达量进行检验,结果如表3 所示,这7 个基因的qRT-PCR 相对表达量与转录组测序的FPKM 值相对表达量的动态变化趋势基本一致。这表明转录组测序表达谱结果是可靠的。
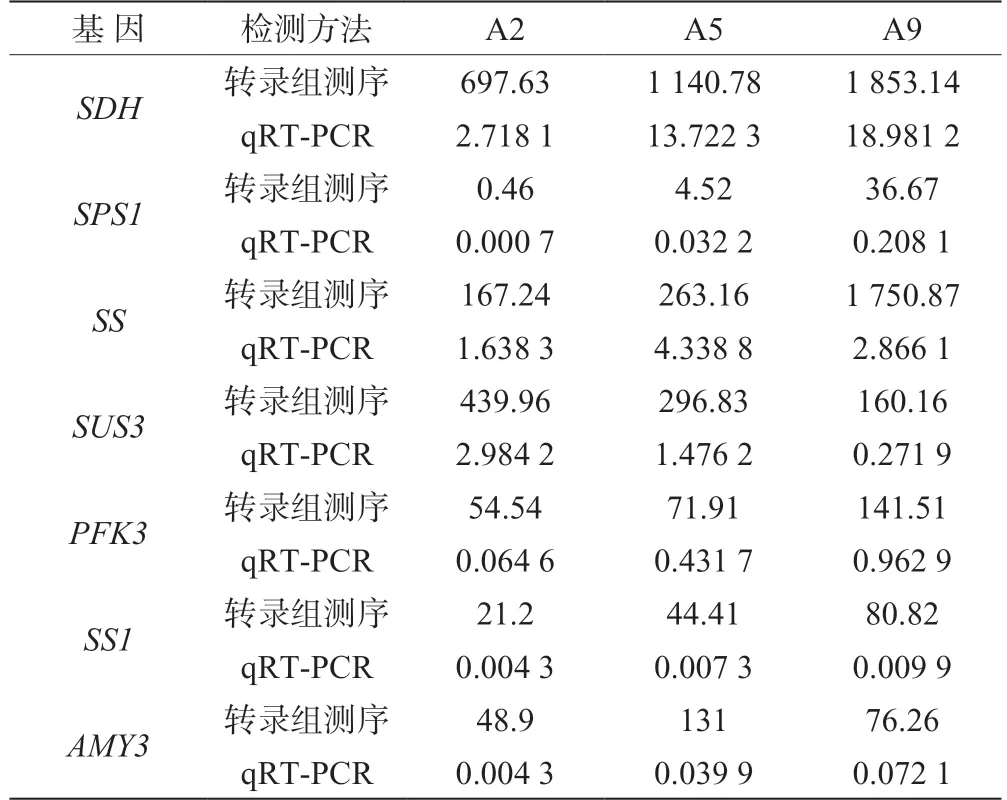
表3 不同方法对‘金湘玉’黄桃果实各发育时期差异表达基因表达量的检测结果
3 讨 论
果实的内外在品质是水果质量评估的重要指标,是影响果农收益和商品市场竞争力的重要因素[10-11]。前人研究发现,不同植物果实中的糖组分及含量不同,甚至同一种果实不同品种间的糖组分及含量也存在较大差异。张颖[12]的研究发现,4 种不同桃品种间果糖含量和蔗糖含量存在差异,花后90 d,‘菁香’桃果实蔗糖含量较高,‘锦绣’黄桃果糖含量最高。前人研究还发现,桃果实栽培种的糖类型大多以蔗糖为主。该试验结果显示,‘金湘玉’黄桃幼果发育期的蔗糖含量极低,该时期糖分主要以果糖和山梨醇为主,山梨醇含量在整个果实生长发育过程中呈现明显的下降趋势,说明山梨醇进入果实后不是一直以山梨醇的形式存在,而是会逐渐转化为果糖和葡萄糖;成熟的‘金湘玉’黄桃果实中果糖的含量最高,使其具有较高的口感甜度。大多数桃品种的果实生长期为110~140 d,而‘金湘玉’的果实生长期较短,为85 d 左右,为早熟品种,由于‘金湘玉’果实发育时间短,因此成熟果实中蔗糖积累较少。
糖代谢是在相关酶基因的调节下完成的,果实生长发育不同阶段相关代谢基因表达的差异可能导致不同阶段糖积累出现差异[13-14]。该研究对‘金湘玉’果实发育3 个不同时期的转录组数据进行差异基因分析发现,具有显著表达差异的基因中SS与SS1基因的表达量水平相差较大,SS基因的表达量远远高于SS1,这2 个基因都可以调控果实糖分的积累,其中SS基因的调控作用更明显;在果实发育过程中,SPS1与SPS4的表达量变化趋势不同,其中SPS1基因在花后30 和60 d 几乎不表达,在花后90 d 表达量升高,SPS4花后30 和90 d 表达量较低,在花后60 d 表达量稍有升高;INV*DC4和INVA均只在花后30 d 表达量很高,在花后90 d 几乎不表达,且INVA基因表达量远高于INV*DC4。前人研究表明,幼果中的SUS1更接近典型的SUS。在植物中,SUS1在蔗糖的分解中发挥主要作用,为细胞壁构建或糖酵解提供底物,随着果实的成熟,SUS2活性增加,并在蔗糖的快速积累中发挥作用[15]。该试验结果显示,SUS2在整个发育过程表达量极低(3个时期FPKM 值分别为0.30、25.78、0.01),SUS3基因在幼果期表达量较高(FPKM 值达439.96),但随着果实的成熟呈下调趋势,因而推测INVA、SUS3基因在花后30 d 是使蔗糖分解为果糖和葡萄糖的关键基因;2 个SDH基因的表达量在花后30~90 d均表现为上升趋势,其中SDH(Prupe.2G288800_v2.0.a1)表达水平较高且持续上调,推测该基因对果实发育后期果糖含量的积累调控作用较强。综上所述,随着果实的成熟,蔗糖合成方向基因SPS1、SS与SS1的表达水平持续上调,对果实中蔗糖含量起着关键作用;SUS3、INVA基因在果实发育前期表达水平较高促进蔗糖的降解,这些基因的调控影响着‘金湘玉’果实糖类含量的变化。
该研究还发现,参与类黄酮物质代谢的相关基因如ANS、DFR、F3H、FLS、4CL1和PAL1等基因在‘金湘玉’果肉中的表达量较低,这与果肉中测出槲皮素苷及山奈素苷含量较低的结果一致,而这些结构基因相互作用共同影响了类黄酮物质的合成。
