缺血性脑卒中患者发生氯吡格雷抵抗的危险因素分析
2024-01-25王亚娟李维亮余爱荣湖北科技学院湖北咸宁437000中部战区总医院临床药学科湖北武汉430070
王亚娟,赵 燕,李维亮,余爱荣 (1.湖北科技学院, 湖北 咸宁 437000;.中部战区总医院临床药学科, 湖北 武汉 430070)
在全球范围内,缺血性脑卒中(IS)仍然是导致 死亡和严重残疾的最主要原因之一[1]。在IS 的治疗过程中,除因出血风险而存在禁忌外,几乎所有IS 的患者都应给予抗血小板药物进行二次卒中预防[2], 阿司匹林联合氯吡格雷的双重抗血小板治疗在IS 发病早期发挥着重要作用[3]。然而临床应用中,脑血管病患者在服用氯吡格雷药物治疗期间存在个体差异,一些患者在服药后出现了病情反复发作或者病情加重的现象,称为氯吡格雷抵抗(CR)[4]。研究表明,导致氯吡格雷抵抗的因素是多种多样的,尚无统一的结论。包括性别[5-6]、年龄[6]、BMI[6-7]、糖尿病[5,8]、高脂血症[8]、高同型半胱氨酸[5,8]、药物间相互作用[8](钙离子拮抗剂、质子泵抑制剂)、遗传基因多态性[9-10](参与氧化代谢的相关基因CYP2C19、与其活化有关基因ABCB1)等均会导致该药物出现抵抗现象。但亦有部分研究报道得出相反结论[11]。且研究主要集中于心血管领域,尤其是经皮冠状动脉介入(PCI)术后患者,而针对IS 患者发生CR 影响因素的报道相对较少。氯吡格雷属于噻吩吡啶类化学衍生物,需要在多种酶的参与下才能够生成有活性的化合物,该活性代谢产物与血小板上的二磷酸腺苷(ADP)受体P2Y12 共价特异性地结合,减少ADP 所刺激的血小板凝聚,阻断ADP 诱导的糖蛋白与纤维蛋白原PIIb/IIIa 受体的结合,发挥抗栓的效应[12-13]。故本研究利用血栓弹力图(TEG)测定ADP 数值,对脑卒中患者的基线资料及CYP2C19 基因多态性进行统计分析,评估产生CR 现象的影响因素,为IS 临床个体化用药、预测卒中复发风险提供精准医疗方案。
1 材料和方法
1.1 研究对象
本研究利用HIS 系统选取2021 年4 月至2022 年7 月在中部战区总医院神经内科住院治疗的IS 患者。(1)纳入标准:①符合《中国脑急性缺血性脑卒中诊治指南》[14]或IS 的相关诊断,且经CT 或MRI 影像学等证实;②年龄均>18 岁;③未进行静脉溶栓或取栓治疗;④均采用氯吡格雷联合阿司匹林进行抗血小板治疗。(2)排除标准:①存在出血性疾病或颅内感染者;②合并恶性肿瘤或严重心、肝、肺、肾脏器官功能衰竭者;③有认知障碍者;④依从性差者;⑤对本研究药物过敏者。该研究已获得中部战区总医院医学伦理委员会审查批准,审查号:[2021]025-01。
1.2 治疗方法
所有入组患者入院后均给予改善循环(银杏达莫)、稳定血斑块(阿托伐他汀)、护胃(泮托拉唑)等常规治疗。在常规治疗基础上给予阿司匹林(拜耳医药保健有限公司,国药准字:J20171021,规格:100 mg/片)100 mg 每日一次和硫酸氢氯吡格雷[赛诺菲(杭州)制药有限公司,国药准字:H20056410,规格:75 mg/片]75 mg 每日一次,均为3 个月一个疗程。同时根据基础疾病给予降血压、降血糖及调血脂治疗。
1.3 资料收集
收集所有入组患者的基线资料,包括姓名、性别、年龄、既往有无高血压病、糖尿病、冠心病、高脂血症、吸烟史(戒烟小于5 年)、饮酒史(戒酒小于5 年)、既往有无缺血性脑卒中病史及患者住院期间合并用药等。记录患者在住院后次日清晨空腹采集的静脉血各项检验指标,包括血常规、肝肾功能、凝血功能等。
1.4 TEG 及相关参数测定
患者在服用阿司匹林联合氯吡格雷药物7~14 d,空腹采集静脉血,分别注射入柠檬酸钠抗凝管1 和肝素抗凝管2 中。利用TEG-5000 型TEG 凝血分析仪(美国Haemoscope 公司)检测柠檬酸-高岭土样品,得出ADP 抑制率。将血小板聚集抑制率>30%定义为氯吡格雷非抵抗,血小板聚集抑制率≤30%定义为氯吡格雷抵抗[15]。
1.5 CYP2C19 基因检测
患者入院后次日清晨空腹抽取静脉血4 ml 于EDTA 抗凝管中,利用全自动杂交仪系统(BR-526-24,上海百傲科技公司)对CYP2C19*1、CYP2C19*2及CYP2C19*3 位点进行检测。该检测过程主要包括全血DNA 的提取、PCR 扩增、芯片杂交显色,利用基因芯片识读仪自动读取结果。根据CYP2C19基因多态性进行药物代谢分组[16],即:快代谢组:EM,CYP2C19*1*1,中代谢组:IM,CYP2C19*1*2、CYP2C19*1*3, 慢 代 谢 组: PM,CYP2C19*2*2、CYP2C19*2*3、CYP2C19*3*3。
1.6 统计学方法
采用SPSS 26.0 统计软件进行数据分析,计量资料服从正态分布,采用(±s)表示,组间比较采用独立样本t检验。若计量资料属于非正态分布,则以中位数和四分位数[M(P25,P75)]表示,组间比较采用Mann-WhitneyU检验。计数资料以例数和百分比[例(%)]表示,组间比较采用χ2检验,将IS 患者发生氯吡格雷抵抗的影响因素进一步进行多因素Logisti 回归分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 基线资料分析
本研究共纳入缺血性脑卒中患者202 例,年龄35~86 岁,其中,CR 组87 例,NCR 组115 例,CR组患者合并糖尿病的比例明显高于NCR 组,差异有统计学意义(P<0.05)。在性别、年龄、吸烟、饮酒、既往有无缺血性脑卒中、高血压病、冠心病、高脂血症及合并用药方面,两组间差异均无统计学意义(P>0.05),见表1。

表1 抵抗组和非抵抗组患者基线资料比较
2.2 实验室检验指标分析
氯吡格雷抵抗组血常规的白细胞计数水平高于非抵抗组,且组间差异有统计学意义(P<0.05)。两组患者红细胞、血红蛋白、血小板计数、凝血酶原时间、D-二聚体、血糖、总胆固醇、甘油三酯、高密度脂蛋白胆固醇、低密度脂蛋白、超敏C 反应蛋白、血同型半胱氨酸、直接胆红素、总胆红素、谷草转氨酶、谷丙转氨酶的组间差异均无统计学意义(P>0.05),见表2。
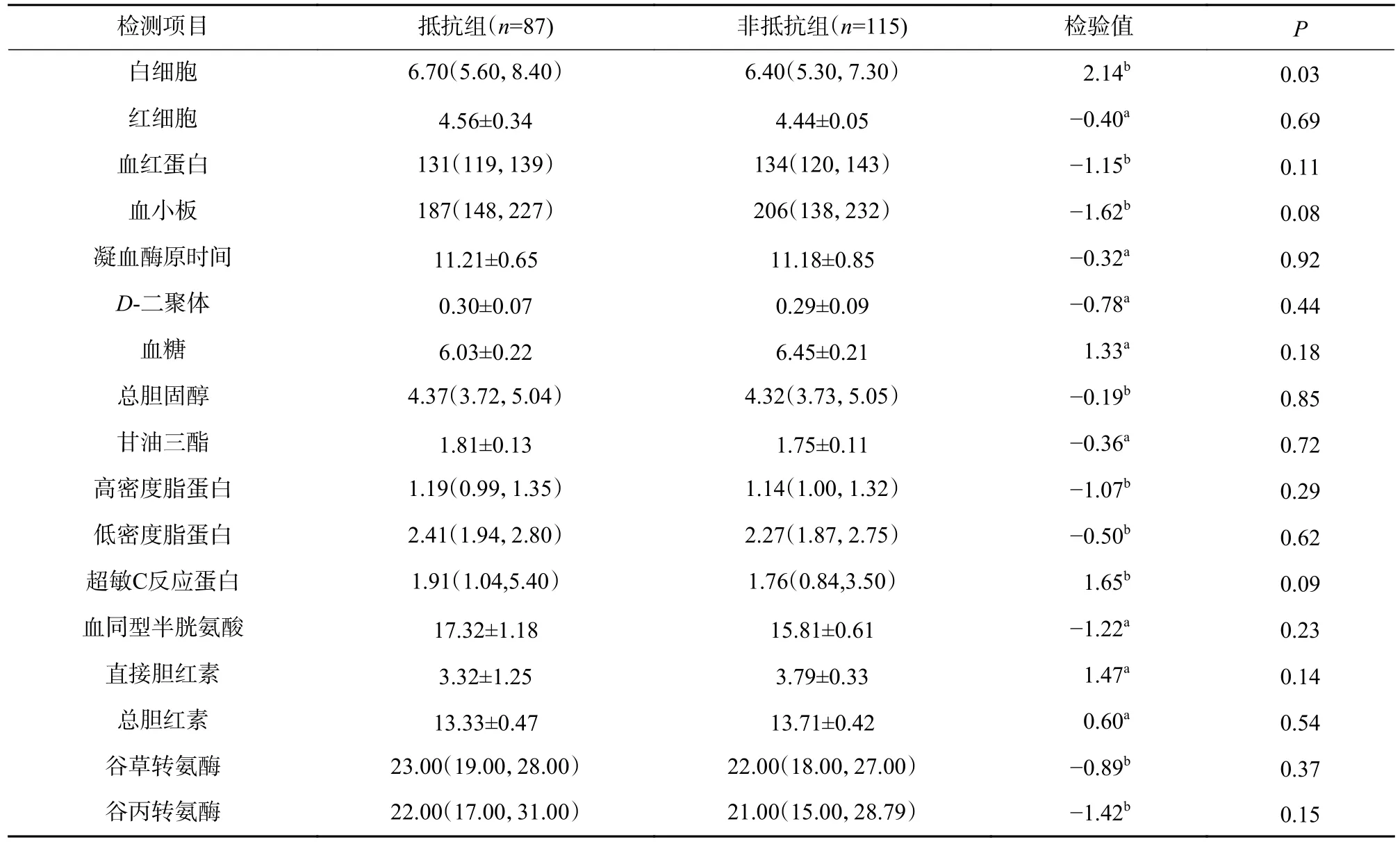
表2 两组患者实验室检测指标比较
2.3 CYP2C19 基因多态性分布
入选的202 名患者中,CYP2C19 *1、CYP2C19 *2及CYP2C19*3 等位基因的频率分别为62.26%、33.17%及4.21%,所有基因位点均符合Hardy-Weinberg 平衡定律,差异无统计学意义(P>0.05),表明该群体具有代表性,详见表3。

表3 202 例IS 患者 CYP2C19 基因型及等位基因的频率分布
2.4 不同CYP2C19 代谢类型患者发生氯吡格雷抵抗的比较
CYP2C19 IM 组患者发生氯吡格雷抵抗的比例显著高于EM 组和PM 组,差异具有统计学意义(P>0.05),见表4。
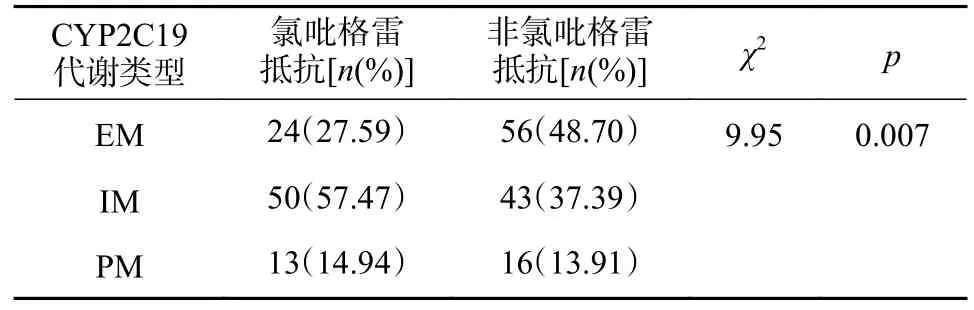
表4 不同CYP2C19 代谢类型的CR 发生率比较(n,%)
2.5 CYP2C19 不同基因型血小板抑制率的比较
3 组IS 患者中ADP 抑制率均不符合正态分布,因此采用非参数检验。EM 组ADP 抑制率的中位数为39.6%,IM 组为26.10%,PM 组为31.95%。3 组血小板抑制率中位数差异具有统计学意义(P<0.05);两两比较,IM 组的血小板抑制率明显低于EM 组,差异具有统计学意义(P<0.05);其他组间差异无统计学意义(P>0.05),详见表5。
2.6 发生氯吡格雷抵抗的危险因素分析
以发生CR 作为因变量,将上述研究中存在统计学差异(P<0.05)的项目作为自变量进行赋值,包括合并糖尿病(未合并糖尿病者赋值0,合并糖尿病者赋值1)、CYP2C19 代谢类型(IM 赋值1,其余赋值0),白细胞计数为连续型数值变量,纳入二元Logistic 回归模型中进行分析。结果显示,合并糖尿病、高白细胞计数水平、CYP2C19 中代谢型为发生氯吡格雷抵抗的独立危险因素,见表6。

表6 发生氯吡格雷抵抗危险因素的Logistic 回归分析结果
3 讨论
氯吡格雷是继阿司匹林后在心脑血管中被广泛使用的抗血小板药物。有报道表明氯吡格雷联合阿司匹林在治疗缺血性脑卒中疗效优于单独使用阿司匹林,且不会增加脑卒中患者发生出血的风险[3,17]。在临床应用中仍有一些患者在服用氯吡格雷后,不能够抑制ADP 诱导的血小板凝聚,也称为氯吡格雷抵抗或者氯吡格雷低反应性[4]。目前国际上关于氯吡格雷抵抗的诊断并无确切的标准[18],有文献称化学比浊法属于比较经典的血小板功能检测方法,但是由于在操作过程中步骤比较繁多且尚无统一的标准化流程,现已逐渐被其它检测方法所取代[19]。有国外研究报道将床旁快速血小板分析(Verify Now)检测系统的检测结果定义为“金标准”,但是由于该检测方法成本较高,因此在国内临床中并没有被大规模应用。而现在国内较常使用的抗血小板效果的监测方法有TEG、血小板分析仪、PL-11 等,TEG 检测血小板功能操作便捷、迅速、受外界影响较小等优点,现已在临床中被广泛使用[20]。
氯吡格雷本身属于无活性的前体药物,需在多种酶的参与下生成有活性的化合物,才能发挥抑制血小板聚集作用。细胞色素P450 酶参与了两步氧化代谢过程。国外有研究报道[21]CYP2C19*2、CYP2C19*3 等位基因的突变主要以亚洲人为主,发生在非洲和欧洲的突变率较低,携带CYP2C19*2、CYP2C19*3 基因的突变可降低细胞色素P450 酶的活性,使得活性代谢物的水平减少,从而导致该药物的临床疗效不佳,所以IM 和PM 组氯吡格雷抗血小板活性会受到CYP2C19 基因多态性的影响。本研究结果显示,CYP2C19 IM 组患者发生氯吡格雷抵抗的比例显著高于EM 组和PM 组,血小板抑制率明显低于EM 组,差异均具有统计学意义,而PM 组血小板抑制率虽然低于EM 组,但差异无统计学意义,可能是PM 组(14.36%)人群占比显著低于IM 组(46.04%)和EM 组(39.60%)造成的。
目前已有研究表明糖尿病患者在服用氯吡格雷后血小板抑制率较差[22-23],但其机制尚不明确。在小鼠模型中的研究结果表明,高血糖可以通过下调CYP 酶影响氯吡格雷药物活化,从而导致抗血小板浓度降低[24]。Angiolillo 等[25]针对冠心病合并2 型糖尿病患者诱导的血小板抑制率减弱的研究中,解释其原因可能是长期的高血糖水平使血小板信号通路上调降低了抗血小板药物的药效,从而导致药物抵抗的发生。此外,糖尿病会影响肝脏代谢与胃肠道吸收,这可能会影响药物的吸收和代谢[26]。本研究结果也显示,合并糖尿病是发生氯吡格雷抵抗的独立风险因素。
本研究结果还表明高白细胞计数可能是IS 患者发生CR 的独立危险因素(OR=1.235,95%CI:1.065,1.432),但目前在IS 患者中有关白细胞计数与CR 之间关系的研究较少。有研究发现炎症标志物升高增加心血管事件的风险,血小板聚集和炎性因子之间的相互作用在急性冠脉综合征中起着非常重要的作用,而炎症调节越来越被认为是当代的治疗靶点,接受氯吡格雷联合阿司匹林双重抗血小板治疗的急性冠状动脉综合征的患者中,白细胞计数与临床疗效密切相关[27]。也有研究者在冠心病患者中发现白细胞中的3 个长链非编码RNA 与CR的发生有关[28]。IS 随着细胞死亡和脑组织受损,分子危险信号通过激活更多的小胶质细胞和浸润白细胞进行前馈反应,释放更多的具有促炎作用的细胞因子。炎症加剧了脑细胞受损程度,使外周血中释放更多的细胞因子,这些细胞因子参与了脑卒中的进展,影响其预后[29-30]。因此,在临床中,高白细胞计数患者服用氯吡格雷时应警惕CR 的发生。
本研究的局限性主要包括以下几点:①样本量相对较少;②TEG 检测过程中受血凝速度、红细胞聚集状态等因素影响;③患者服药7~14 d 只检测1 次ADP 抑制率,不能反应整体水平;④未直接检测血浆氯吡格雷及其活性代谢物水平。上述因素可能对研究结果产生偏倚,今后还需要进一步的验证。
