皮肤黑色素瘤差异表达基因的生物信息学分析及调控中药预测
2024-01-25王梓霞黄羽欣谢锦楠王沐瑶王文辉
王梓霞,黄羽欣,谢锦楠,王沐瑶,王文辉
1.广州中医药大学第二临床医学院,广东 广州 510006
2.广州中医药大学第一临床医学院,广东 广州 510499
3.广州中医药大学东莞医院,广东 东莞 523000
皮肤黑色素瘤(cutaneous melanoma)是一种高度恶性的皮肤肿瘤。2020 年,全球约共有325 000例新增黑色素瘤病例和57 000 例黑色素瘤死亡病例,占新增肿瘤发病率的1.7%和肿瘤死亡病例的0.7%[1-2]。皮肤黑色素瘤的诊断通常由皮肤科医生在临床检查中发现,辅助以皮肤镜检查,确诊比例可达到90%,但仍有10%的皮肤黑色素瘤需要进一步分子分型确诊[3]。皮肤黑色素瘤的临床治疗包括手术切除、放化疗、靶向治疗和免疫疗法等。然而,这些治疗方法大多都具有不同程度的毒副作用,加之肿瘤组织的原发、继发耐药等,在一定程度上限制了其临床应用[4]。因此,探索新的皮肤黑色素瘤治疗手段,对提高患者的生存率,改善患者的生存质量具有重要意义[5-6]。
在中医研究领域内,皮肤黑色素瘤常归属于“恶疮”“黑痣”“黑疔”“失荣”等范畴,如《外科正宗》中记载“黑子,痣名也。此肾中浊气混滞于阳,阳气收束,结成黑子,坚而不散。”长期以来,中医药在与化疗药物的联合应用防治肿瘤中表现出较大的临床价值,其不良反应轻微且耐药性低[7]。目前研究表明,中药及其活性成分在促进黑色素瘤细胞凋亡、调控黑色素瘤细胞周期、抑制黑色素瘤的血管生成及对受体酪氨酸激酶(receptor tyrosine kinase,RTK)传导通路的调节均起到积极作用[8]。因此,本研究拟利用生物信息学角度分析皮肤黑色素瘤的相关生物标志物,以期为皮肤黑色素瘤的干预治疗提供潜在靶点,并为中药治疗皮肤黑色素瘤提供相应理论依据。
1 资料与方法
1.1 皮肤黑色素瘤数据获取
从GEO 数据库下载编号分别为GSE3189、GSE114445、GSE46517 的3 个基因表达微阵列数据集。GSE3189 采用美国昂飞公司人基因组U133A Array 表达芯片GPL96 平台,包括7 例正常组织,18 例正常痣组织和45 例恶性皮肤黑色素瘤组织样本。GSE114445 采用美国昂飞公司人基因组U133 Plus 2.0 Array 表达芯片GPL570 平台,包括5 例普通黑素细胞痣组织、7 例发育不良痣组织和16 例原发性皮肤黑色素瘤组织样本。GSE46517 采用美国昂飞公司人基因组U133A Array 表达芯片GPL96 平台,包括31 例原发性皮肤黑色素瘤组织、73 例转移性皮肤黑色素瘤组织、9 例正常痣组织、7 例正常皮肤组织和1 例正常黑素细胞上皮组织样本。
1.2 差异表达基因(differentially expressed genes,DEGs)的筛选
通过GEO2R 在线工具(www.ncbi.nlm.nih.gov/geo/geo2r/)分别对3 个皮肤黑色素瘤相关的GEO数据集进行皮肤黑色素瘤癌症组和正常对照组分类,下载分类数据集后删除没有相应基因符号的探针集。最后通过本地Excel 软件,对皮肤黑色素瘤样本和非癌样本进行DEGs 的筛选。DEGs 的纳入标准为Padj<0.01,|log2FC|>1[FC 表示差异倍数(fold change)],使用Venny2.1 在线工具绘制最终纳入DEGs 的韦恩图。
1.3 基因本体论(gene ontology,GO)富集分析和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析
将DEGs 导入DAVID 数据库分别进行KEGG通路和GO 功能富集分析,其中P<0.05 被认为具有统计学意义。
1.4 构建蛋白互作(protein-protein interaction,PPI)网络
将DEGs 导入String 数据库以构建PPI 网络,同时分析DEGs 对应蛋白之间的相互作用,设置标准为Settings>0.7。将蛋白互作文件导入Cytoscape 3.9.0 软件,进行PPI 网络的优化。
1.5 关键基因选择与分析
通过CytoHubba 插件筛选度(degree)值位于前15 的基因为关键基因。分别通过GSCA 数据库和基因表达谱交互分析网站(Gene Expression Profiling Interactive Analysis,GEPIA,Gepia 2.0),对关键基因进行突变分析与总体生存率分析。
1.6 核心基因(集)的选择与分析
从关键基因在皮肤黑色素瘤相关的癌症基因组图谱数据集(Cancer Genome Atlas,TCGA)的生存分析结果中,选取对皮肤黑色素瘤患者总体生存率存在显著影响的基因,结合GEO 数据集选取其中上调基因,筛选出多个核心基因并构建核心基因集。使用GSCA 数据库对核心基因集进行基因集变异分析(GSVA 分析),通过GSVA 评分探究基因集在皮肤黑色素瘤中免疫浸润的特点和泛癌分析中的表达程度。使用TIMER 2.0 数据库分别对核心基因进行免疫浸润分析。
1.7 中药预测分析
应用Coremine Medical 数据库,将关键基因与具有潜在治疗作用的中药进行映射,选取其中P<0.05 的中药予以汇总分析。
2 结果
2.1 DEGs 的获取
从GSE3189、GSE114445、GSE46517 芯片中分别获得2 802、521、814 个DEGs,3 个数据集的共同DEGs 共114 个,如图1 所示,其中包括36 个上调基因和78 个下调基因。

图1 差异表达基因Venn 图Fig.1 Venn map of differentially expressed genes
2.2 DEGs 的GO 功能和KEGG 通路分析
运用DAVID 数据库对DEGs 进行GO 和KEGG 富集分析,得出28 个GO 分析条目和7 个KEGG 分析条目,如图2。GO 功能富集分析表明,在生物过程(biological process,BP)中主要富集在跨膜受体蛋白酪氨酸激酶信号通路、细胞黏附、RNA 聚合酶II 启动子转录的正调控、多细胞生物发育等方面;在细胞组成(cellular component,CC)中富集在基底外侧质膜、双细胞紧密连接、细胞表面、细胞基膜、质膜、细胞外区域等部位;在分子功能(molecular function,MF)中富集在整合素结合、蛋白酪氨酸激酶活性、跨膜受体蛋白酪氨酸激酶活性等方面。KEGG 通路富集分析显示,上调基因主要富集在病毒蛋白与细胞因子和细胞因子受体的相互作用、细胞因子-细胞因子受体相互作用、Toll 样受体信号通路等方面,而下调基因未显示富集途径。
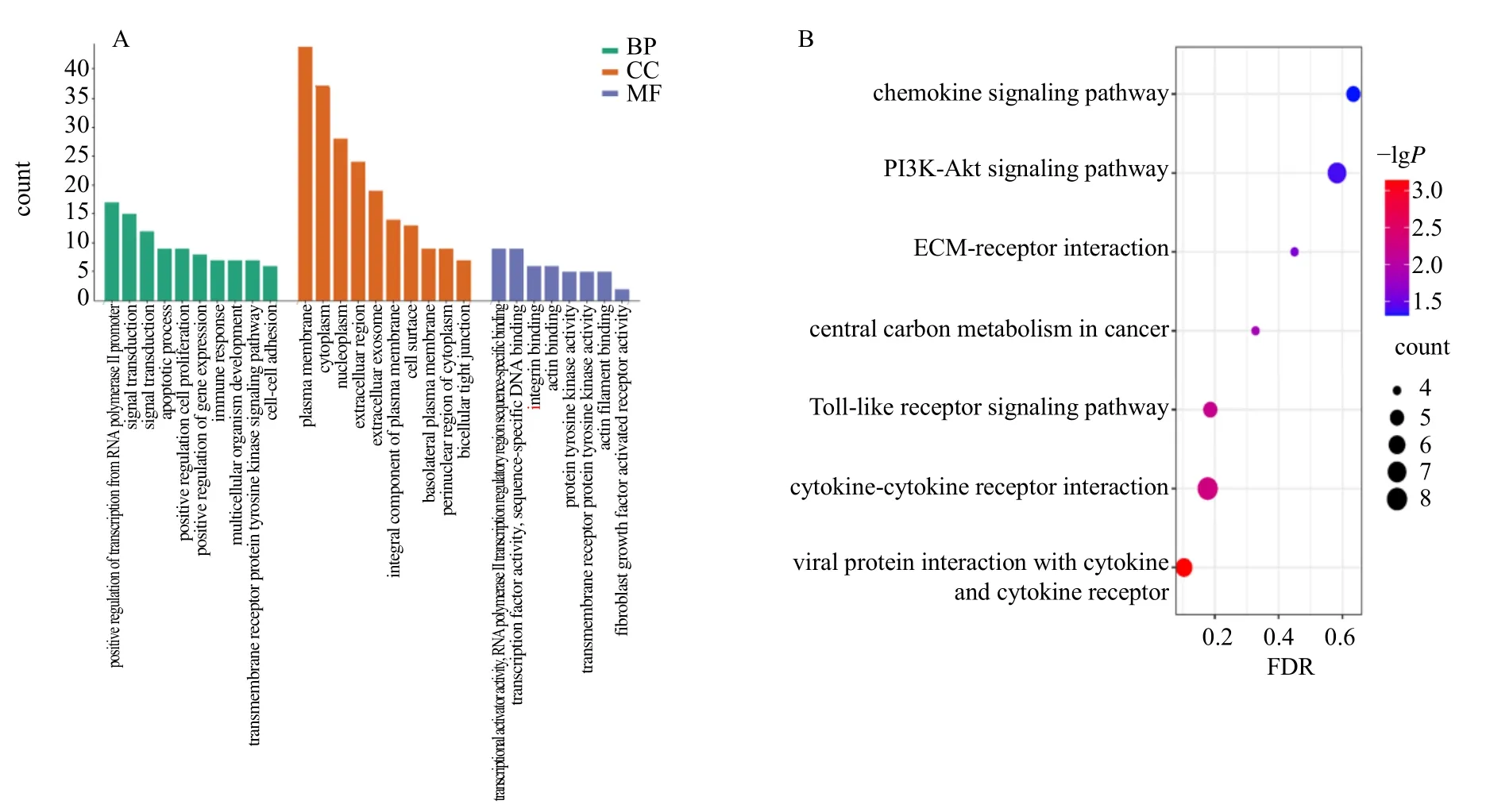
图2 差异表达基因的GO 功能 (A) 和KEGG 通路 (B) 富集分析结果Fig.2 Enrichment analysis results of GO function (A) and KEGG pathway (B) of differentially expressed genes
2.3 PPI 网络的构建
应用Cytoscape 3.9.0 软件对DEGs 进行分析,构建PPI 网络,其中浅绿色代表上调基因,浅红色代表下调基因,见图3。

图3 差异表达基因的PPI 网络Fig.3 PPI network of differentially expressed genes
2.4 关键基因的筛选和突变分析
将度值位于前15 的基因筛选为关键基因,分别为EGFR、KPNA2、GATA3、AURKA、TYMS、PKP1、SPP1、MMP1、KLF4、EPCAM、KIF23、DTL、CLDN1、LCP2、FGFR2。关键基因的基因全名和功能注释见表1。

表1 关键基因名称和功能作用 (度值前15)Table 1 Names and functional roles of key genes (top 15 degrees)
利用GSCA 数据库对关键基因进行突变分析,具体突变情况如图4、5 所示。结果显示,FGFR2、EGFR和MMP1分别为突变率最高的前3 位基因,并均以有害突变为主,其中错义突变为主要的突变型形式。此外,15 个关键基因中在皮肤黑色素瘤样本集中,突变形式以转换(transitions,Ti)为主,并以胞嘧啶(C)转换为胸腺嘧啶(T)的情况最多。

图4 排名前10 的突变基因瀑布图Fig.4 Waterfall diagram of top 10 mutated genes

图5 关键基因集的突变情况分布Fig.5 Distribution of mutations in key gene sets
2.5 皮肤黑色素瘤临床生存分析
通过Gepia 2.0 网站,对其收录的481 例来自TCGA 的皮肤黑色素瘤患者数据与关键基因进行总体生存率分析,并以Kaplan-Meier 曲线展现,如图6 所示。结果显示,共有4 个基因(KPNA2、GATA3、AURKA、DTL)的差异表达对患者的生存预后存在显著影响。其中KPNA2、AURKA、DTL为皮肤黑色素瘤的风险因子(风险比>1),其高表达的皮肤黑色素瘤患者总体生存率较低;GATA3为皮肤黑色素瘤的保护因子(风险比<1),其低表达的皮肤黑色素瘤患者总体生存率与正常人群相比较低。以上结果均具有统计学意义(P<0.05)。

图6 关键基因的生存分析曲线Fig.6 Survival analysis curve of key genes
2.6 核心基因(集)的筛选和分析
结合关键基因在皮肤黑色素瘤相关的TCGA数据集的生存分析结果,选取对皮肤黑色素瘤患者总体生存率存在显著影响的基因,并结合GEO 数据集中表达水平上调的基因,筛选出3 个核心基因KPNA2、AURKA、DTL并构建核心基因集。利用GSCA 数据库和TIMER 2.0 数据库,进行基因集变异分析(GSVA 分析),以探究核心基因(集)在皮肤黑色素瘤中免疫浸润的特点和泛癌分析中的表达程度。
2.6.1 核心基因集的泛癌分析 应用GSCA 数据库对核心基因集进行泛癌分析,并以GSVA 评分代表核心基因集的表达程度。该数据库共有14 种可供分析的癌症表型,包括膀胱尿路上皮癌、结肠腺癌、食管癌、头颈部鳞状细胞癌、肝细胞癌、肺腺癌、胃腺癌、甲状腺癌、乳腺癌浸润癌、肾嫌色细胞癌、肾透明细胞癌、肾乳头状细胞癌、前列腺癌。结果显示,与正常组织相比,核心基因集的表达均在癌症组织显著上调(P<0.01),如图7 所示。表明选取的核心基因集在人体多种癌症的发生进展中,均表现出基因的显著高表达,或为后续从基因层面对癌症发生机制共性的探讨提供一定的借鉴意义。

图7 核心基因集的泛癌表达分析Fig.7 Expression analysis of core gene set in pan-cancer
2.6.2 核心基因集的免疫浸润分析 通过GSCA 数据库以热图形式呈现皮肤黑色素瘤中免疫细胞浸润与基因集GSVA 富集评分之间的联系,并通过Spearman 相关性分析计算核心基因集与免疫细胞浸润二者之间的相关性,如图8 所示。结果显示,在皮肤黑色素瘤组织中,核心基因集的表达与CD4+T 细胞、初始CD4+T 细胞(CD4 naive)、CD8+T细胞、Th17 细胞、Th2 细胞、黏膜相关恒定T 细胞(mucosal-associated invariant T cells,MAIT)、滤泡辅助性T 细胞(follicular helper T cell,Tfh)的浸润呈显著负相关,与自然调节性T 细胞(natural regulatory T cells,nTreg)、中性粒细胞(neutrophil)、树突状细胞(dentric cell,DC)、单核细胞(monocyte)呈显著正相关。
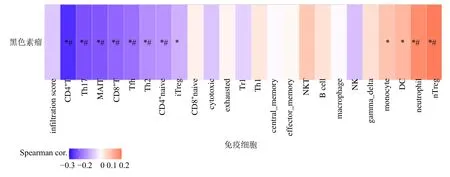
图8 核心基因在皮肤黑色素瘤中的免疫浸润表达Fig.8 Immunoinvasive expression of core genes in cutaneous melanoma
2.6.3 核心基因的免疫浸润分析 应用TIMER 2.0数据库,选择免疫浸润细胞为B 细胞、CD4+T 细胞、CD8+T 细胞、巨噬细胞、中性粒细胞、树突状细胞6 种,分别对3 个核心基因KPNA2、AURKA、DTL进行分析,如图9 所示。由P值可知,3 种核心基因与所选免疫细胞浸润均显著相关。Spearman 相关系数结果显示,KPNA2、AURKA均分别与CD8+T细胞和树突状细胞呈正相关,DTL则与CD4+T 细胞、中性粒细胞呈正相关。
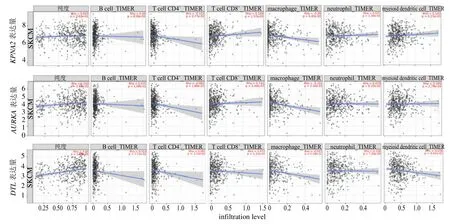
图9 3 种核心基因与皮肤黑色素瘤肿瘤纯度及6 种免疫细胞的浸润分析Fig.9 Tumor purity of three core genes in cutaneous melanoma and infiltration analysis of three core genes in six immune cells
2.7 潜在调控中药预测分析
应用Coremine Medical 数据库,将3 个核心基因与具有潜在治疗作用的中药进行映射,选取其中具有统计学意义(P<0.05)的药物进行分析,可以得到对核心基因具有潜在治疗作用的一系列中药,如油桐叶、猪苓、云芝、构皮、高良姜、甘草、丹参、人参等,如表2 所示。

表2 基于核心基因的中药预测Table 2 Traditional Chinese medicines prediction based on core genes
3 讨论
3.1 免疫相关的肿瘤微环境(tumor microenvironment,TME)与皮肤黑色素瘤密切相关
对于皮肤黑色素瘤免疫机制的研究涉及TME、抗原呈递和检测、淋巴细胞和免疫细胞亚群、免疫检查点等多个方面[9]。皮肤黑色素瘤的发生与TME密切相关,TME 包括肿瘤细胞、免疫细胞、血管和基质成分等,它们的相互作用对于肿瘤的发展起着至关重要的作用[10]。研究表明,黑色素瘤细胞可通过分泌细胞因子和化学物质来抑制免疫细胞的功能,从而促进免疫逃逸[11]。此外,免疫细胞的浸润程度和类型也会影响皮肤黑色素瘤的发生和发展。在皮肤黑色素瘤中,肿瘤浸润淋巴细胞数量较少,且其免疫耐受性较强,说明TME 抑制免疫反应的能力是导致皮肤黑色素瘤逃逸的重要因素[12]。皮肤黑色素瘤的发生还与人类白细胞抗原系统(human leukocyte antigen,HLA)和肿瘤抗原有关,HLA 与T 细胞受体结合后可引发T 细胞免疫反应,从而杀伤肿瘤细胞[13]。同时,在皮肤黑色素瘤中T 细胞和B 细胞都受到不同程度的影响[14]。T 细胞在体内的主要作用是杀伤肿瘤细胞,然而,在皮肤黑色素瘤中肿瘤抑制T 细胞的功能是导致其免疫逃逸的主要机制之一。但是B 细胞在皮肤黑色素瘤中的作用尚不清楚,其在肿瘤免疫治疗中的作用亦有待进一步研究和探讨,本研究对于B 细胞免疫浸润趋势分析结果也无明显特异性改变。此外,免疫细胞亚群的存在也会影响皮肤黑色素瘤的发生和发展。在皮肤黑色素瘤患者中,调节性T 细胞(regulatory cells,Tregs)数量增加,自然杀伤(natural killer,NK)细胞活性降低,这些因素都可能导致免疫逃逸,且与本研究分析的结果相符,即Treg 细胞免疫浸润趋势与疾病呈正相关[15]。
3.2 细胞周期异常和细胞侵袭是皮肤黑色素瘤的潜在机制
皮肤黑色素瘤的形成主要包括黑素细胞的增殖、细胞周期和凋亡失控、细胞浸润和侵袭、血管生成、免疫逃逸等生物过程。正常情况下,黑素细胞仅会在皮肤、眼睛等部位分散分布,而遗传基因突变、线粒体损伤等会导致黑素细胞的恶性增殖,进而形成黑色素瘤。另外,黑色素瘤细胞的细胞周期和凋亡过程受到了调节失控的影响:多数黑色素瘤患者的细胞周期调控基因存在突变,这种突变会使得细胞周期G1/S 检查点失调,从而促进黑色素瘤细胞的增殖和生长;黑色素瘤细胞中许多细胞周期调节蛋白cyclin-dependent kinase(CDK)抑制剂p16INK4a的基因缺失或基因突变会导致细胞周期蛋白D1-周期蛋白依赖性激酶4/6 复合物活性上调,促进细胞进入DNA 复制和细胞分裂期[16];黑色素瘤细胞的凋亡受到抑制,导致细胞周期过程不被中断,进而导致细胞过度增殖和扩散。黑色素瘤细胞还可以穿透正常组织,进入血管和淋巴系统,并在其他部位进行扩散形成转移灶,这一过程与黑色素瘤细胞表面的特定黏附分子和基质金属蛋白酶等相关因素有密切关系[17]。此外,黑色素瘤细胞能够通过表面分子的改变、免疫细胞浸润抑制等,逃避身体免疫系统的攻击,并促进皮肤黑色素瘤的生长和扩散。
本研究通过分析3 个数据集得出114 个皮肤黑色素瘤组织与正常组织的DEGs,其中包括上调基因36 个、下调基因78 个。GO 功能和KEGG 通路富集分析显示,皮肤黑色素瘤的发生发展与信号转导、凋亡过程、基因表达的正调控、细胞因子与细胞因子受体相互作用、Toll 样受体信号通路等密切相关。在信号转导方面,Malekan 等研究表明,缺氧诱导因子-1α(hypoxia-inducible factor 1-alpha,HIF-1α)能够通过RAS/RAF/MEK/ERK 信号级联通路、磷脂酰肌醇-3- 羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和核因子-κB(nuclear factorκB,NF-κB)等常见通路影响皮肤黑色素瘤进程中细胞增殖、转移、血管生成和有关代谢[18-19]。其中,作为皮肤黑色素瘤发病机制的核心,RAS/RAF/MEK/ERK 信号通路通常由致癌突变(如B-RAF、N-RAS)和上游膜受体突变(例如KIT)激活[20]。其中,部分致癌突变会激活PI3K/Akt/mTOR 通路,从而通过一系列信号转导使得Akt 磷酸化和活性增加,导致细胞凋亡减少和增殖信号增加,促进肿瘤的生成[21]。在细胞因子方面,研究表明细胞因子可以通过抑制增殖和促进凋亡2 个方面来直接抑制肿瘤细胞的生长。在临床前癌症模型中,粒细胞巨噬细胞集落刺激因子已被证明可以介导有效的抗肿瘤免疫[22]。此外,细胞因子通过信号通路可对皮肤黑色素瘤中的细胞浸润侵袭起到促进作用。Rathore 等[23]研究表明,肿瘤来源的正五聚蛋白3(pentraxin 3,PTX3)通过可靶向的炎症相关途径促进黑色素瘤细胞侵袭,并通过Toll 样受体4(Tolllike receptor 4,TLR4)/NF-κB 信号通路促进黑色素瘤细胞迁移。总体而言,以上研究结果均与本研究的分析结果一致。
3.3 核心基因可能成为皮肤黑色素瘤潜在治疗靶点
本研究共筛选得到15个关键基因,包括EGFR、KPNA2、GATA3、AURKA、TYMS、PKP1、SPP1、MMP1、KLF4、EPCAM、KIF23、DTL、CLDN1、LCP2、FGFR2,其中KIF23、KPNA2、DTL、TYMS、MMP1、AURKA、LCP2、SPP1表达上调,EGFR、GATA3、EPCAM、CLDN1、KLF4、FGFR2、PKP1表达下调。此外,继续优化关键基因筛选,得到3个核心基因KPNA2、AURKA、DTL并构建核心基因集。KPNA2是在核质运输中发挥重要作用的蛋白,在介导肿瘤抑制因子的核转运方面,可通过影响细胞分化、增殖和凋亡促进肿瘤形成和进展。已有研究表明,KPNA2在黑色素瘤组织和细胞系中呈高表达状态,其过表达可以通过NF-κB-p65 信号通路促进皮肤黑色素瘤细胞增殖、迁移和侵袭,对预后有显著不良影响[24-25]。AURKA作为AURK 家族的代表性成员,对有丝分裂过程以及维持基因组完整性具有重要作用。其在肿瘤细胞中作为转录因子可促进细胞迁移与入侵,并定位于线粒体调节线粒体动态和三磷酸腺苷生产[26-27]。另有研究表明,AURKA下调可促进皮肤黑色素瘤胞凋亡并诱导细胞周期阻滞[28]。而DTL可以通过调节参与细胞周期的调节蛋白的表达,影响DNA 复制和修复的完整性[29]。有研究表明,DTL连同细胞因子受体4(Cullin-RING ligase 4,CRL4)形成CLR4Cdt2连接酶,抑制其活性可以阻滞黑色素瘤在体内外生长增殖[30]。此外,有数据显示DTL高表达的皮肤黑色素瘤患者,其无病生存期和总生存期均较短[29]。
此外,FGFR2基因的突变对皮肤黑色素瘤的产生和进展也存在相关影响。正常生理状态下,由FGFR介导的信号传导通路参与新血管生成、细胞增殖和迁移、调节器官发育、伤口愈合等过程。然而,当FGFR发生突变或者过表达时,会引起FGFR 信号通路的过度激活,并进一步诱发正常细胞癌变[31]。FGFR常见的变异情况有以下5 种[32-33]:(1)由于基因扩增导致FGFR过表达;(2)EC 区域(胞外结构域)的FGFR突变(SNV与indel);(3)TK 区域(激酶结构域)的FGFR突变(SNV 与indel);(4)FGFR融合I 型:FGFRs的TK 区域前与另一个基因5’端发生基因融合;(5)FGFR 融合II 型:FGFRs的TK 区域后与另一个基因的3’端发生基因融合。有研究显示,功能丧失的FGFR2突变发生在黑色素瘤的1 个亚群中,突变谱显示其70%的突变方式为转换,与本研究结果相符合。其中 A648T 突变消除了FGFR2的酪氨酸激酶活性,但黑色素瘤中FGFR2功能丧失的生物学后果仍未有研究发现[30]。
3.4 相关中药可能是皮肤黑色素瘤治疗的潜在药物
本研究筛选出作用于皮肤黑色素瘤关键基因的中药可分为以下9 类:补虚药(人参、甘草)、清热解毒药(油桐叶)、拔毒生肌药(木薯)、消肿拔毒药(蓖麻子)、温里药(高良姜)、健脾利湿药(蚕豆、云芝)、利水渗湿药(猪苓、构皮)、活血化瘀药(丹参)、安神药(灵芝)。
皮肤黑色素瘤在中医范畴虽无明确病名对应,但根据发病特点可归属“黑痣”“黑疔”“恶疮”“失荣”等,亦与“脱痈”“厉痈”“翻花”等发病形式极为类似[34]。其形成机制多以正气虚损为基础,进而阳气束结,或外邪搏于血气,致气血瘀滞形成乌黑肿块。此外,血癖气滞、湿毒淤滞、外感六淫等病因皆可变生恶疮导致本病。上述补虚药中,人参性平、味甘,属微苦微温之品,既能大补元气,又能益血生津、安神定魄,为补药之良品,虚证之要药。《圣济总录》所载“人参丸”,以人参1 分为末入药,主治小儿疮子黑色。甘草味甘性平、气薄味厚,既能补脾胃之不足,益三焦之元气,又能调和诸药。“人参-甘草”作为经方常见药对,相须为用,共同补益脾肺之气,使气血津液得生,虚损诸证自解。故而上述补虚药的使用及配伍,辅以补气安神之灵芝,可针对皮肤黑色素瘤起病的前提基础“虚损内生”起到对证治疗作用。此外,高良姜作为辛热之品,有温中止呕、散寒止痛之功,可针对寒湿停聚型皮肤黑色素瘤患者起温化水湿之效;丹参活血止痛、祛瘀生新,可有效缓解皮肤黑色素瘤中由于气血瘀滞所致的乌黑肿块;猪苓、构皮、蚕豆、云芝均有祛湿之功,可用于湿毒瘀滞型皮肤黑色素瘤。
中药外治法亦在一定程度上有助于皮肤黑色素瘤的治疗,如蓖麻子善祛风活络、消肿拔毒,《本草经疏》载其可“追脓取毒,能出有形之滞物”,外用能“退消阳毒红肿,及发颐、瘰疬、乳痈等症”。《慈禧光绪医方选议》曾载有蓖麻子膏一方,以蓖麻子1 两“摊布光上,贴面跳动处,或掺于大肥皂内贴之”,可治手臂风疾及痈疽肿毒。对于血瘀日久化热,致使皮肤红肿焮痛的皮肤黑色素瘤患者或有一定疗效。此外,油桐叶清热解毒、杀虫消肿,木薯消肿解毒,均可捣烂或绞汁敷抹于患处,用以缓解痈疽疮疡、瘀肿疼痛等皮肤病症,对于患处破溃、出血的皮肤黑色素瘤病灶或有一定疗效。
目前多项研究[35-36]表明人参活性成分对皮肤黑色素瘤细胞有诱导凋亡、抑制转移的作用,人参皂苷Rh2可以诱导人皮肤黑色素瘤细胞A375-S2 凋亡,人参皂苷Rg3可明显抑制B16 皮肤黑色素瘤肺转移等。此外,丹参提取液可能通过抑制皮肤黑色素瘤细胞对基底膜的侵袭能力以及降低其运动能力显著减轻皮肤黑色素瘤肺转移程度[37]。丹参的主要成分丹参酮I、丹参酮IIA和隐丹参酮可以抑制皮肤黑色素瘤细胞的增殖活性,促进其凋亡[38]。同时,丹参-人参可协同抑制髓源抑制性细胞(myeloidderived suppressor cells,MDSCs)在转移灶中的浸润,从而重塑转移灶局部免疫抑制的微环境,达到抑制肿瘤转移的目的[39]。另有研究表明,高良姜素可以抑制人皮肤黑色素瘤A375细胞的生长和转移,同时降低A375 细胞内酪氨酸酶的活性[40]。猪苓多糖可以通过促进巨噬细胞释放NO 抑制皮肤黑色素瘤细胞生长[41]。灵芝多糖可促进黑素瘤和骨肉瘤抗原诱导巨噬细胞CD86 和主要组织相容性复合体II类(major histocompatibility complex-II,MHC-II)(IA/I-E)表达,促进巨噬细胞对肿瘤抗原的提呈作用[42]。云芝多糖可诱导细胞凋亡,并抑制小鼠黑色素瘤B16 细胞的生长[43]。多项研究表明,甘草的活性成分甘草查耳酮A 和光甘草定可以通过抑制皮肤黑色素瘤细胞糖酵解表型诱导细胞凋亡,异甘草素可以通过抑制酪氨酸酶的活性抑制皮肤黑色素瘤细胞的生长[44-47]。这表明中药及其活性成分在延缓皮肤黑色素瘤进展方面扮演重要角色。这些结果可为中医药治疗皮肤黑色素瘤组方配伍提供一定参考价值。
4 结论
本研究通过生物信息学方法说明皮肤黑色素瘤的发生进展是一个多基因异常表达的复杂过程,主要与细胞周期调控、跨膜受体蛋白酪氨酸激酶信号通路、细胞黏附等生物过程及Toll 样受体信号通路等有关,同时如nTreg 等免疫细胞的浸润及相关TME 对皮肤黑色素瘤发生发展也密切相关。此外,本研究从基因层面挖掘出皮肤黑色素瘤的关键基因和优化核心基因(集),有望成为疾病诊断和预后的潜在生物标志物和药物作用靶点。丹参、人参、构皮、高良姜、甘草、蓖麻子、油桐叶等可作为皮肤黑色素瘤治疗的潜在中药,为中医药防治皮肤黑色素瘤提供新的思路。由于本研究只是基于公共数据集进行挖掘,其结果及机制仍需在基础实验与临床研究中进一步验证。
利益冲突所有作者均声明不存在利益冲突
