海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1 细胞增殖的作用研究
2024-01-25任彧娜刘晓庆李慕云廖文勇张淑静范盎然修琳琳钟赣生
任彧娜,刘晓庆,曹 灿,李慕云,廖文勇,张淑静,于 雪,范盎然,修琳琳,钟赣生
北京中医药大学,北京 100029
海藻与甘草属于“十八反”禁忌,历代关于其能否同服的争议颇多[1]。临床中海藻-甘草配伍组合常用于治疗甲状腺疾病,如明代王肯堂《证治准绳》中记载的昆布散可治疗瘿瘤,明代陈实功《外科正宗》中首载的海藻玉壶汤常用于治疗瘰疬、瘿瘤,清代顾世澄《疡医大全》中的消痰汤可用于治疗瘰疬、癥瘕,以上组方均含海藻-甘草配伍且能取得良好疗效[2-3]。关于海藻-甘草反药组合有大量实验研究,其可行性及科学性目前正在被现代科学逐步验证和阐释[4-5]。甲状腺肿大是一种常见的内分泌系统疾病,中医学称甲状腺肿大为“瘿病”,情志郁结、饮食不节、地域差异及体质因素等均可导致脏腑经络失和,气、痰、血壅结形成瘿[6-8]。西医学则认为引起甲状腺功能异常的有诸多因素,如碘摄入不足或摄入过量、自身免疫系统紊乱等,导致甲状腺上皮细胞增生,从而形成甲状腺肿大[9]。在甲状腺肿大的形成过程中,伴随着甲状腺组织的增生和细胞的增殖,细胞凋亡与增殖失衡,凋亡相对不足[10]。
近年来,关于海藻与甘草配伍作用机制的研究较多,但多为包含海藻、甘草的全方,较少直接探讨海藻-甘草对甲状腺肿大的作用[11]。本研究以人甲状腺正常细胞Nthy-ori-3-1 为研究对象,选取前期实验效果最佳剂量即《中国药典》2020 年版高限剂量的2 倍(海藻24 g、甘草20 g)制备含药血清[12-13],通过观察海藻-甘草含药血清对Nthy-ori-3-1 细胞增殖模型的影响,探讨其抗甲状腺肿大的可能作用机制,为海藻-甘草作为可靠的临床用药提供依据。
1 材料
1.1 动物与细胞
SPF 级雄性Wistar 大鼠30 只,10 周龄,体质量300~340 g,购自北京维通利华实验动物技术有限公司,质量合格证号SCXK(京)2021-0011,使用许可证号SYXK(京)2020-0033。动物饲养于北京中医药大学SPF 级动物房,室内温度(22±2)℃,相对湿度60%~70%。动物实验经北京中医药大学动物伦理委员会批准(批准号BUCM-4-2021072001-3037)。
Nthy-ori-3-1 细胞购自商城北纳创联生物科技有限公司,细胞编号340487。
1.2 药品与试剂
海藻配方颗粒(批号21061391)、甘草配方颗粒(批号21070231)购自江阴天江药业有限公司;胎牛血清(fetal bovine serum,FBS,批号2350404RP)、青链霉素混合液(批号187689)购自美国Invitrogen公司;含EDTA 的胰酶(批号2323143)购自美国Gibco 公司;CCK-8 试剂(批号AQ308-500T)、RPMI 1640 培养基(批号10752109088)购自北京翱擎生物科技有限公司;促甲状腺激素受体人单克隆抗体M22(批号m22-11ar)购自英国RSR 公司;电镜固定液(批号CR2305008)、牛血清白蛋白(bovine serum albumin,BSA,批号CR2209008)、DAPI 染色试剂(批号CR2302026)、CY3 标记山羊抗兔IgG 抗体(批号CR2203118)购自武汉赛维尔生物科技有限公司;812 包埋剂(批号CR2304084)购自美国SPI 公司;细胞周期检测试剂盒(批号20220822)、BCA 蛋白含量检测试剂盒(批号20200720)购自凯基生物技术股份有限公司;细胞凋亡检测试剂盒(批号20010370)、β-actin 小鼠单克隆抗体(批号10025459)、微管相关蛋白轻链3(microtubuleassociated protein light chain3,LC3)多克隆抗体(批号00115896)、Beclin1 多克隆抗体(批号00106238)购自美国Proteintech 公司。
1.3 仪器
Heracell Vios 160i 型CO2培养箱(美国Thermo Fisher Scientific 公司);OptiMair 型超净工作台(新加坡ESCO 公司);5702R 型台式低温离心机(德国Eppendorf 公司);CPOCH 型全波长酶标仪(美国Bio-Tek 公司);Echo Revolve 型正倒置一体荧光显微镜(美国Echo 公司);HT7800 型透射电子显微镜(日本Hitachi 公司);FACSCelesta 三激光流式细胞仪(美国BD 公司);GS-900™ Calibrated Densitometry System 型凝胶成像仪(美国Bio-Rad 公司)。
2 方法
2.1 海藻-甘草含药血清的制备
30 只SPF 级雄性Wistar 大鼠适应性喂养3 d后,随机分为对照组和海藻-甘草组。按前期实验基础选择海藻、甘草生药剂量为《中国药典》2020 年版高限剂量的2 倍(海藻24 g、甘草20 g)[12-13],即7.92 g/kg,将海藻和甘草配方颗粒用去离子水混匀配制成混悬液,每日ig 2 次。对照组ig 等体积去离子水,2 次/d,连续5 d。于末次给药1 h 后麻醉,腹主动脉取血,于4 ℃冰箱中静置2 h,待其自然凝血,取上清液,2 500 r/min 离心15 min,取血清,于56 ℃水浴30 min 灭活,用0.22 μm 微孔滤器滤过除菌,分装于15 mL 离心管中,保存于−80 ℃冰箱备用。
2.2 细胞培养
Nthy-ori-3-1 细胞用含 10%胎牛血清、100 μg/mL 青霉素和100 μg/mL 链霉素的RPMI 1640 培养基,常规培养于37 ℃、5% CO2的培养箱,饱和湿度,严格无菌,每2~3 天用0.25%的胰蛋白酶消化细胞并传代,取对数生长期细胞用于实验。
2.3 CCK-8 法检测Nthy-ori-3-1 细胞增殖
2.3.1 M22 对Nthy-ori-3-1 细胞增殖的影响 取对数生长期的Nthy-ori-3-1 细胞,以1×105个/mL 接种于96 孔板,每孔100 μL,于37 ℃、5% CO2培养箱中培养24 h,待细胞贴壁后,分别加入不同质量浓度(0.062 5、0.125 0、0.250 0、0.500 0、1.000 0 μg/mL)的M22,对照组加入等体积PBS,每组设3 个复孔。在37 ℃、5% CO2条件下,分别作用细胞12、24、48 h 后,每孔加入10 μL CCK-8 试剂,继续培养1 h,用酶标仪测定450 nm 处的吸光度(A)值。
2.3.2 海藻-甘草含药血清对Nthy-ori-3-1 细胞活性影响 取对数生长期的Nthy-ori-3-1 细胞,以1×105个/mL 接种于96 孔板,每孔100 μL,于37 ℃、5% CO2培养箱中培养24 h,待细胞贴壁后,设置对照组、模型组和海藻-甘草含药血清组,模型组给予0.125 μg/mL M22 培养24 h,对照组给予等体积PBS;海藻-甘草含药血清组在模型建立的基础上,分别加入5%、10%、15%、20%海藻-甘草含药血清,每组设3 个复孔。37 ℃、5% CO2条件下,作用细胞24 h 后,每孔加入10 μL CCK-8 试剂,继续培养1 h,用酶标仪测定450 nm 处的A值。
2.4 倒置相差显微镜观察Nthy-ori-3-1 细胞形态
取对数生长期的Nthy-ori-3-1 细胞,以2×105个/mL 接种于6 孔板,每孔2 mL,待细胞贴壁后,设置对照组、模型组和海藻-甘草含药血清组,模型组给予0.125 μg/mL M22 培养24 h,对照组给予等体积PBS,海藻-甘草组在模型建立的基础上,加入15%海藻-甘草含药血清,每组设3 个复孔。37 ℃、5% CO2条件下,作用细胞24 h 后,倒置相差显微镜观察各组细胞形态变化。
2.5 透射电镜观察Nthy-ori-3-1 细胞形态
细胞接种、分组及药物处理方法同“2.4”项,药物作用Nthy-ori-3-1 细胞24 h 后,离心收集细胞,加入电镜固定液于4 ℃固定4 h,加入1%锇酸固定2 h,依次乙醇、丙酮脱水,渗透包埋,将树脂块于超薄切片机超薄切片60~80 nm,经醋酸铀饱和乙醇溶液避光染色8 min 和避二氧化碳染色8 min,室温干燥过夜。于透射电子显微镜下观察,采集图像分析。
2.6 流式细胞术检测Nthy-ori-3-1 细胞周期分布
细胞接种、分组及药物处理方法同“2.4”项,每组设3 个复孔。37 ℃、5% CO2条件下,药物作用Nthy-ori-3-1 细胞24 h 后,制备细胞密度为1×106个/mL 细胞悬液,加入70%冷乙醇固定,按Rnase A-PI(1∶9)配制染色工作液,避光染色60 min 后200 目筛网滤过,于流式细胞仪记录激发波长488 nm 处红色荧光。
2.7 流式细胞术检测Nthy-ori-3-1 细胞凋亡
细胞接种、分组及药物处理方法同“2.4”项,每组设3 个复孔。37 ℃、5% CO2条件下,药物作用Nthy-ori-3-1 细胞24 h 后,制备细胞密度为1×106个/mL 细胞悬液,加入CL488-Annexin V 和PI工作液,避光,4 ℃染色15 min 后200 目筛网滤过,流式细胞仪检测细胞凋亡情况。
2.8 免疫荧光检测LC3 平均荧光强度
细胞接种、分组及药物处理方法同“2.4”项,每组设3 个复孔,药物作用24 h 后,将爬片甩干,用组化笔在盖玻片细胞均匀分布处画圈。在圈内加100 μL 破膜工作液,室温孵育20 min,再滴加3%BSA 均匀覆盖组织,室温封闭30 min,一抗4 ℃孵育过夜,二抗室温孵育50 min,滴加DAPI 染液后,用抗荧光淬灭封片剂封片,进行图像采集。
2.9 Western blotting 检测Beclin1 蛋白表达
细胞接种、分组及药物处理方法同“2.4”项,每组设3 个复孔。37 ℃、5% CO2条件下,药物作用Nthy-ori-3-1 细胞24 h 后,弃去培养基,加入RIPA裂解液,于冰上裂解细胞30 min 后,4 ℃、12 000 r/min 离心10 min,取上清,以BCA 试剂盒测定蛋白质量浓度。加入适量Loading buffer,使用PCR 仪在95 ℃、12 min 条件下使蛋白变性。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%脱脂牛奶中封闭1 h,加入一抗4 ℃孵育过夜,加入二抗室温孵育1 h,加入ECL 显色液,显影并定影。以β-actin 为内参,采用Image J 软件分析各条带灰度值。
2.10 统计学分析
采用SPSS 20.0 统计软件进行数据分析,计量资料以±s表示。若数据方差齐,多组比较采用单因素方差分析,组间比较采用最小显著性差异法(LSD);若方差不齐,采用Dunnett’s 检验。
3 结果
3.1 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1细胞增殖的影响
如图1 所示,与对照组比较,0.062 5、0.125 0、0.250 0 μg/mL 的M22 作用24 h,能够显著促进细胞增殖(P<0.05、0.01),其中以0.125 0 μg/mL 的M22 促增殖作用最为明显。
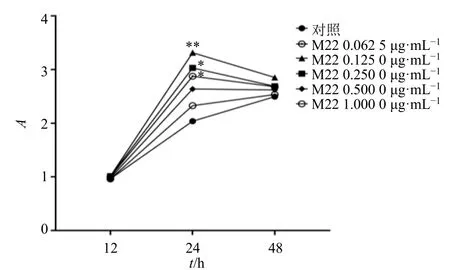
图1 M22 对Nthy-ori-3-1 细胞增殖的影响 (±s, n = 3)Fig.1 Effect of M22 on proliferation of Nthy-ori-3-1 cells(±s, n = 3)
经0.125 μg/mL 的M22 处理Nthy-ori-3-1 细胞24 h,再分别给予5%、10%、15%、20%海藻-甘草含药血清干预24 h,如图2 所示,与对照组比较,模型组细胞活力显著升高(P<0.001);与模型组比较,各给药组细胞活力均显著降低(P<0.05、0.01),以15%海藻-甘草含药血清效果最佳。
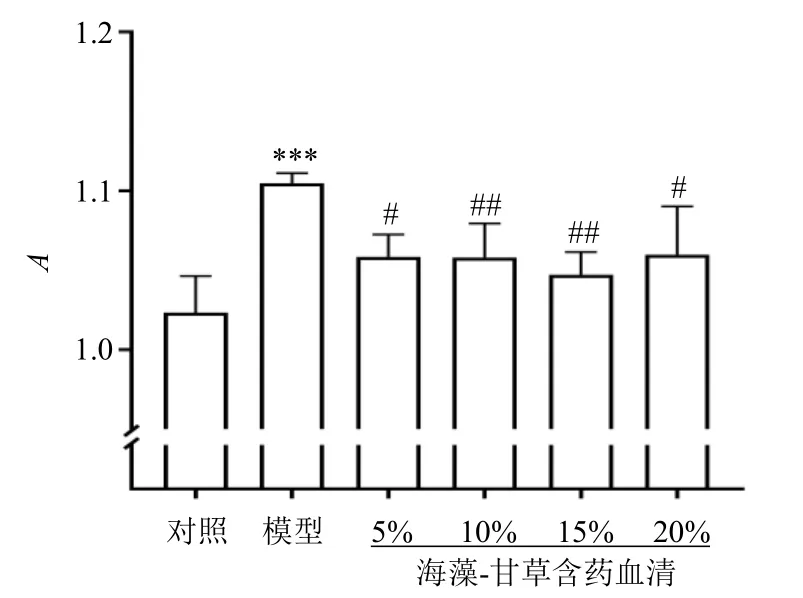
图2 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1 细胞增殖的影响 (±s, n = 3)Fig.2 Effect of Sargassum-Glycyrrhizae Radix et Rhizoma containing serum on proliferation of M22-induced Nthy-ori-3-1 cells (±s, n = 3)
3.2 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1细胞形态的影响
如图3 所示,对照组细胞为梭形或不规则形,呈贴壁生长;模型组细胞数量增多,形态饱满,出现过度增殖现象;海藻-甘草含药血清干预后,细胞增殖被抑制,凋亡细胞增加,细胞密度减少。

图3 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1 细胞形态的影响 (×100)Fig.3 Effect of Sargassum-Glycyrrhizae Radix et Rhizoma containing serum on morphology of M22-induced Nthy-ori-3-1 cells (× 100)
3.3 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1细胞超微结构的影响
如图4 所示,对照组细胞形态正常,边界清晰;模型组细胞内质网发达扩张,线粒体肿胀,溶酶体较少;海藻-甘草含药血清干预后,自噬小体增多,细胞肿胀减轻。

图4 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1 细胞超微结构的影响Fig.4 Effect of Sargassum-Glycyrrhizae Radix et Rhizoma containing serum on ultrastructure of M22-induced Nthyori-3-1 cells
3.4 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1细胞周期分布的影响
如图5 所示,与对照组比较,模型组G0/G1期细胞比例明显下降(P<0.01),S 期和G2/M 期细胞比例无明显差异;与模型组比较,海藻-甘草含药血清组G0/G1期细胞比例明显升高(P<0.01),S 期和G2/M 期细胞比例无明显差异。

图5 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1 细胞周期分布的影响 (±s, n = 3)Fig.5 Effect of Sargassum-Glycyrrhizae Radix et Rhizoma containing serum on cell cycle distribution of M22-induced Nthyori-3-1 cells (±s , n = 3)
3.5 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1细胞凋亡的影响
如图6 所示,与对照组比较,模型组细胞凋亡率明显上升(P<0.05);与模型组比较,海藻-甘草含药血清组细胞凋亡率显著上升(P<0.01)。

图6 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1 细胞凋亡的影响 (±s , n = 3)Fig.6 Effect of Sargassum-Glycyrrhizae Radix et Rhizoma containing serum on apoptosis of M22-induced Nthy-ori-3-1 cells(±s , n = 3)
3.6 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1细胞LC3 表达的影响
如图7 所示,与对照组比较,模型组LC3 平均荧光强度降低;与模型组比较,海藻-甘草含药血清组LC3 平均荧光强度增加。
3.7 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1细胞Beclin1 蛋白表达的影响
如图8 所示,与对照组比较,模型组自噬关键蛋白Beclin1 表达显著降低(P<0.001);与模型组比较,海藻-甘草含药血清组Beclin1 蛋白表达水平显著升高(P<0.01)。

图8 海藻-甘草含药血清对M22 诱导的Nthy-ori-3-1 细胞Beclin1 蛋白表达的影响 (±s , n = 3)Fig.8 Effect of Sargassum-Glycyrrhizae Radix et Rhizoma containing serum on Beclin1 protein expression of M22-induced Nthy-ori-3-1 cells (±s, n = 3)
4 讨论
甲状腺肿大是一种常见的内分泌系统疾病,常伴有甲状腺组织增生和细胞异常增殖,临床上常见于单纯性甲状腺肿大、甲状腺功能亢进或减退、甲状腺结节和甲状腺腺瘤等[10,14]。古今治疗甲状腺肿大的方药中多包含有海藻和甘草的配伍组合,二者虽为反药,却在治疗甲状腺疾病中取得了良好的疗效[15-17]。课题组前期研究表明,包含海藻-甘草配伍的海藻玉壶汤对甲状腺肿大模型大鼠的甲状腺功能、甲状腺系数及甲状腺相关基因的表达均有明显的纠正作用,且全方组效果明显优于各拆方组,海藻、甘草二者缺一不可[18-20]。
M22 现已广泛应用于建立毒性弥漫性甲状腺肿大(Graves disease,GD)和Graves 眼病的细胞模型[21]。GD 患者由于体内的促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAb)分泌过多,导致了甲状腺肿大、甲状腺功能亢进等症状。M22是来自于人体的TSAb 单克隆抗体,TSAb 是TRAb的一种,TRAb 的功能与促甲状腺激素(thyroidstimulating hormone,TSH)类似,因而M22 可以模拟TRAb 的作用,与促甲状腺激素受体(thyroidstimulating hormone receptor,TSHR)竞争性结合进行信号转导,从而引起甲状腺滤泡细胞的过度增殖,分泌过多的甲状腺激素[22-24]。本研究采用M22 刺激Nthy-ori-3-1 细胞建立体外过度增殖模型,通过CCK-8 法检测发现,M22 能明显促进Nthy-ori-3-1细胞增殖,并且0.125 μg/mL 的M22 在作用24 h 时促进细胞增殖的效果最佳。
经M22 刺激的Nthy-ori-3-1 细胞给予海藻-甘草含药血清后,呈现出典型的凋亡特征性改变,细胞数量减少,细胞生长增殖被抑制。流式细胞术结果显示,海藻-甘草含药血清能使Nthy-ori-3-1 细胞的凋亡率明显升高。细胞周期有2 个重要节点,G0/G1期向S 期的转换以及S 期向G2/M 期的转换,S 期是DNA 合成的重要时期。M22 可使G0/G1期细胞比例明显减少,S 期比例略有增加但无明显差异,提示细胞合成增加,细胞增殖被促进;经海藻-甘草含药血清作用后,G0/G1期细胞比例增加,而S 期和G2/M 期无明显差异,推测海藻-甘草含药血清可能主要在G0/G1期发挥作用,从而抑制Nthy-ori-3-1细胞的增殖。
本研究发现,海藻-甘草含药血清可能通过诱导自噬发生来促进Nthy-ori-3-1 细胞的凋亡。LC3 和Beclin1 是自噬形成过程的核心因子,其表达水平变化常用来监测自噬的发生及形成[25-26]。本研究测定Nthy-ori-3-1 细胞的LC3 和Beclin1 蛋白表达水平,结果显示与对照组比较,模型组LC3 平均荧光强度降低,Beclin1 蛋白表达下调,这提示了在M22 刺激Nthy-ori-3-1 细胞增殖的过程中,伴有自噬功能的失调;而与模型组比较,海藻-甘草含药血清组LC3 平均荧光强度明显升高,Beclin1 蛋白表达明显上调,提示海藻-甘草含药血清可能通过促进自噬的发生,从而促进细胞凋亡,发挥抗甲状腺肿大的作用。
本研究初探海藻-甘草对M22 诱导的Nthy-ori-3-1 细胞增殖模型的影响,发现海藻-甘草含药血清可以明显抑制Nthy-ori-3-1 细胞增殖,促进其凋亡。同时,海藻-甘草含药血清可促进LC3 与Beclin1 蛋白表达,后续可研究自噬相关通路其他信号分子的表达情况,进一步探索海藻-甘草配伍对自噬功能的影响。自噬与增殖关系复杂,诱导自噬可能促进增殖,也有可能抑制增殖。本研究观察到海藻-甘草含药血清对自噬的抑制作用,进一步探讨其对细胞增殖的影响,可能为甲状腺疾病防治带来新的突破。
利益冲突所有作者均声明不存在利益冲突
