青藏高原高寒草地土壤酶活性海拔地带性特征
2024-01-25霍皇煜周天财张建香陈俊合汪亚峰
霍皇煜,米 琦,周天财,李 洋,张建香,4,陈俊合,汪亚峰,*,孙 建
1 青藏高原地球系统与资源环境全国重点实验室,中国科学院青藏高原研究所,北京 100101 2 中国科学院大学资源与环境学院,北京 100049 3 兰州大学生态学院,兰州 730000 4 兰州大学资源环境学院,兰州 730000
土壤酶是指土壤中的聚积酶,是一种具有生物催化能力和蛋白质特性的高分子活性物 质[1],包括胞外酶、胞内酶和游离酶等,主要来源于土壤微生物的活动、植物根系分泌物和腐解的动植物残体[2]。土壤酶作为生态系统的生物催化剂,是土壤有机体的代谢驱动力,推动着土壤中的物质循环和能量转化,促进土壤有机质的矿化分解和无机物的转化[3-4]。比如,多种土壤酶在生态系统碳氮磷循环过程中具有重要作用[5]。具体而言,与土壤碳循环密切相关的土壤β-1,4-葡萄糖苷酶(βG),其作用是将纤维二糖水解成一分子葡萄糖,葡萄糖在降解有机化合物的第一阶段具有活性,降低了有机结构分子的大小,从而激发了接下来的微生物酶活性[6]。与土壤氮循环密切相关的N-乙酰-β氨基葡萄糖苷酶(NAG),与细菌多糖外壳和真菌细胞壁的形成有关,还参与几丁质的分解和有机氮的吸收,可将几丁质代谢过程中产生的寡糖水解成单糖[7],其活性的高低一定程度上反映了高寒草地生态系统的氮转化速率[8]。同时,土壤亮氨酸氨基肽酶(LAP)可水解蛋白质,是土壤有机氮水解为氨基酸过程中重要的酶,与土壤氮素的转化过程密切相关[9]。其次,在土壤磷循环中扮演重要角色的土壤碱性磷酸酶(ALP)是一类催化土壤有机磷化合物矿化为无机磷的酶[10],其活性高低直接影响有机磷在土壤中的分解转化及其生物有效性[11]。
此外,土壤酶因其能够及时感知外界因素引起的土壤特性的微小变化,被认为是表征土壤中物质、能量活动强度和土壤质量水平的重要生物学指标[12]。由于其对温度、降水、土壤理化性质等环境因子的高度敏感性,已成为陆地生态系统变化的关键预警信号和敏感指标[13]。20世纪以来,全球气候变暖趋势明显,气候变化对土壤微生物及酶活性具有显著的调控效应。但因为不同土壤酶的温度和降雨敏感性存在差异,因此与生物地球化学循环相关的酶可能以不同方式响应气候变化[14-16]。比如,温度可以通过改变与碳循环相关的土壤酶活性来调控植物的生长。整合分析发现,陆地温度、大气CO2浓度的变化引起土壤温度的改变,可以直接影响微生物的代谢速率以及土壤酶活性,进而改变植物的碳积累和地下部分碳的输入[17]。而与土壤养分循环相关的土壤酶主要受到降水的影响。通过对气候变化下植物与土壤之间养分运输的研究,发现陆地降水的变化容易引起土壤水分的变化,从而影响土壤微生物呼吸速率及养分运输和土壤酶活性的改变[18]。土壤水分和质地决定了植物根系分泌物的释放[19],并调控了土壤酶、底物和反应产物的扩散速率,最终对养分可利用性产生影响[20-21]。
青藏高原作为世界上海拔最高的区域,有“世界屋脊”之称,该区域地貌复杂,气候寒冷干燥,气温日较差大,被认为是全球气候变化的敏感区[22],全球气候的微小变化可能会改变该区土壤微生物群落结构和土壤酶活性进而影响陆地生态系统[23]。青藏高原具有一系列独特的海拔梯度和气候梯度,海拔梯度通常被理解为自然温度、水分和光照梯度,温度和降水作为重要的气候因素随着海拔的增加而发生显著变化。高寒草地是青藏高原最主要的生态系统类型之一,约占青藏高原总面积的60%左右,在调节气候、固碳固氮和涵养水源等方面具有重要的生态功能[24-26]。青藏高原独特的地形地貌特征、寒冷干燥的气候条件和恶劣严苛的植物生长环境,导致高寒草地生态系统结构和功能对环境变化非常敏感[27-28]。虽然青藏高原独特的海拔梯度和水热梯度为研究土壤酶活性的垂直地带性变化特征提供了天然实验室,但是气候因子,尤其是温度和降水在海拔梯度上如何影响高寒草地的各种土壤酶活性并不清晰。大量研究主要关注定点或者小尺度海拔对土壤酶活性的影响[29-32],而有关青藏高原区域大尺度土壤酶活性的海拔梯度变化特征和驱动因素研究较少。因此,在全球气候变化大背景下,系统地研究青藏高原高寒草地生态系统中土壤酶活性对海拔的响应机制,有助于我们展开对高寒草地生态系统关键结构、过程和功能的探讨。
1 材料与方法
1.1 研究区概况
青藏高原平均海拔4000 m以上[33],是中国最大、世界海拔最高的高原[34]。本文研究区域(图1)位于青藏高原,覆盖了四川、甘肃、青海和西藏地区(经度80°-105°E,纬度27°-37°N,海拔3023-5124 m,年均气温-5.69-6.29 ℃,年降水量52.15-1078.84 mm),气候寒旱特征明显[35]。该地区主要植被类型是高寒草甸、高寒草原和高寒荒漠草原,主要土壤类型有毛毡土、冷钙质土和棕色钙质土[36]。植物群落中主要优势物种有针茅属(Stipa)、嵩草属(Kobresia)和薹草属(Carex)等[37]。

图1 研究区样点示意图Fig.1 Sample sites map of the study area
1.2 土壤样品采集及酶活性的测定
2020年7月中旬至8月底,在沿青藏高原内部环线人为干扰较少的地方,每隔50 km左右随机选取采样点,共计在135个样点进行取样,并记录每个样点的经纬度、海拔和植被类型等信息。每个样地大小10 m×10 m,在每个样地随机选取3组50 cm×50 cm小样方进行植物群落调查和样品采集。用直径为3.5 cm的土壤螺旋钻在各个小样方内随机采集3钻土壤样品,每钻采集0-10、10-20 cm和20-30 cm的土层,其中0-10 cm土样用于测定土壤酶活性。以上样品采集后,均严格按照标准处理方式保存并带回实验室进行测定。
回到实验室后,将土壤样品风干,通过2 mm筛网过筛,并用球磨机研磨成细粉,在4 ℃下储存,用于土壤酶活性测定。NAG、ALP、LAP、βG活性均采用微孔酶标板荧光分析法测定[38-39]。将土壤悬液、底物及相应缓冲液置于微孔板内培养,使酶反应在微孔板内进行,而后进行荧光检测。具体如下:NAG活性采用对硝基苯酚法测定,以每克土样每天生成1 μmol对硝基苯酚定义为一个酶活力单位。LAP活性采用对硝基苯胺法测定,以每克土样每天生成1 nmol对硝基苯胺为一个酶活力单位。ALP活性采用磷酸苯二钠法测定,以在37 ℃下每克土样每天释放1 nmol苯酚为一个酶活力单位。βG活性采用对硝基苯酚法测定,以每天每克土样中产生1 μmol对硝基苯酚定义为一个酶活力单位。
1.3 气候数据来源与分析
通过中国气象数据网(https://data.cma.cn/)获取青藏高原年平均气温(annual mean temperature,AMT)和年降水量(annual mean precipitation,AMP)数据,再使用Anusplin 4.2进行空间插值,得到1 km空间分辨率的气候栅格数据。最后,基于采样点的经纬度,利用ArcGIS 10.2 (ESRI,Redlands,USA)软件提取研究区135个样点的气候数据。
1.4 数据分析方法
采用Excel 2019和SPSS 26 (IBM SPSS Statistics 26)对数据进行整理和分析,其中,对βG、NAG、ALP、LAP活性和各环境因子进行Pearson相关性分析,对高低海拔情况下的温度、降水和βG、NAG、ALP、LAP活性进行单因素方差分析。采用ArcGIS 10.2绘制研究区样点示意图;采用SigmaPlot 14.0绘制散点图,并进行线性回归分析;采用Origin 2018绘制箱线图;用R 4.1.3进行频率分布直方图和热度图绘制,包括R语言的“corrplot”、“ggplot2”和“gridExtra”语言包。
2 结果
2.1 高寒草地土壤酶活性数据特征
NAG、ALP、LAP和βG活性在区域尺度上存在差异。与氮循环相关的NAG和LAP活性的变化范围分别为1.03-41.51 μmol d-1g-1、0.38-15.06 μmol d-1g-1,与磷循环相关的ALP活性的变化范围为1.70-45.83 μmol d-1g-1,而与碳循环相关的βG活性的变化范围为2.02-115.38 μmol d-1g-1(图2)。NAG和LAP活性的离散程度比较小,其标准差分别是6.22 μmol d-1g-1、2.29 μmol d-1g-1。而ALP和βG的活性较高,其平均值分别是22.53 μmol d-1g-1和38.17 μmol d-1g-1。

图2 土壤酶活性频率分布图Fig.2 Frequency distribution of soil enzyme activityMax:最大值;Min:最小值;Mean:平均值;SD:标准差
2.2 地形和气候因子对土壤酶活性的影响
相关性热度图(图3)表明,青藏高原ALP和βG活性均与海拔呈显著负相关(P<0.01);温度和降水均与海拔呈显著负相关(P<0.05),其中与降水相关性较高;NAG、ALP和βG活性均与降水呈显著正相关(P<0.01),其中与ALP和βG相关性较高。

图3 土壤酶活性与地形和气候因子的相关性Fig.3 Correlation of soil enzyme activity and the topographical and climatic factorsALT:海拔;AMT:年平均气温;AMP:年平均降水量;βG:土壤β-1,4-葡萄糖苷酶;NAG:土壤N-乙酰-β氨基葡萄糖苷酶;LAP:土壤亮氨酸肌肽酶;ALP:土壤碱性磷酸酶
海拔和土壤酶活性回归模型发现,除了ALP和βG以外,其余土壤酶(NAG和LAP)活性在海拔梯度上没有显著性的变化趋势(图4)。Piecewise回归模型结果显示,ALP活性随着海拔的升高而显著降低(P<0.01),ALP活性的海拔阈值为3546 m左右,当海拔高于3546 m时,ALP活性对海拔的敏感性更高(图4)。在海拔3364 m处,βG活性变化显著,在海拔低于3364 m时,βG活性与海拔显著正相关,在海拔高于3364 m时,βG活性与海拔显著负相关(P<0.01,图4)。综合ALP和βG的海拔阈值,我们定义低海拔范围为3023-3455m,高海拔范围为3455-5124m。

图4 土壤酶活性与海拔的关系Fig.4 The relationship between soil enzyme activity and altitudeTH: 阈值
2.3 土壤酶活性沿气候梯度的变化规律
ALP和βG活性在海拔梯度上变化显著,进一步对海拔阈值前后的气候因子和土壤酶活性进行分析。高低海拔模式下ALP活性与降水显著正相关(P<0.01),且高海拔模式下(R2=0.35,slope=0.04,图5)ALP活性对降水的敏感性大于低海拔(R2=0.35,slope=0.03,图5)。而高低海拔模式下ALP活性与温度均无显著关系(图5)。
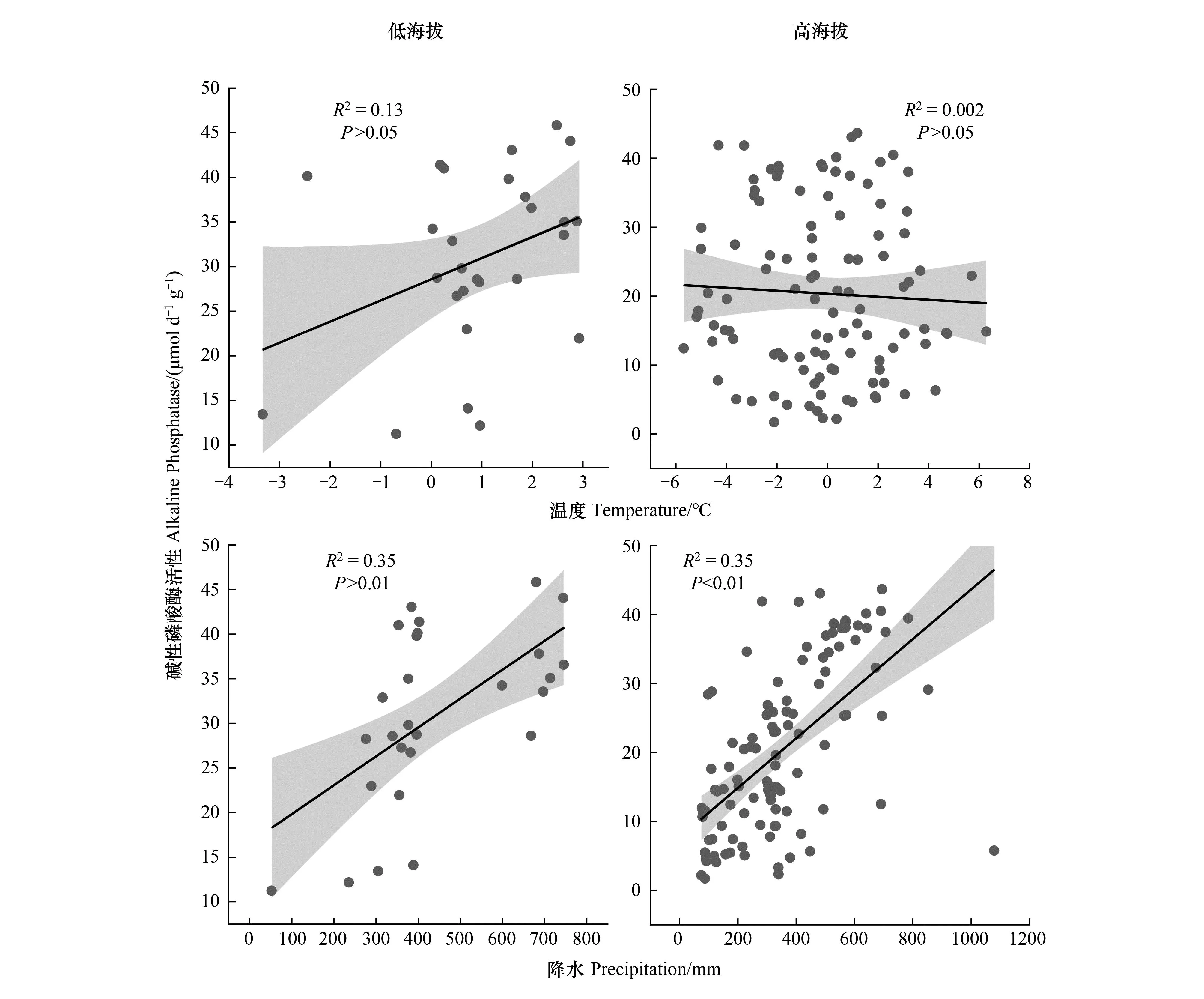
图5 高低海拔模式下温度、降水与ALP酶活性的关系Fig.5 The relationships among temperature,precipitation and ALP enzyme activity阴影部分表示95%置信区间
高低海拔模式下分别建立温度和降水与βG活性的回归模型发现,低海拔模式下,温度和降水对βG活性无显著影响(图6)。高海拔模式下,降水与βG活性均呈显著正相关关系(R2=0.35,P<0.01,图6)。低海拔βG活性(平均值为66.12 μmol d-1g-1)显著高于高海拔βG活性(平均值为35.19 μmol d-1g-1,图7)。除个别极值外,低海拔ALP活性(平均值为30.89 μmol d-1g-1)显著(P<0.05)高于高海拔ALP活性(平均值为20.43 μmol d-1g-1,图7)。

图6 高低海拔模式下温度、降水与βG酶活性的关系Fig.6 The relationships among temperature,precipitation and βG enzyme activity

图7 高低海拔模式下温度、降水、酶活性的差异Fig.7 The relationship among temperature,precipitation and enzyme activity图第一行按照ALP海拔阈值区分高低海拔;图第二行按照βG海拔阈值区分高低海拔;*表示在0.05水平上差异显著;**表示在0.01水平上差异显著;箱体部分五条水平箱线自下而上分别代表变量的最小值、第一四分位数、中位数、第三四分位数和最大值;散点自左往右代表不同海拔对应的温度、降水和酶活性值
3 讨论
3.1 高寒草地土壤酶活性
土壤是个复杂多酶体系,土壤酶活性可以较全面的反应土壤环境、质量和肥力变化[40-42]。目前,关于海拔对土壤酶活性影响的研究结果差异较大[43-46],本研究证明了青藏高原ALP和βG活性均与海拔相关性显著,NAG和LAP活性与海拔相关性不显著(图4),分析其原因可能为不同土壤酶活性对气候的响应差异有关。
一般认为,氮在青藏高原地区是稀缺的,酶作为富含氮的化合物,其生产在氮有限的系统中受到氮可用性的严格控制[47],所以总氮决定了土壤酶的生产,影响土壤酶的活性。本文中,与土壤氮循环密切相关的NAG和LAP活性数据标准差较小(图2),说明两种土壤酶具有相对较强的稳定性[48],这可能的原因是,青藏高原高寒草地在普遍缺氮的环境调控下,使得N循环酶的生产是基因组成性表达的结果[47],同时,高原冻土也使得NAG和LAP活性较少受到蛋白水解的影响。而与土壤碳循环密切相关的βG和与土壤碳循环密切相关的ALP活性相对较高(图2),说明了βG和ALP大多数情况下具有长时间的高活性状态。而βG和ALP活性的标准差较大,说明了βG和ALP活性容易受到环境因子的影响[49]。
3.2 土壤酶活性对环境因子的响应机制
环境因子直接或间接改变酶的活性,例如通过酶本身构象变化、与土壤颗粒的络合以及扩散速率的改变直接影响酶活性[50],或通过改变底物溶解度、底物浓度、目标物的可及性、微生物的生存策略等间接影响酶活性[47]。研究发现土壤酶活性(除了LAP)均与降水量呈正相关关系(图3),这可能是因为降水通过改变土壤含水量来影响土壤酶活性,从而显著影响底物和抑制性化合物的扩散速率[50]。同时,降水也可以通过影响微生物养分需求和土壤养分有效性来影响土壤酶活性。比如,降水量的增加也可能导致土壤养分淋失降低,导致微生物底物减少,从而限制微生物营养。因此,微生物会分泌更多相应的酶以满足其营养需求[51]。综上所述,降水作为主导因素不仅直接影响土壤酶活性,而且降水也能通过影响植物生长,土壤含水量和养分,与养分循环密切相关的微生物群落组成和结构,最终间接作用于土壤酶活性。
虽然降水通过多种途径调节土壤酶活性,但不同土壤酶活性在响应高低海拔时存在差异。为了解释温度和降水是如何对土壤酶活性产生影响的,进一步在不同海拔模式下进行了分析。具体而言,碳源酶与磷源酶随海拔升高而出现拐点(图4),造成这一结果的主要原因可能是底物可用性受限制,磷源酶由于随着海拔的增加,磷限制的缓解,ALP的分泌相应减少。其中,随着海拔的升高,βG活性先升高后下降,这可能是由于在一定温度阈值内,较高的土壤温度对βG活性有促进作用[52]。
对于ALP而言,高低海拔模式下,随着降水量沿海拔梯度的降低,ALP活性降低(图5)。这是因为降雨会增加土壤酶与土壤颗粒的络合以及土壤酶与底物的扩散速率[53-54],其次,降雨还会影响土壤养分淋溶、土壤有机质的降解以及植被生长和发育等过程间接影响土壤酶活性[55]。高海拔模式下ALP活性对降水的敏感性高于低海拔。其原因可能是在高海拔地区资源限制加剧,降水的增加能调动更多的资源可用性。
对于βG而言,高低海拔模式下,βG活性与温度相关性不显著(图6),说明土壤βG对温度变化不敏感,这是因为温度的变化将以难以预测的复杂方式影响酶活性。一方面,在达到某个最佳温度(通常超过其原生环境中记录的温度)之前,温度增加会增加酶催化反应的速率,另一方面,微生物可能会因变暖而减少酶的合成和分泌[56-57]。此外,酶变性率和细胞外蛋白酶的降解活性也可能随着变暖而增加[58]。
海拔是一定均温、活动积温和降水量的综合反映,地形的垂直变化会改变植物群落结构和类型的演化[59-60],进而通过土壤光、热、水和空气条件改变土壤的物理、化学和生物性质,最终导致生态系统功能发生改变[61]。综合而言,由于海拔高度的不同,气候环境、植被特征、土壤理化性质等存在差异[62],植被类型、土壤养分、微生物群落组成、温度和降水等一系列影响土壤酶活性的生物和非生物因素[63]也会存在差异,多重因素的影响使得高低海拔模式下土壤酶活性的差异性显著(图7)。即,相比高海拔的低水热、土壤养分、微生物量和微生物活性,低海拔环境限制得到一定改善[62],所以其土壤酶活性较高。
4 结论
以青藏高原高寒草地为研究对象,将土壤酶活性海拔梯度研究从站点尺度拓展到样带尺度。基于样带上135个样点调查分析,综合运用4种土壤酶和3个环境因子,从环境因子与土壤酶活性关系的角度出发,对土壤酶活性随海拔的变化特征进行研究。研究发现,青藏高原高寒草地生态系统土壤酶活性存在较为明显的海拔格局,随着海拔的上升,ALP和βG展现出显著分异,其阈值分别约为3546 m和3364 m,且低海拔显著高于高海拔。高低海拔模式下,ALP活性受降水影响显著;高海拔模式下,βG活性受降水影响显著,低海拔模式下,气候影响不明显。土壤酶活性对环境因子有适应性的改变,海拔的变化对温度降水产生影响,进而影响土壤酶活性。总而言之,降水是高寒草地土壤酶活性变化的主导因素,但是不同土壤酶活性响应高低海拔的降水存在差异。研究结果对理解高寒草地生物地球化学循环过程和机制具有重要意义。
