L-茶氨酸延缓应激条件下秀丽隐杆线虫的衰老
2024-01-25杜召凤李怡霏屈长青
杜召凤,李怡霏,贾 茹,屈长青,2*
(1.阜阳师范大学 生物与食品工程学院,安徽 阜阳 236037;2.阜阳师范大学 抗衰老中草药安徽省工程技术研究中心,安徽阜阳 236037;3.安徽农业大学 茶树生物学与资源利用国家重点实验室,安徽 合肥 230036)
衰老是自然界中的一种由不同器官和系统一系列特定变化所产生的复杂的生命现象,它是生命运动的自然过程[1]。生命体生存周期的延长通常是与机体对外界的抗胁迫能力相关。常见的胁迫环境有热应激、氧化应激、紫外应激等。衰老是每一个生命体都不可避免的自然现象,但是随着对生命科学探索的逐渐深入,以及现代医学的发展,一些抗衰老药物可以做到一定程度地延缓衰老[2]。古往今来,人们对于延缓衰老延长寿命的探寻从未停止,随着我国社会人口老龄化的严重,对于抗衰老机制及抗衰老药物的研发已成为当前生命科学研究的重要课题[3]。
茶氨酸是茶叶中特有的氨基酸[4],其主要分布在茶叶的嫩枝、子叶和根中,存在两种同分异构体,分别为L 型和D 型茶氨酸,研究中所用到的L型茶氨酸为游离形式天然氨基酸,具有抗氧化、抗炎、神经保护、抗癌、抗焦虑、代谢调节、心血管保护、肝和肾保护以及免疫调节等作用[5-8],是我国批准的新食品原料[9]。目前有关茶氨酸抗衰老研究的模型动物有小鼠、家禽,但是以线虫为模型研究应激条件下的茶氨酸抗衰老功效较少。本实验以秀丽隐杆线虫为模式生物,采用热应激与氧化应激两种胁迫条件,研究L-茶氨酸对于改善各种应激引起的秀丽隐杆线虫抗氧化逆境的作用,为L-茶氨酸抗逆境、抗衰老产品的开发应用提供依据。
1 材料与方法
1.1 材料、试剂与设备
1.1.1 材料
L-茶氨酸(纯度≥98%),购于上海源叶生物科技有限公司;秀丽隐杆线虫(Caenorhabditis elegans,C.elegans),包括野生型秀丽隐杆线虫(Bristol strain N2)以及转基因品系TJ375[hsp-16:GFP],由阜阳师范大学抗衰老中草药安徽省工程技术研究中心提供;大肠杆菌E.coli0P 50由阜阳师范大学抗衰老中草药安徽省工程技术研究中心提供。
1.1.2 主要试剂及配制
谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(Superoxide Dismutase,SOD)试剂盒购于北京索莱宝科技有限公司。
M9 缓冲液(1L):称取3.0 g 磷酸二氢钾,6.0 g磷酸氢二钠,5.0 g 氯化钠,0.25 g 七水硫酸镁,加入去离子水定容至1 L,121 ℃高压灭菌20 min,4 ℃冰箱保存[10]。
裂解液(100 ml):取5 mol·L-1氢氧化钾溶液和10%次氯酸钠溶液各10 mL,定容至100 mL[11]。
NGM-OP50 培养基[12](1 L):称取3.0 g 氯化钠,17.0 g 琼脂,2.5 g 蛋白胨,975 mL 蒸馏水,25 mL 磷酸盐缓冲溶液,121 ℃高压灭菌20 min 后,再加入硫酸镁、氯化钙以及胆固醇溶液。待冷却后,涂布100μLE.coliOP50于平板上。
1.1.3 仪器设备
培养箱(上海一恒科技仪器有限公司);普通冰箱(中国海尔集团有限公司);倒置光学显微镜(日本Olympus 有限公司);超净工作台(中国ESCO 公司);恒温水浴锅(上海一恒科学仪器有限公司);TDL80-2B 台式离心机(上海安亭科学仪器厂);高压灭菌锅(日本HIRAYAMA 公司);振荡培养箱(金坛市白新宝仪器厂);紫外分光光度计(上海沪西分析仪器厂有限公司);超纯水仪(美国Millipore 有限公司);酶标仪(美国BioTek 公司)。
1.2 实验方法
1.2.1 线虫的培养及实验分组
将5 d 龄体内带卵的线虫用M9 缓冲液冲下,进行同期化处理,20 ℃培养12 h,得到L1 期线虫,将其接种到NGM-OP50 培养基上,20℃培养48~54 h,即得到用于实验的L4 期线虫,将其分为对照组和处理组,处理组用L-茶氨酸进行干预,同时根据Zarse K 等人[13]的研究,设置浓度分别为0.1、1、10μmol·L-1。分别用CD、LD、MD、HD 表示对照组、L-茶氨酸低剂量组、L-茶氨酸中剂量组、L-茶氨酸高剂量组。
1.2.2 移动力测定
建筑面积的大小是影响造价成本波动的根本因素。对于建筑面积较小的工程,工程造价成本的预估难度相对来说就小很多,且预估造价与最终决算费用的误差也较小。而对于建筑面积较大的工程,受建筑材料、人工费用等因素价格波动影响,其最终的造价成本预估也较难控制。
收集同期化野生型N2 线虫培养8 d,各组随机选取100 条,记录线虫的移动能力。线虫的移动力测定方法参考刘星雨[14]等人的方法,具体标准为:①秀丽隐杆线虫自发运动,不需要触碰刺激,记为A;②秀丽隐杆线虫必须受到触碰刺激才运动,记为B;③秀丽隐杆线虫受到触碰刺激后只摆动头或尾,记为C。每组实验重复三次。
1.2.3 急性热应激实验
本方法基于龚雨顺[15]等人实验改进,同期化野生型N2 线虫培养3 d,随机挑取20 条转移至加有M9 溶液的EP 管中,在37 ℃的水浴条件下分别应激10、15、20、25 分钟后观察并记录其存活率。每组实验重复三次。
1.2.4 TJ375 型线虫的荧光可视化
收集同期化转基因品系TJ375 型线虫培养3天,在35 ℃恒温培养箱中进行热环境胁迫处理。热应激1 h 后,转移至20 ℃下恢复24 h。滴加10μL 左旋咪锉溶液(1 mmol·L-1)麻醉,倒置荧光显微镜下观察线虫体内相对荧光强度,拍摄荧光图片,利用Image J 软件分析处理。每组实验重复三次。
1.2.5 H202诱导的急性氧化应激实验
收集同期化野生型N2 线虫培养3 d,将线虫暴露于10μL 30%的H202中,每隔5 min 观察并记录线虫的存活率,直至线虫全部死亡。每组实验重复三次。
1.2.6 氧化应激后脂褐素水平的测定
按照1.2.6 的方法处理线虫,在对照组的秀丽隐杆线虫半致死时,即在30%的H202作用10 min时,挑取存活的线虫进行荧光观察。荧光观察方法参照王慧[16]等实验方法改进。配制1%浓度的琼脂糖凝胶,每个组挑取4~5 条线虫,滴加10 uL左旋咪锉溶液(1 mmol·L-1)麻醉,倒置荧光显微镜下,激发340~380 nm,发射430 nm,观察线虫体内脂褐素水平,拍摄荧光图片,利用Image J 软件分析处理[17]。每组实验重复三次。
1.2.7 线虫抗氧化酶活力的测定
收集同期化野生型N2 线虫培养8 d,转移至EP 管中,将秀丽隐杆线虫用生理盐水制备成冰浴匀浆,液氮速冻后解冻,重复两次,超声震碎,4 ℃、8000 r·min-1离心,收集上清液[18]。采用试剂盒测定线虫体内超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)活力。每组实验重复三次。
1.3 数据处理
数据使用GraphPad Prism 5.0 软件进行统计分析,组间比较采用单因素方差分析,用平均值±标准差(x±s)表示。“*”表示P<0.05,差异具有统计学意义,“**”表示P<0.01,存在显著性差异;“***”表示P<0.001,存在极显著差异。
2 结果与分析
2.1 对野生型N2 线虫移动力的影响
有研究表明,移动能力及对外界机械刺激反应的退化是测定秀丽隐杆线虫衰老的一种指标[19]。如图1 所示,线虫培养至第8 天时,L-茶氨酸可以提高秀丽隐杆线虫的移动力,说明L-茶氨酸具有提高野生型秀丽隐杆线虫抗衰老的潜力。
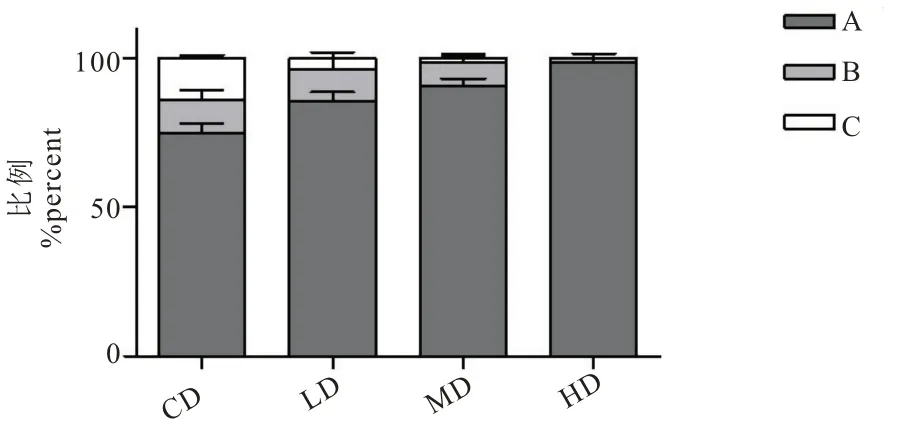
图1 L-茶氨酸对线虫移动力的影响
2.2 热应激下野生型N2 线虫的寿命
在37 ℃急性热应激情况下,不同浓度茶氨酸对野生型秀丽隐杆线虫在10、15、20、25 分钟时寿命的影响如图2 所示,与CD 组相比,HD 组在10、15、20、25 分钟时均能提升线虫的存活率(P<0.05),说明10μmol·L-1的L-茶氨酸能够有效延长野生型秀丽隐杆线虫急性热应激下的寿命。
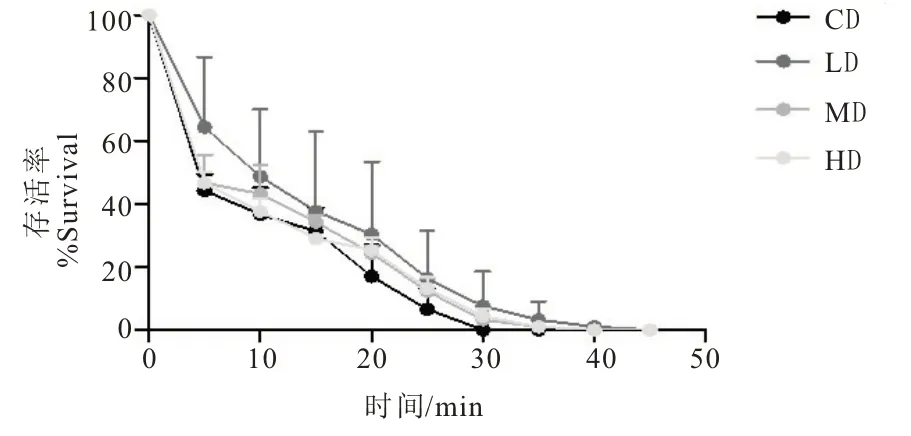
图2 L-茶氨酸对热应激下线虫寿命的影响
2.3 热应激下TJ375 型线虫的相对荧光检测
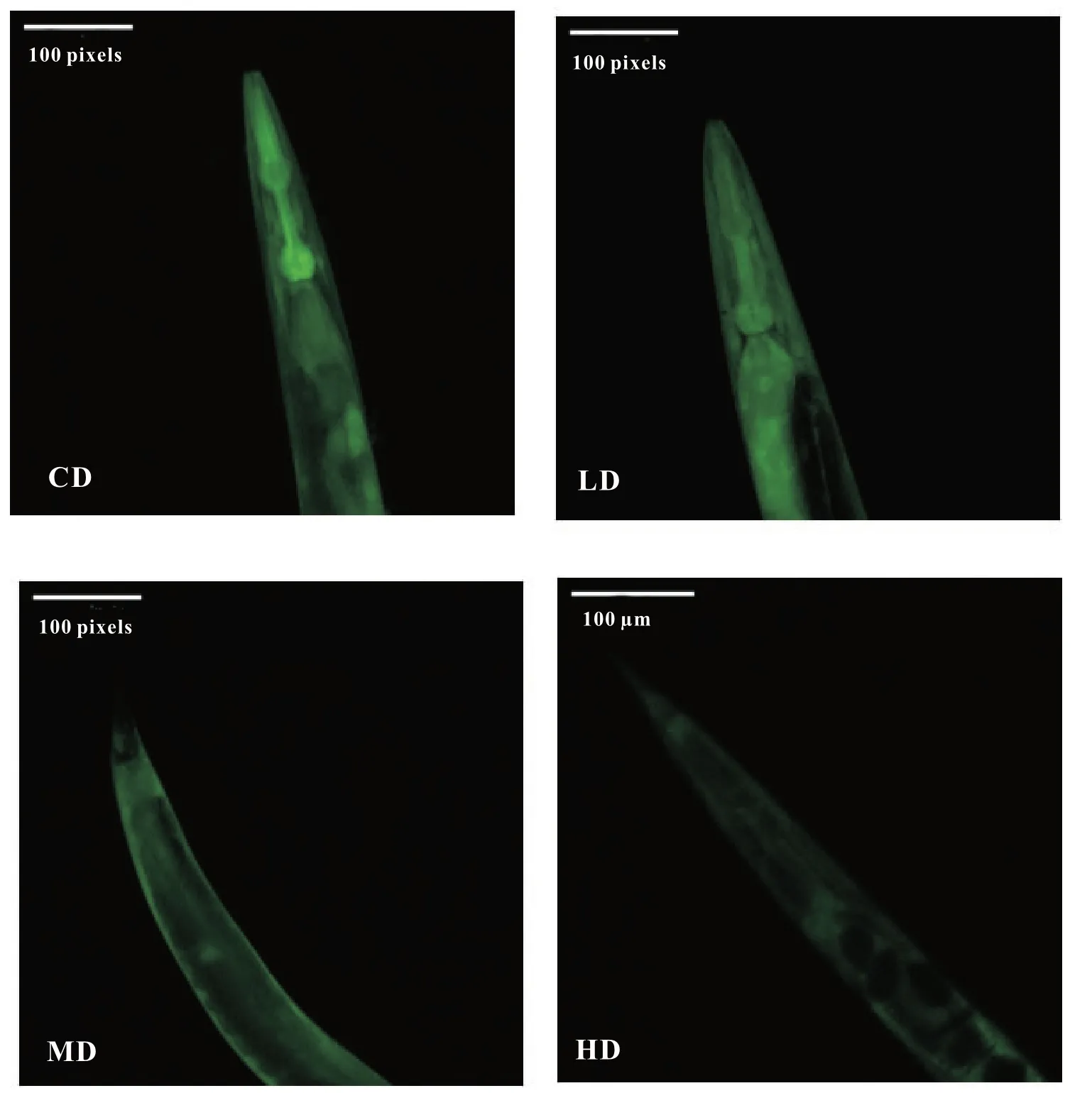
转基因品系TJ375 型线虫受到外界热应激刺激后,会表达hsp:gfp 融合蛋白发挥抗逆性作用[20],由图3 可以得出与CD 组相比,HD 组可极显著降低线虫体内的相对荧光强度,降低比例为46.1%。说明L-茶氨酸对线虫的热应激损伤具有修复作用。
注:相对荧光强度即线虫体内热休克蛋白自发荧光面积与虫体面积之比。*:与对照组相比,P<0.05。**:与对照组相比,P<0.01。***:与对照组相比,P<0.001。##:与L-茶氨酸高剂量组相比,P<0.01。
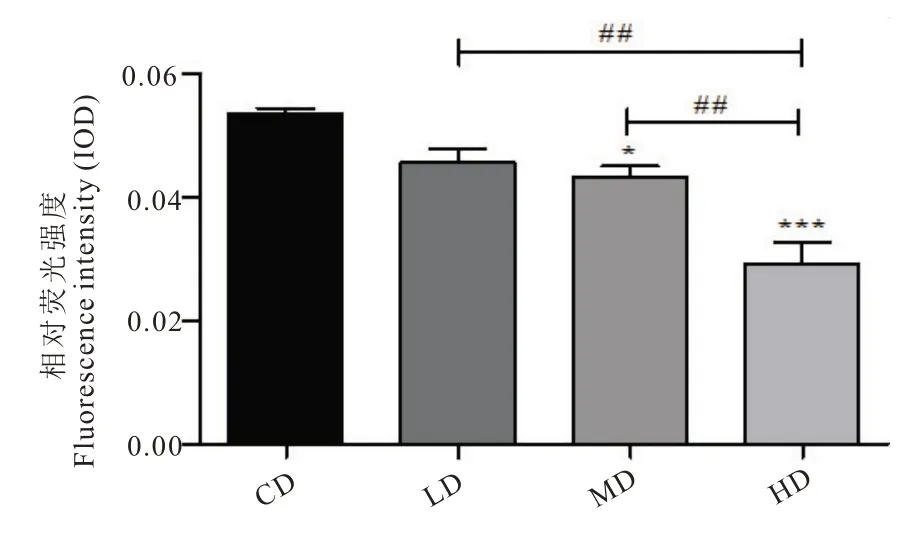
图3 L-茶氨酸对热应激下TJ375 线虫荧光强度的影响
2.4 L-茶氨酸对氧化应激损伤线虫的影响
如表1 所示,CD 组的最大寿命为17.0 ± 1.7 min,LD 组的最大寿命为22.0±1.7 min,MD 组的最大寿命为25.0 ± 1.7 min,HD 组的最大寿命为31.0±1.7 min。MD 组相对于CD 组有显著性差异(P<0.05),HD 组相对于CD 组有极显著差异(P<0.001)。说明L-茶氨酸能够延长秀丽隐杆线虫在氧化应激下的最大寿命。

表1 L-茶氨酸对氧化应激下线虫最大寿命的影响
2.5 茶氨酸对氧化应激损伤线虫脂褐素含量的影响
线虫体内的脂褐素会随着年龄增长而增多,可作为线虫机体衰老的生物标志。由图4 可知,HD 组秀丽隐杆线虫体内的脂褐素荧光值较CD组相比显著降低(P<0.05)。由此说明,茶氨酸能够有效降低氧化应激损伤引起的线虫体内脂褐素水平,减缓线虫机体的衰老。
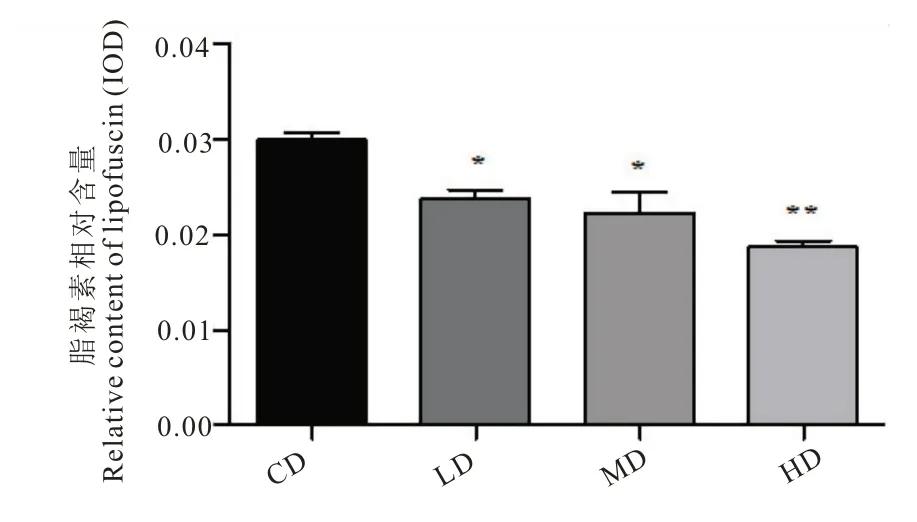
图4 L-茶氨酸对氧化应激下线虫脂褐素含量的影响
2.6 L-茶氨酸对线虫体内抗氧化酶活力的影响
SOD 和CAT 是线虫体内两种重要的抗氧化酶[21],GSH-Px 也具有抗氧化作用,是机体内广泛存在的一种重要的过氧化物分解酶。L-茶氨酸不仅可以通过非酶促抗氧化,还能够以SOD、GSHPx 抗氧化作为防线抑制过氧化物与过氧化氢等产生的双重抗氧化作用[22]。由图5 可知,给予一定剂量的茶氨酸后,秀丽隐杆线虫体内抗氧化酶活力与对照组相比显著升高,其中,与CD 组相比,LD、MD、HD 组线虫体内的SOD 活力分别提升了56.8%(P<0.001)、70.8%(P<0.001)、80.4%(P<0.001),均达到极显著差异水平;CAT 活力分别提升 了25.5%、52.9%(P<0.05)、164.7%(P<0.001);GSH-PX 活力分别提升了7.2%、18.6%(P<0.05)、51.0%(P<0.001)。说明L-茶氨酸能够有效增强线虫的抗氧化性,这可能是其发挥抗衰老作用的机制之一。
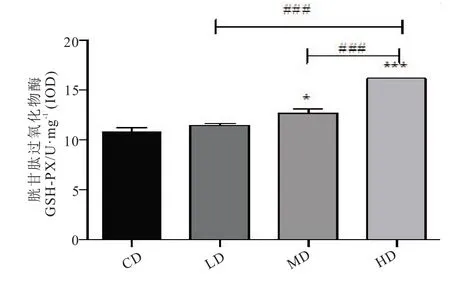
3 讨论
本实验从线虫运动力测定、热应激下寿命和相对荧光检测、氧化应激下的寿命和脂褐素水平以及体内抗氧化酶活力测定等方面结果表明,10μmol·L-1的L-茶氨酸能够延长秀丽隐杆线虫在热应激条件下的寿命以及在氧化应激的条件下的最大寿命,极显著地降低热应激后的相对荧光强度,提高它的抗胁迫能力。茶氨酸的合成还受到诸多生物和非生物因素的调控[23],其启动子区含多个响应逆境胁迫的顺式作用元件,郭晨[24]等人也证明L-茶氨酸具有改善热处理引起的小鼠组织损伤和氧化逆境的效果。L-茶氨酸可以降低氧化应激后线虫体内脂褐素水平,减缓衰老。同时10μmol·L-1剂量组氧化损伤线虫体内SOD、CAT 和GSH-Px 活力极显著增加(P<0.001)。因此我们认为这两个方面可能与茶氨酸提高线虫的抗衰老能力有关。已有研究表明,L-茶氨酸可通过下调小鼠体内炎症因子的表达,减少氧化应激损伤,调控线粒体凋亡通路以减少细胞凋亡,抑制MAPK 信号通路降低促凋亡信号引起的凋亡[25-32]。本实验结果为相关茶氨酸抗氧化保健产品开发应用提供了科学依据,但本次研究只局限于生理表型方面,后期我们将通过基因表达检测、组学等实验技术,系统探究其分子机制,为茶氨酸在食品工业或者制药工程中的开发提供理论帮助。
