蓖麻PIP5K1 基因克隆、生物信息学及功能分析
2024-01-24李明静袁朴芳尹明达王志妍户雪妹顾晓慧黄风兰
李明静 袁朴芳 罗 蕊 尹明达 王志妍 户雪妹 顾晓慧 黄风兰,2
(1 内蒙古民族大学生命科学与食品学院,通辽 028000;2 内蒙古自治区蓖麻育种国家民委重点实验室/内蒙古自治区蓖麻育种与综合利用重点实验室/蓖麻产业技术创新内蒙古自治区工程研究中心/内蒙古自治区高校蓖麻产业工程技术研究中心,通辽 028000)
蓖麻(Ricinus CommunisL.)是大戟科蓖麻属双子叶一年生或多年生草本植物,是一种用途广泛、经济效益高的非食用性作物,为世界十大油料作物之一,具有极高的附加价值[1]。蓖麻种子含油量在40%以上[2],是一种可以替代石油应用于生产实践的植物油,被视为可再生的“石油”资源,从中提炼出的蓖麻油也广泛应用于国防、化工、轻纺、医药等多种行业[3]。在提取蓖麻油后剩余的蓖麻饼粕中,仍然含有大量的粗蛋白、粗纤维、碳水化合物和多种矿物质元素,同时还含有少量的天然毒素物质,可以用于饲料、杀虫剂、改良土壤,具有巨大的开发潜力[4]。蓖麻既耐干旱也耐盐碱,为目前国内不少土地问题(如可耕种区域少和土壤盐碱化严重等[5-7])开辟了新的解决途径。蓖麻也是一种抗重金属的植物,能抗Cu2+和Zn2+等[8],可用于重金属污染土壤的修复[9]。国际社会对蓖麻产品日益关注,而我国对蓖麻的研究由来已久[10],其中以内蒙古通辽为主产区,通辽市的蓖麻种植面积约为全国的1/4。
PⅠP5K 酶(Phosphatidylinositol 4-phosphate 5-kinase)是有机体中一种重要的磷脂质激酶,能加快1-磷脂酰-1D-肌醇环5 位羟基磷酸化和PⅠ-4-磷酸的磷酸化并生成PⅠ-4,5-二磷酸,该转化过程在磷酸肌醇循环中属于至关重要的环节,并且在调节多种信号通路中起着核心作用[11-13]。由此可知,PⅠP5K 酶是磷脂酰肌醇(Phosphatidylinositol,PⅠ)信号转导通路中的一个重要酶类,对PⅠ信号转导通路中的调节也在许多细胞功能中起关键作用[14]。王永富等[15]发现辣椒PIP5K1基因的启动子顺式作用元件主要响应激素、防御与胁迫以及低温应答;Chakrabarti等[16]、Mikami 等[17]发现拟南芥PIP5K1基因参与拟南芥水分胁迫的响应和脱落酸(ABA)信号调控途径;Ugalde 等[18]、Liu 等[19]在拟南芥和小麦上的试验结果表明,PIP5K1是液泡生物合成和早期花粉发育的重要因素,而梁塔娜等[20]在蓖麻上的试验也有类似结论。总之,PIP5K基因家族参与调控多种植物生长发育,而PIP5K1基因参与不同代谢通路的调节,同时在逆境响应过程中也发挥着重要的作用。
本文通过克隆蓖麻PIP5K1基因,对其进行了生物信息学和在不同时期雌性植株内的表达分析,为揭示PIP5K1基因参与调控蓖麻植株的生长发育机理和发掘与之相关的其他重要基因奠定了基础。
1 材料与方法
1.1试验材料供试材料为蓖麻Lm 型雌性系aLmAB2品种,该品种由蓖麻育种国家民委重点实验室提供。
1.2试验方法
1.2.1PIP5K1基因的克隆蓖麻总RNA 提取随机选取30 株蓖麻Lm 型雌性系aLmAB2品系的花序轴顶端,使用北京Takara 生物技术有限公司的植物组织RNA 提取试剂盒提取蓖麻花序总RNA。
反转录 取1µL的Random Primers,4µL的RNA溶液混匀。在70℃水浴锅中加热5min,立即冰水浴5min,离 心10s。加 入4µL 的5×React Buあer,4µL的MgCl2,1µL 的RT,1µL 的PCR Nuc mix,0.5µL 的rRNasin,进行PCR 扩增,PCR 扩增程序为70℃变性15min,25℃退火5min,42℃延伸60min,40 个循环。反应结束后,对cDNA 浓度进行测定,并将其稀释到100ng/µL 作为后续反应的模板。
引物设计 从NCBⅠ检索得到PIP5K1的基因序列(序列号:LOC8275135),利用网页程序Snap Gene 进行引物设计(表1)。
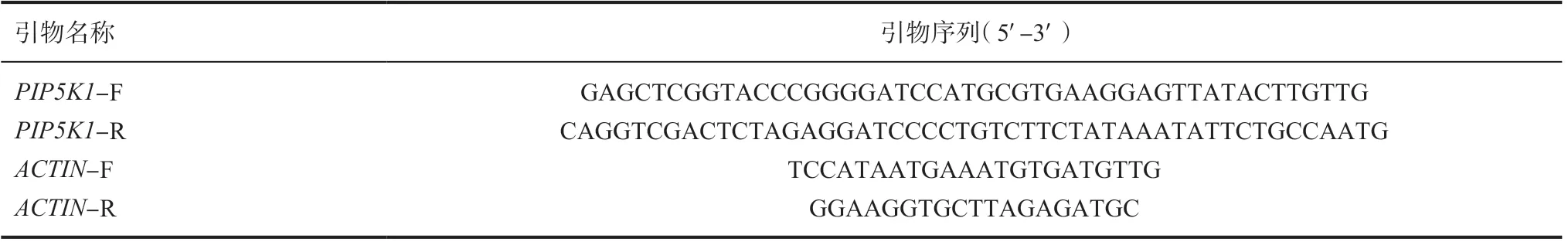
表1 引物名称与序列
PCR扩增 以反转录得到的cDNA作为模板进行PCR 扩增。扩增体系为:5×PS Buあer 10.0µL;dNTP 4.0µL;引物1 和引物2 各1.0µL;模板1.5µL;ddH2O 32.0µL;PrimeSTAR 0.5µL。扩增程序为:94℃预变性5min;94℃变性30s;55℃退火45s,72℃复性延伸1min,72℃终延伸10min。40 个循环。反应完成后,电泳检测。
目的基因回收 扩增完成后,采用试剂盒法进行目的基因的回收纯化。
克隆载体与目的基因连接 将pUC19 载体与纯化后得到的目的基因进行无缝连接,连接体系为:Mix 试剂5.00µL,目的基因0.75µL,载体1.80µL,ddH2O 2.45µL。连接过程在16℃水浴锅(DK-8D)中进行,过夜连接。
连接产物转化大肠杆菌与菌液PCR 鉴定 用冻融法把连接好的产物10µL 接入DH5α大肠杆菌感受态,摇菌培养,离心,涂板培养,最后挑取单斑与100μg/mL Amp(氨苄青霉素)液体混合后作为模板进行菌液PCR 鉴定,菌液PCR 体系参考王志妍等[21]的方法。PCR 反应程序与以cDNA 作为模板展开扩增的体系相同,以上步骤完成后用1%琼脂糖凝胶电泳对PCR 产物进行检测。
酶切重组载体并测序分析 利用限制性内切酶BamHⅠ和KpnⅠ对重组载体双酶切,酶切过程于37℃水浴锅中静置3h,载体酶切反应体系参考王志妍等[21]的方法。酶切完成后琼脂糖凝胶电泳检测鉴定,将鉴定正确的菌液送至通用生物股份有限公司开展序列测定和分析。
1.2.2PIP5K1基因的生物信息学分析使用Protparam、Expasy-ProtScale、TMHMM、SOPMA、SWⅠSS-Model 和MEGA 等软件对基因PIP5K1编码蛋白的理化性质、亲疏水性、跨膜区、二级结构、三级结构及同源性利用生物信息学展开分析或预测。
1.2.3PIP5K1基因表达量分析PIP5K1基因与蓖麻ACTIN基因引物序列见表1。以反转录获得的cDNA 为模板,以蓖麻ACTIN基因为内参,进行实时荧光定量PCR(qRT-PCR)分析。根据北京庄盟国际生物基因科技有限公司荧光定量PCR 试剂盒说明书进行操作。反应体系包括:SYBR Premix Ex Taq 10.0µL,上下游引物各0.4µL,cDNA 2.0µL,ddH2O 7.2µL。扩增反应在ABⅠ 7500 FAST 实时荧光定量PCR 仪上进行,扩增条件为:95℃预变性5min,60℃ 10min,72℃ 35min,40 个循环。
1.3数据处理采用2-ΔΔCt法计算相对表达量,以相同的试验方法进行3 次生物学重复,用SPSS 2016对数据进行单因素方差分析,并采用Graphpad 作图。
2 结果与分析
2.1PIP5K1基因克隆结果对得到的蓖麻总RNA展开电泳检测,在图1A 能够发现3 个明显条带(28S、18S、5S),可以用作反转录模板。以cDNA为PCR 扩增模板,扩增结果见图1B,PCR 扩增后获得2325bp 的明显条带。
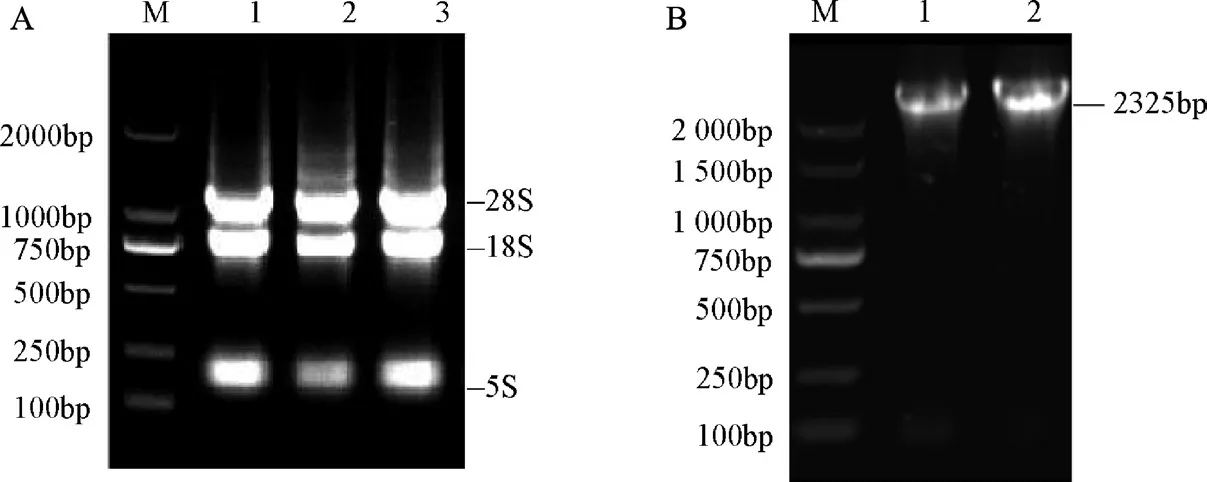
图1 蓖麻总RNA 提取及PIP5K1 基因PCR 扩增电泳检测结果
将重组载体菌液PCR 扩增结果进行琼脂糖凝胶电泳检测,结果见图2A。送样进行序列测定及分析。用BamHⅠ和KpnⅠ两种酶对重组子进行双酶切鉴定,电泳检测结果见图2B,重组子经双酶切后得到了2686bp 和2325bp 的2 条特异性片段,酶切验证结果正确。
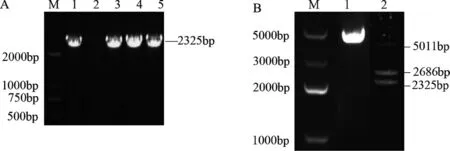
图2 重组载体菌液PCR 电泳及质粒酶切产物电泳检测结果
测序结果显示PIP5K1基因为含有2325 个碱基的序列,通过对序列测定后的拼接结果和PIP5K1基因参考序列展开比对,发现2 个序列相同。
2.2PIP5K1基因所编码蛋白的生物信息学分析结果
2.2.1蛋白质理化性质分析利用Protparam 软件分析发现,PIP5K1基因编码蛋白的氨基酸等电点是8.85,氨基酸数目是774 个,不稳定系数是31.84,分子量大小是87967.37Da,亲水性系数是-0.669,属于亲水性稳定蛋白。
2.2.2蛋白质亲疏水性分析用Expasy-ProtScale网站对蛋白质的亲疏水性展开分析,结果见图3。从图中可知PIP5K1基因编码蛋白质的亲水性平均系数为负值,说明该蛋白为亲水性蛋白。

图3 PIP5K1 基因编码蛋白亲疏水性分析
2.2.3蛋白质跨膜区分析使用网页程序TMHMM对跨膜区展开分析,结果见图4。该图可以表明PIP5K1基因所编码蛋白具有774 个氨基酸,没有具备跨膜螺旋区域,属于非跨膜蛋白。
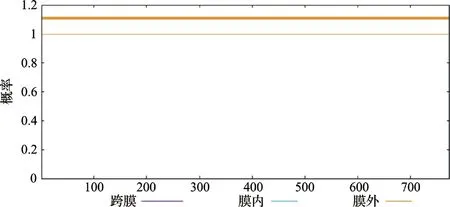
图4 PIP5K1 基因编码蛋白跨膜区分析
2.2.4PIP5K1基因编码蛋白质的结构分析基于网页程序SOPMA 对蛋白质的二级结构展开预测,结果见图5。该图表明在所测蛋白的序列中,α 螺旋包含了179 个氨基酸,占比23.13%;β 转角中包含了66 个氨基酸,占比8.53%;伸展链包含了151 个氨基酸,占比19.51%;无规卷曲包含的氨基酸数目为378 个,占比48.84%。
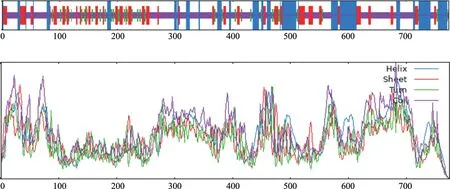
图5 PIP5K1 基因编码蛋白二级结构预测
通过网页程序SWⅠSS-Model 对PIP5K1基因编码蛋白的三级结构展开预测,效果如图6 所示,该图表明PIP5K1基因编码蛋白关键构成要素包括了α 螺旋、β 转角、伸展链、无规卷曲等,而无规卷曲所占据的比例几乎达到该结构的一半,和上面得到的二级结构预测保持一致。PIP5K1基因编码蛋白特定的生物学功能取决于其空间结构的复杂性。
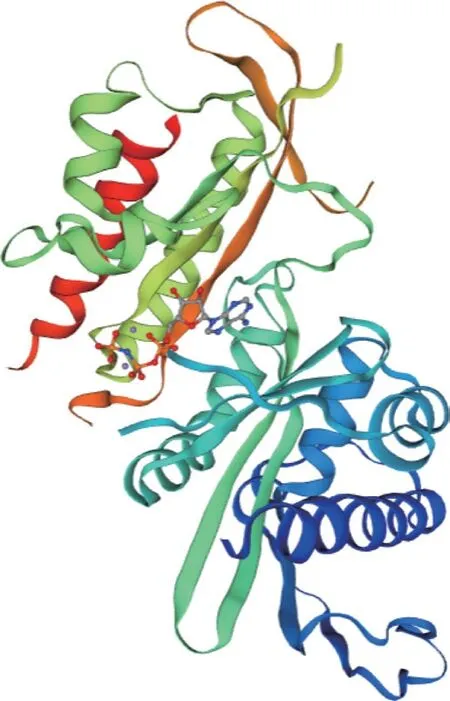
图6 PIP5K1 基因编码蛋白三级结构预测
2.2.5同源性分析用本地软件MEGA 中的邻接法对PIP5K1基因编码蛋白与其他植物种类如木薯等,展开同源性比较,进行500 次的bootstrap 检测,比较结果如图7 所示。该图表明,在本文所选择的物种中和蓖麻PIP5K1基因编码蛋白亲缘关系最近的是同属于大戟科的木薯,和其余物种的亲缘关系相对较远,亲缘关系最远的当属高粱。
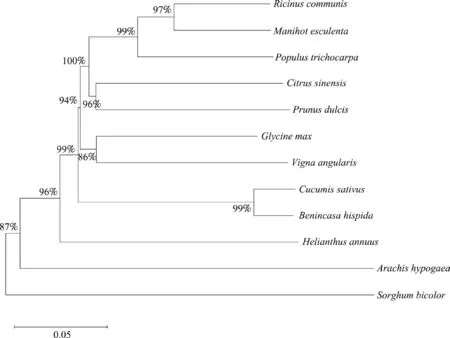
图7 蓖麻PIP5K1 基因编码蛋白进化树分析
2.3PIP5K1基因在不同时期不同花序中的差异表达提取Lm 型雌性系蓖麻aLmAB2标雌系、单雌系、两性系花序的营养生长期(4 叶期)、营养生长到生殖生长转变期(5 叶期)、主茎穗开花期、二级分枝开花期共12 种样品的总RNA,进行PIP5K1基因荧光PCR 检测。由图8 可以看出,PIP5K1基因在单雌系、标雌系2 种花序5 叶期时基因相对表达量普遍高,在3 种花序类型的主茎穗时期表达量较低;在标雌系花序的5 叶期时有最高的相对表达量,在单雌系花序主茎穗期有最低的相对表达量,最高相对表达量是最低相对表达量的16 倍左右。

图8 蓖麻PIP5K1 相对表达量变化
3 讨论与结论
磷脂酰肌醇4-磷酸5-激酶(PⅠP5K)是PⅠ信号转导途径中的关键酶,该基因家族在许多细胞的功能发挥方面起着关键作用。PIP5K1基因在植物生长发育及代谢方面和逆境响应过程中发挥着重要的调控作用。目前对于PIP5K1基因在生长发育和代谢功能方面的研究较多,文艳鹏[22]对蓖麻PIP5K基因家族的功能进行研究,结果表明PIP5K1基因是影响液泡生物合成和早期花粉发育的重要基因,而周玉琼[23]发现了PIP5K1基因在玉米生长过程中具有促进根尖和花粉管发育成熟的作用。张高原等[24]发现PIP5K1基因在西瓜植株各组织的不同发育时期均表现出较高的表达量,说明PIP5K1基因可能参与调控西瓜不同组织形态的代谢通路。本试验克隆得到的PIP5K1基因大小是2325bp,而梁塔娜[25]研究的蓖麻PIP5K1基因大小为3246bp,这可能是因为他们研究的是蓖麻PIP5K1基因的完整序列,而本文研究的是蓖麻PIP5K1基因的编码序列。本研究结果表明PIP5K1基因所编码的蛋白质是具有亲水性的稳定蛋白质,对该蛋白展开二级结构预测显示占比最大的组成成分为无规卷曲,这与前人结论一致。
本研究采用克隆技术得到全长为2325bp 的蓖麻PIP5K1基因片段。基于PIP5K1基因所编码蛋白展开生物信息学分析,结果显示该蛋白的氨基酸数目为774 个,分子质量是87967.37Da,分子式为C3888H6028N1112O1160S33;总平均亲水性系数为-0.669,不稳定系数为31.84,所以该蛋白是一种具有亲水性的稳定蛋白;无跨膜螺旋区,属于非跨膜蛋白;在蛋白的二级结构中23.13%的比例为α 螺旋、8.53%的比例为β 转角、19.51%的比例为伸展链、48.84%的比例为无规卷曲;三级结构与二级结构预测结果一致;与同属大戟科的木薯亲缘关系较近。PIP5K1基因在标雌系花序中相对表达量最高,在两性系花序中相对表达量最低。本研究通过克隆蓖麻PIP5K1基因并对其编码蛋白进行生物信息学和基因表达量分析,为揭示PIP5K1基因参与调控蓖麻植株的生长发育机制和深入研究奠定了理论基础,而该基因对蓖麻生长发育的调控作用和代谢通路的调节作用有待进一步研究。
