橡胶树蛋白激酶基因SnRK2.7 的克隆及表达
2024-01-23刘云飞田维敏
刘云飞,李 言,田维敏
(1. 海南大学 热带作物学院,海口 570228; 2. 中国热带农业科学院 橡胶研究所/农业农村部橡胶树生物学与遗传资源利用重点实验室/海南省热带作物栽培生理学重点实验室,海口 571101)
脱落酸(abscisic acid, ABA)是一种经典植物激素,在植物应对干旱、高盐和低温等非生物胁迫中起重要的调节作用。植物遭遇低温、干旱和高盐等逆境胁迫时,内源ABA 迅速积累,应对环境胁迫的压力[1-2]。ABA 诱导细胞中分子伴侣、LEA蛋白、防冻蛋白、糖、脯氨酸等保护剂的积累,或激活解毒机制,调节氧化还原平衡或改变离子转运来重建稳态,从而增强植物非生物胁迫的耐受性[3]。此外,ABA 还调节植物种子成熟、种子休眠和萌发、营养发育、幼苗建立、根生长、开花、气孔运动和衰老等各方面的生长发育[4]。
人们对ABA 信号传导途径已经有了较深入的了解。在高等植物逆境胁迫时,ABA 含量增加,结合于受体PYR/PYL/RCAR 蛋白内腔的配体结合位点,诱导受体蛋白的构象变化,ABA 被封闭在受体蛋白内,重塑了受体蛋白的表面,为磷酸酶PP2Cs 提供相互作用的结合位点,形成PYR/PYL/RCAR-ABA-PP2C 复合物,从而阻断了底物进入PP2Cs 的活性位点[5-7]。PP2Cs 是ABA 信号通路的负调节因子,可阻止ABA 信号的传递,降低了植物对环境胁迫的耐受性[8-9]。PP2Cs 与ABA 受体的互作,增强了PYR/PYL/RCARs 与ABA 的结合力,其亲和力增加了大约10 倍[10-11],从而减弱PP2C 对下游蔗糖非发酵相关蛋白激酶2(Sucrose non-fermentating1-related protein kinase 2,SnRK2)的抑制作用[5-7]。一些没有与ABA 结合的PYR/PYL/RCARs 也可以自由与PP2Cs 相互作用,但外源性ABA 显著增强受体对PP2C 活性的抑制作用[12]。在ABA 信号转导途径中,SnRK2s 是一个重要环节,能够磷酸化下游的转录因子和其他蛋白,从而调控植物的逆境反应。拟南芥有38 个SnRKs,分为SnRK1、SnRK2 和SnRK3 三个亚家族[13],其中,SnRK2 家族有10 个成员。SnRK2s 通过磷酸化bZIP23,介导干旱胁迫反应[14];通过磷酸化ABI5,介导ABA 调控种子萌发[15];通过磷酸化ICE1,介导ABA 调控抗寒性的形成[16]。低温胁迫下,拟南芥内源ABA 含量增加,SnRK2.6/OST1 被激活,从而磷酸化下游ICE1,增强它的转录活性和稳定性,提高了植株的抗寒性[16]。又因为JA 也调节ICE1 的转录[17],所以SnRK2.6/OST1 在ABA和JA 信号途径交互调控植物的ICE-CBF 途径中起重要作用。
巴西橡胶树(Hevea brasiliensisMuell. Arg.)(简称橡胶树)原产南美洲亚马逊河流域,是商业用天然橡胶的主要来源。我国的橡胶树种植区位于世界热带北缘,经常性遭遇的寒流是我国发展橡胶树种植业面临的一种主要的非生物逆境。所以选育“高产抗寒”品种一直是我国橡胶树育种的首要目标。通过60 余年的杂交育种,选育出一批抗寒性强的橡胶树品种,为研究橡胶树低温胁迫抗性形成机制提供了优良材料。橡胶树无性系‘93-114’是我国自主选育的次生代抗寒品种,尤其是抗平流型寒害的能力强。笔者从橡胶树无性系‘93-114’的叶片中分离到一个SnRK2 基因家族的一个成员—HbSnRK2.7。为了探索蛋白激酶基因HbSnRK2.7在巴西橡胶树应对低温胁迫反应中的作用,采用q-PCR 技术,分析了该基因在外源ABA 处理和低温胁迫下的表达模式,以及不同抗寒性种质间的表达差异,旨在为进一步鉴定HbSnRK2.7的功能提供理论依据。
1 材料与方法
1.1 材料实验材料为处于一蓬叶稳定期的橡胶树抗寒种质‘桂研73-165’、‘GT1’、‘INA873’、‘湛试32-713’、‘93-114’和不抗寒种质‘PB235’、‘热垦514’、‘热垦515’、‘海垦1’、‘热垦501’的芽接苗,该材料于2020 年芽接于中国热带农业科学院种苗培育基地。多糖多酚植物总RNA 提取试剂盒(离心柱型)和FastKing cDNA 第一链合成试剂盒(去基因组)(天根生化科技有限公司);荧光定量所需酶(2×TB GreenTM Premix ExTaqTMⅡ)(大连宝生物公司);其他生化试剂为进口或国产分析纯试剂;基因扩增和荧光定量引物(生工生物工程上海股份有限公司)。
1.2 材料处理低温处理恒温培养箱(PGR15,COVVILN,加拿大)条件设置为:光照强度为125 μmol·m-2·s-1,光照周期16 h/8 h,温度为28 ℃,相对湿度为80%。将生长一致且健康的30 株芽接苗置于培养箱,恢复培养2 d,平均分为处理组和对照组,然后将处理组幼苗置于4 ℃的恒温培养箱中,其他设置条件不变,分别在0 、2 、4 、8、12、24 h 时间点收集叶片,每个时间点选择15 株幼苗,每株幼苗采集1 片树叶,等量5 片树叶制成1 个混合样,每个时间点制成3 个混合样,对照同样采集样品。用0.1 mmol·L-1ABA 喷施整株幼苗,然后置于28 ℃的恒温培养箱中继续培养,分别在0、2、4、8、12 和24 h 时间点收集叶片,每个时间点选择15 株幼苗,每株幼苗采集1 片树叶,等量5 片树叶制成1 个混合样,每个时间点制成3 个混合样[18]。ABA 处理和低温处理共用对照。采集的样品迅速置于液氮中,用于提取总RNA。分别采集一蓬叶稳定期的橡胶树种质‘桂研73-165’、‘GT1’、‘INA873’、‘湛试32-713’、‘93-114’、‘PB235’、‘热垦514’、‘热垦515’、‘海垦1’、‘热垦501’芽接苗的树皮,每个种质采集5 株幼苗制成1 个混合样品,3 个生物学重复,迅速置于液氮中,用于提取总RNA。
1.3 总RNA 的提取与cDNA 的合成按照多糖多酚植物总RNA 提取试剂盒说明书提取样品的总RNA。按照cDNA 合成试剂盒的说明书合成cDNA。然后置于-20 ℃冰箱中保存备用。
1.4 基因HbSnRK2.7的克隆从转录组[19]中,筛选1 个有差异表达的 Unigene,注释为SnRK2家族成员,通过橡胶树基因组数据库[20],获得该基因cDNA 序列。借助NCBI 比对分析,确定该基因为HbSnRK2.7,并获得完整的基因开放阅读框序列。依据HbSnRK2.7的开放阅读框序列,设计引物(表1),扩增基因开放阅读框全长。利用 RTPCR 技术,从橡胶树‘93-114’叶片中扩增出基因HbSnRK2.7的开放阅读框全长。RT-PCR 扩增体系为 50 μL,高保真酶 25 μL、引物HbSnRK2.7-FL-F 和HbSnRK2.7-FL-R 各1 μL、模板1 μL、ddH2O 添加至50 μL。扩增程序:95 ℃预变性5 min;95 ℃变性10 s,58 ℃退火30 s,72 ℃延伸2 min,35 个循环;72 ℃再延伸5 min。然后1%琼脂糖凝胶电泳,胶回收,连接转化,挑阳性菌落,送广州艾基生物技术公司进行测序验证。
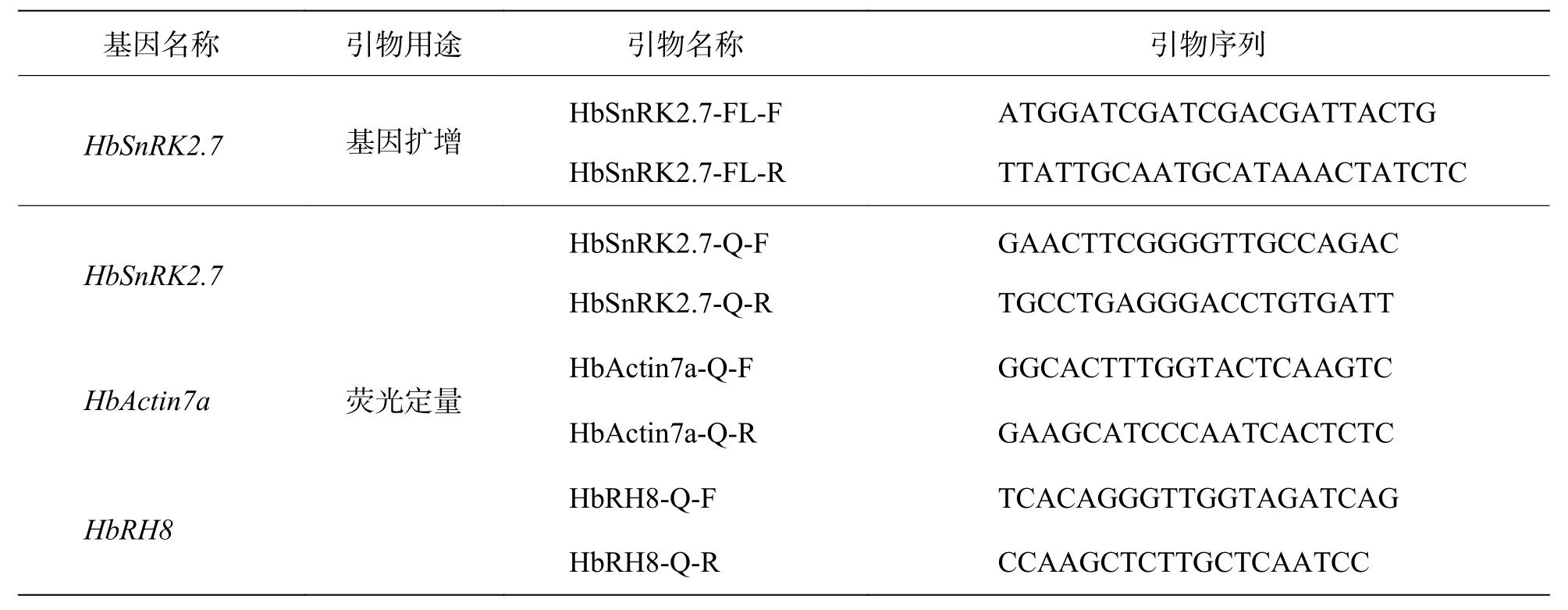
表1 橡胶树基因HbSnRK2.7 扩增引物和荧光定量引物
1.5 HbSnRK2.7生物信息学分析通过DNAMAN V9 软件对HbSnRK2.7进行多重序列比对、基因序列翻译、蛋白质分析等方面的分析。通过Expasy 软件对HbSnRK2.7蛋白的分子量和等电点进行分析。通过MEGA5.10 软件对HbSnRK2.7的氨基酸序列进行进化树分析。通过NetPhos 3.1 软件分析HbSnRK2.7的磷酸化位点。
1.6 q-PCR 分析利用CFX384 实时荧光定量PCR 系统(Bio-Rad,加利福尼亚,美国)进行q-PCR 实验。依据基因丰度,将cDNA 稀释10 倍作为q-PCR 模板。实验反应体系和方法参照文献 [18]。内参基因为HbActin7a和HbRH8。基因HbSnRK2.7荧光定量引物和内参引物见表1。HbSnRK2.7 相对表达量通过2-△△Cq法进行分析[21]。
1.7 数据处理采用t-test 方法对基因相对表达量进行差异显著性分析(P<0.05 为显著性差异;P<0.01 为极显著差异)。
2 结果与分析
2.1 橡胶树HbSnRK2.7基因的克隆与生物信息学分析在HbSnRK2.7阅读框的两端设计引物,通过RT-PCR 技术及核苷酸测序技术,以橡胶树‘93-114’的cDNA 为模板,克隆了HbSnRK2.7基因的完整阅读框(图1)。HbSnRK2.7 包含364 个氨基酸,预测的分子量和等电点分别为41.39 kD 和4.70。HbSnRK2.7与拟南芥(Arabidopsis thalianaL Heynh.)AtSnRK2.2、AtSnRK2.3、黄瓜(Cucumis sativusL.)CsSnRK2.2、 葡萄(Vitis viniferaL)VvSnRK2.3的核苷酸序列的同源性分别为73.39%、74.98%、80.87%和77.99%。HbSnRK2.7氨基酸序列与黄瓜CsSnRK2.2、葡萄VvSnRK2.3、蓖麻(Ricinus communisL)RcSnRK2.2、玉米(Zea maysL)ZmSnRK2.2 的氨基酸序列同源性分别为90.96%, 84.07%, 65.11%和67.58%。虽然氨基酸序列同源性有一定差异,但是它们具有保守的丝氨酸/苏氨酸蛋白激酶结构域(结构域Ⅰ),可催化磷酸基从ATP 转移到蛋白质底物上的丝氨酸/苏氨酸残基上(图2)。另外,它们都有结构域Ⅱ、结构域Ⅲ和结构域Ⅳ。结构域Ⅱ是HbSnRK2.7 响应非生物胁迫所需的结构域;结构域Ⅲ紧挨结构域Ⅱ,位于蛋白的C 端,是ABA 依赖的HbSnRK2.7激活所需结构域;结构域Ⅳ位于结构域Ⅰ内,HbSnRK2.7 蛋白的N 端,是与ATP 结合的保守结构域(图2)。结构域的保守性表明它们可能具有相似的生物学功能。通过NetPhos 3.1 软件分析HbSnRK2.7 的磷酸化位点,结果显示HbSnRK2.7含有13 个丝氨酸、5 个苏氨酸和4 个酪氨酸磷酸化位点,大部分磷酸化位点集中在丝氨酸/苏氨酸蛋白激酶结构域(图2)。聚类结果显示,橡胶树HbSnRK2.7 与拟南芥AtSnRK2.2、AtSnRK2.3、黄瓜CsSnRK2.2、葡萄VvSnRK2.3 等属于SnRK2亚家族的第Ⅲ组(图3)。

图1 橡胶树HbSnRK2.7 基因的阅读框及其推导的氨基酸序列
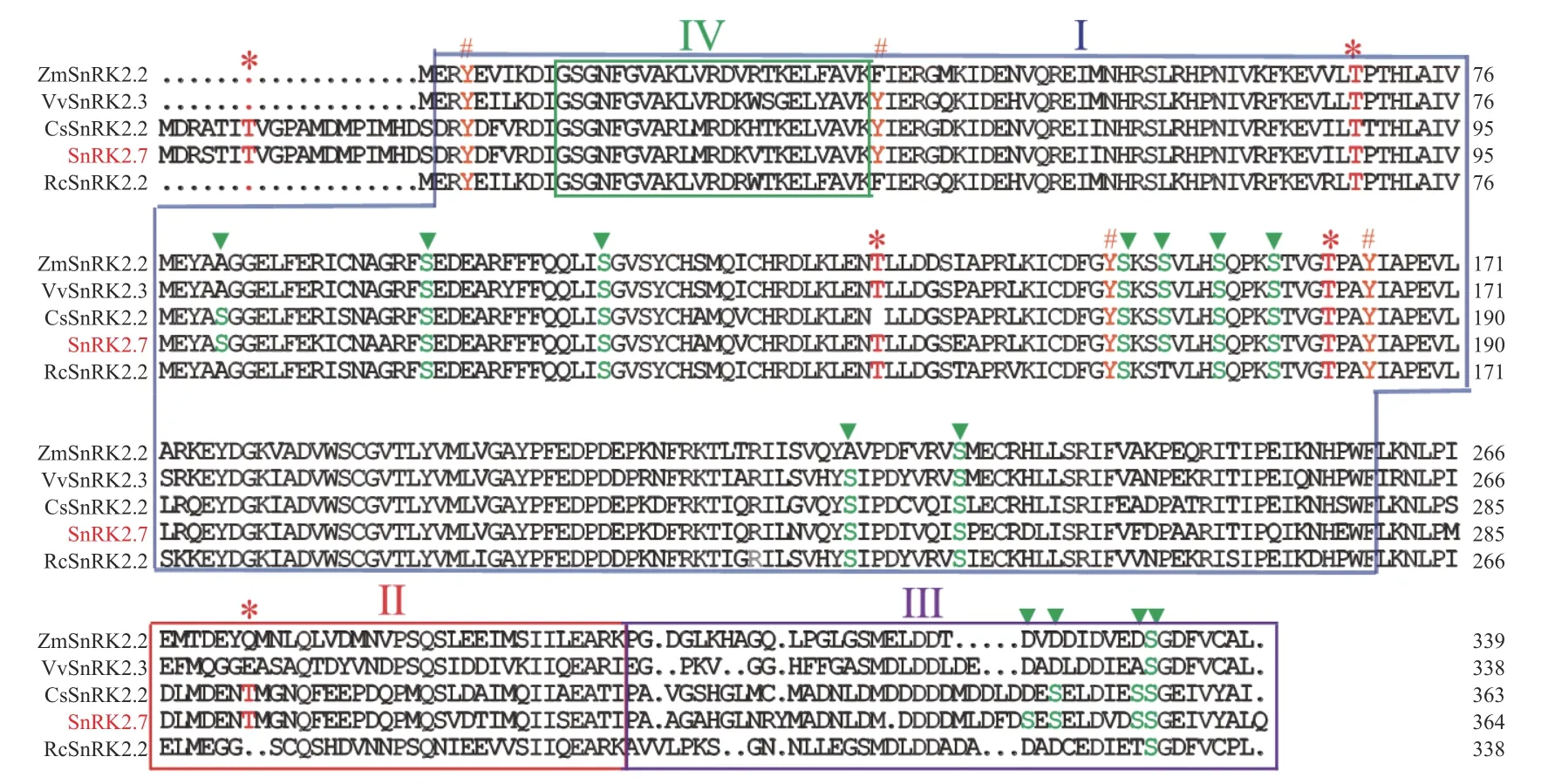
图2 橡胶树HbSnRK2.7 蛋白与其他植物的SnRK2 蛋白结构及其磷酸化位点
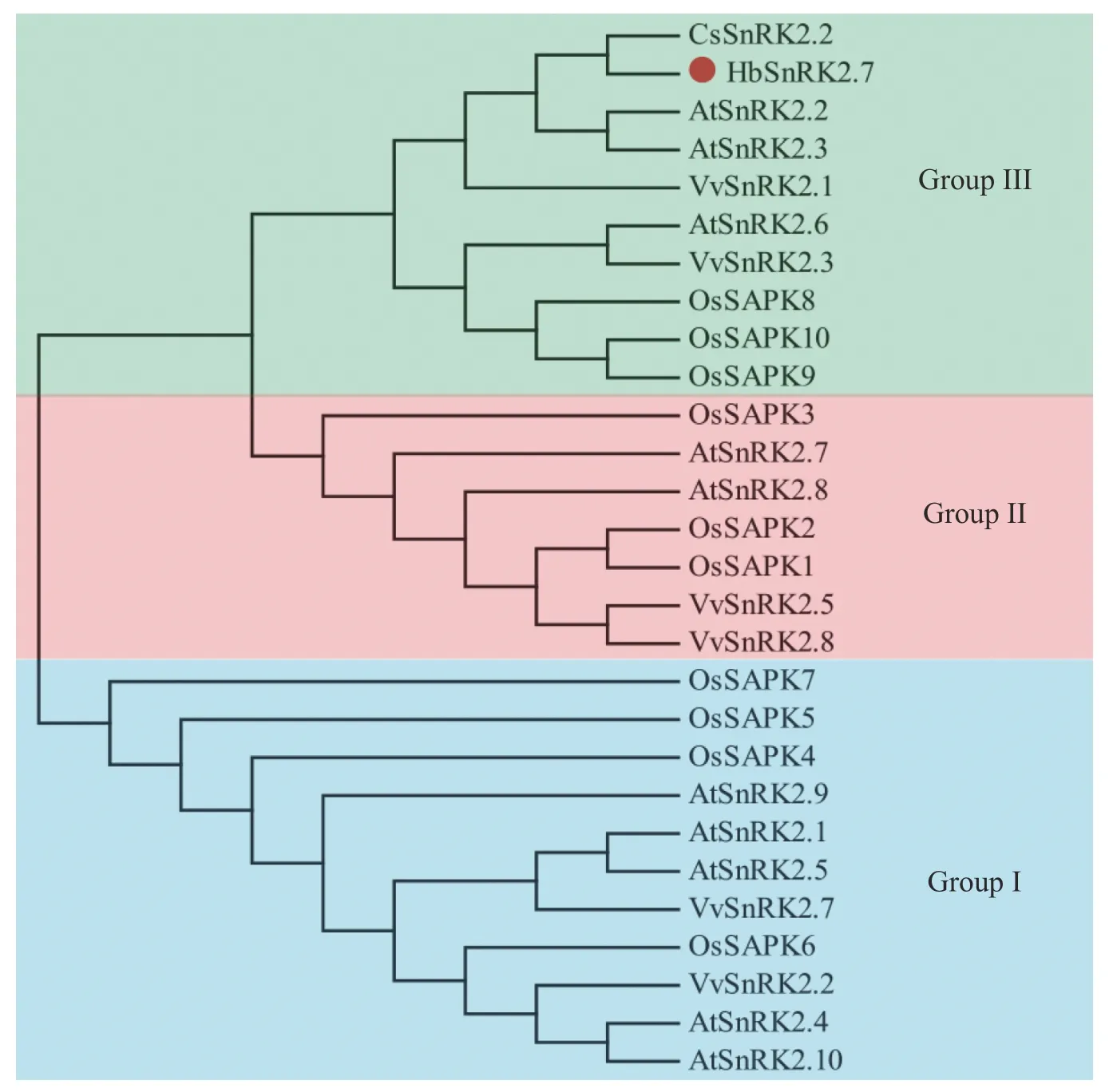
图3 橡胶树HbSnRK2.7 蛋白与其他植物的SnRK2 蛋白的系统进化树分析
2.2 外施ABA 和低温胁迫对橡胶树HbSnRK2.7基因表达的影响ABA 处理下,抗寒橡胶树‘93-114’树皮中的HbSnRK2.7基因呈下调表达趋势。在ABA 处理2 h 时,HbSnRK2.7的表达量稍微变动,没有显著差异。处理4 h 时,HbSnRK2.7已极显著下调表达,在处理8 h 时,表达量下调到最低点。在处理12 h 和24 h 时,HbSnRK2.7表达量稍微上调且趋于稳定,但是其表达量仍显著低于ABA处理0 h 时的表达量。低温胁迫下,HbSnRK2.7基因在橡胶树‘93-114’中的表达呈下调趋势。在低温胁迫2 h 时,HbSnRK2.7的表达量极显著降低。低温胁迫4 h 和8 h 时,HbSnRK2.7继续下调表达,在低温胁迫12 h 时,表达量上调,但极显著低于低温胁迫0 h 的表达量。低温胁迫24 h 时,HbSnRK2.7表达量下调到最低,是低温胁迫0 h 的表达量的1/2(图4)。
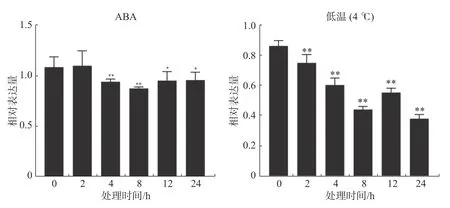
图4 ABA 和低温胁迫对橡胶树HbSnRK2.7 基因表达的影响
2.3 橡胶树HbSnRK2.7基因在抗寒种质和不抗寒种质中的表达分析橡胶树HbSnRK2.7在不抗寒种质‘热垦515’中的本底表达最高,在抗寒种质‘桂研73-165’中的本底表达最低。在不抗寒种质‘PB235’、‘热垦514’、‘热垦515’、‘海垦1’和‘热垦501’中的整体表达量显著高于抗寒种质‘桂研73-165’、‘GT1’、‘INA873’、‘湛试32-713’和‘93-114’中的表达量(图5)。
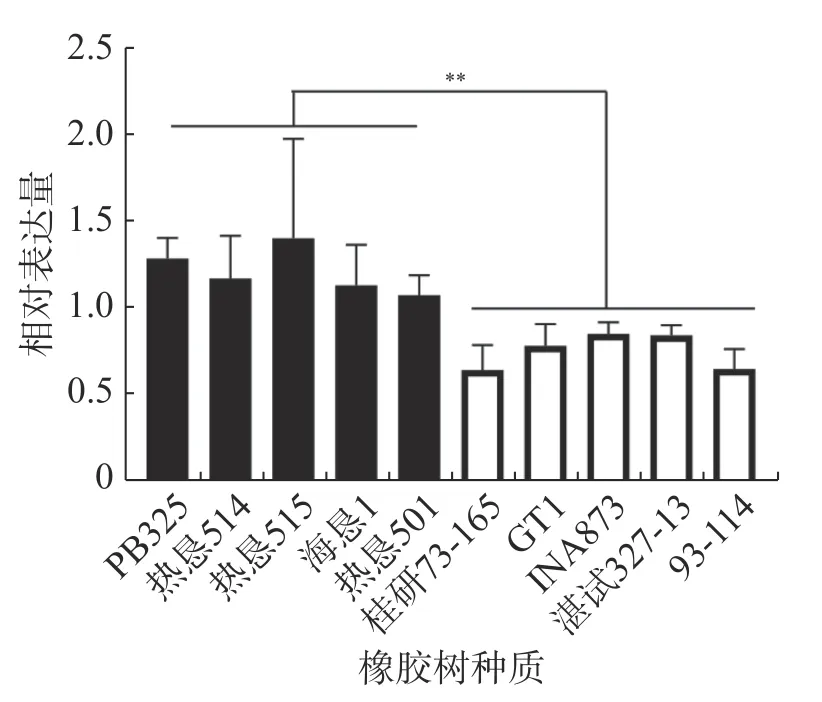
图5 橡胶树HbSnRK2.7 在不同抗寒种质中的表达
3 讨 论
本研究利用RT-PCR 技术从橡胶树‘93-114’中分离鉴定了丝氨酸/苏氨酸蛋白激酶HbSnRK2.7基因,橡胶树HbSnRK2.7基因与草本植物拟南芥AtSnRK2.2、AtSnRK2.3、黄瓜CsSnRK2.2、木本植物葡萄VvSnRK2.3的同源性较高,核苷酸序列的一致性在73%以上,氨基酸序列的一致性在65%以上。它们具有共同的保守丝氨酸/苏氨酸蛋白激酶催化结构域[22-24],同源性比较高,该结构域是SnRK2 蛋白磷酸化功能的核心催化中心,其中包含ATP 结合结构域,可催化磷酸基从ATP 转移到蛋白质底物上的丝氨酸/苏氨酸残基上,使底物磷酸化[25]。SnRK2s 参与了植物对非生物胁迫和脱落酸(ABA)依赖的植物发育的响应。SnRK2 亚家族分为3 个组:组Ⅰ中的蛋白激酶是不被ABA 激活的;组Ⅱ中的蛋白激酶不被ABA 激活或被ABA 微弱激活,取决于植物种类;组Ⅲ中的蛋白激酶强烈响应ABA 诱导[22]。HbSnRK2.7属于丝氨酸/苏氨酸蛋白激酶家族的SnRK2 亚家族的组Ⅲ成员,具有ABA 激活所需结构域,推测HbSnRK2.7能够响应ABA 的刺激反应。另外,HbSnRK2.7还具有响应非生物胁迫所需的结构域,推测HbSnRK2.7能够响应非生物胁迫反应。磷酸化位点主要集中在HbSnRK2.7的丝氨酸/苏氨酸蛋白激酶催化结构域,磷酸化/去磷酸化调控了HbSnRK2.7对底物的磷酸化活性。
植物在遭受干旱、低温、高盐等环境胁迫时,其内源激素ABA 迅速合成和积累,在植物应对环境胁迫中起着重要作用[1-2]。SnRK2s 蛋白激酶是ABA 信号途径的关键环节,介导依赖ABA 的非生物胁迫反应[26-27]。拟南芥AtSnRK2.2、AtSnRK2.3响应ABA 刺激反应,呈下调表达趋势[28-30]。HbSnRK2.7与黄瓜CsSnRK2.2核苷酸序列的同源性为80.87%,CsSnRK2.2响应ABA 诱导下调表达[23]。HbSnRK2.7与葡萄VvSnRK2.1核苷酸序列的同源性为75.08%,VvSnRK2.1同样响应ABA 诱导下调表达[31]。HbSnRK2.7与拟南芥AtSnRK2.2、AtSnRK2.3、黄瓜CsSnRK2.2、葡萄VvSnRK2.1的表达模式一致,受ABA 诱导下调表达。推测HbSnRK2.7 可能在ABA 信号转导途径中起着负调控的作用。然而与HbSnRK2.7同属于亚家族Ⅲ的水稻SAPK8、SAPK9和SAPK10受ABA 诱导上调表达[32],暗示即使同一亚家族的成员,在不同的物种对于ABA 刺激的响应也存在差异。
SnRK2s 是ABA 信号途径的重要环节,参与植物低温胁迫反应[33]。拟南芥AtSnRK2.6受低温胁迫上调表达,激活的AtSnRK2.6 磷酸化ICEs,干扰了E3 连接酶HOS1 与ICEs 的互作,从而抑制了ICEs 经26S 蛋白酶体的降解,增强其稳定性和转录活性,提高植物的抗寒性[16]。橡胶树HbSnRK2.6A/B/C 受ABA 和低温诱导上调表达,且通过调控抗寒关键因子HbICE2 的转录活性,参与ABA 调控橡胶树响应低温胁迫[34]。本研究克隆的橡胶树HbSnRK2.7对ABA 处理和低温胁迫的响应与HbSnRK2.6s相反,该基因既在ABA 处理下显著下调表达,又受低温胁迫显著下调表达,而且在不抗寒种质中的表达量显著高于抗寒种质,表明橡胶树HbSnRK2.7可能作为负调控因子,介导ABA 依赖的橡胶树低温胁迫抗性的形成。与HbSnRK2.7同源性比较高的玉米ZmSnRK2.2[35]、葡萄VvSnRK2.1、VvSnRK2.3[36]在低温胁迫下呈下调表达模式。鹅掌楸(Liriodendron chinense)SnRK2 家族2 个成员(Lchi00543和Lchi01348)受ABA 和低温诱导同样下调表达[37]。HbSnRK2.7类似的基因都是对应物种SnRK2 家族的极少数成员,与其他受ABA 和低温正向调控的多数成员不同[38]。因此,这些基因可能作为负调控因子在植物响应低温胁迫中起着特殊的作用。
