香蕉枯萎病菌候选效应蛋白FoSSP20 的鉴定和功能初探
2024-01-23符俐盈张玉芳陈代朋
王 田,符俐盈,赵 阳,刘 爽,张玉芳,陈代朋,郑 丽
(海南大学 植物保护学院/热带农林生物灾害绿色防控教育部重点实验室,海口 570228)
香蕉(Musaspp.)在亚非拉等不发达地区不仅是主要食物来源,而且是重要的经济支柱[1]。据联合国粮农组织统计,我国香蕉产量占全球总产量的10%左右,仅次于印度[2]。由香蕉枯萎病菌(Fusariumoxysporumf. sp.cubense,Foc)引起的香蕉枯萎病是一种严重危害香蕉生产的土传病害。根据Foc菌株对宿主的毒力差异,Foc可分为4 个生理小种,Focrace1、Focrace2、Focrace3 和Focrace4(Foc1,Foc2,Foc3andFoc4),其中Foc4可细分为FocTR4(tropical race 4)和FocSTR4(subtropical race 4)[3]。Foc1能侵染大多数三倍体香蕉(Musaspp., AAA 和Musaspp., AAB),如栽培品种“Gros Michel”等[4]。20 世纪50 年代,由Foc1引起的香蕉枯萎病大面积爆发,使“Cros Michel”香蕉(Musaspp., AAA)大量死亡,种植园绝收,对当时的香蕉产业造成了毁灭性的打击[5]。“Cavendish”香蕉开始替代“Cros Michel”香蕉,贡献了50%全球产量和99%的出口市场,而毒性更强的FocTR4 能侵染“Cavendish”香蕉和大多数重要的栽培品种,并在世界各地广泛传播,对现在的香蕉产业造成严重破坏[6]。
在植物与病原菌长期的协同进化过程中,植物建立起了能有效抵御病原微生物的先天免疫系统(innate immune system),当植物遭受病原菌侵染时,免疫系统能特异识别信号分子从而激活植物自身免疫应答[7]。先天免疫系统包括2 个不同的层面。第1 层免疫系统是由位于植物细胞表面的模式识别受体(pattern recognition receptors, PRRs)识别并结合病原微生物的病原或微生物相关分子模式(pathogen or microbial-associated molecular patterns, PAMPs or MAMPs)诱导的免疫反应,称为PTI(PAMP-triggered immunity)[8 - 9]。第二层免疫系统中,一些病原微生物分泌的效应蛋白直接或间接被植物中的抗病(resistance, R)蛋白识别,如核苷酸结合富亮氨酸重复序列(nucleotidebinding leucine-rich repeat, NLR)蛋白,随后诱导的免疫反应,称为ETI(effector-triggered immunity)[10]。在免疫反应中,ETI 相比PTI 免疫反应更剧烈,通常会导致植物局部细胞死亡,称为过敏性坏死反应(hypersensitive response, HR)[11]。病原微生物为了更好地侵染寄主植物会分泌效应蛋白干扰PTI[12]。研究结果表明,香蕉中过表达细胞凋亡基因或PCD 相关基因可以提高香蕉对Foc的抗病性,说明香蕉细胞HR 反应也是香蕉抗枯萎病的重要抗病机制[13 - 14]。
效应蛋白被证明在Foc的侵染过程中发挥作用。Foc的全基因组测序已经完成,利用基因组测序技术和生物信息学分析在FocTR4 中预测了大量的候选效应蛋白[15-16]。然而,许多候选效应蛋白的毒力功能并不清楚。因此,Foc中的候选效应蛋白的鉴定和毒力分析对于研究Foc的致病机制和其与宿主间相互作用至关重要。
烟草瞬时表达系统被广泛应用于鉴定各种病原菌候选效应蛋白的功能[17]。BAX 蛋白是Bcl-2 蛋白家族中的一种能诱导细胞坏死的蛋白,将其构建在烟草花叶病毒载体(tobacco mosaic virus vector)中在本氏烟(Nicotiana benthamiana)中瞬时表达时,可以作为阳性对照诱导本氏烟叶片的细胞程序性死亡(programmed cell death,PCD)[18-19]。苹果炭疽菌(Colletotrichum fructicola)中的候选效应蛋白CfEC92 被验证可以抑制由BAX 诱导的PCD[20]。激发子INF1 是一种毒力因子,可以诱导本氏烟叶片的过敏性坏死(hypersensitive response,HR)反应[21]。另外,17 种葡萄霜霉菌(Plasmopara viticola)PvRXLR 候选效应蛋白可以完全抑制由BAX 和INF1 诱导的PCD,并且PvRXLR159 在本氏烟中的瞬时表达可以抑制本氏烟对葡萄霜霉菌的抗性[22-23]。本研究从课题组前期在Foc4基因组中筛选出的80 个候选效应蛋白(FoSSP1-FoSSP80)中选取FoSSP20 为研究对象,通过生物信息学分析其结构,并通过信号肽分泌实验、亚细胞定位实验、烟草瞬时表达实验和qRT-PCR 初步分析其功能,以鉴定FoSSP20 的毒力功能,从而为研究FoSSP20 在Foc4与香蕉的相互作用中的分子机制奠定理论基础。
1 材料与方法
1.1 供试菌株和植物真菌菌株:尖孢镰刀菌古巴专化型4 号生理小种(Fusarium oxysporumf. sp.cubenserace 4,Foc4);根瘤农杆菌(Agrobacterium tumefaciens)菌株GV3101;大肠杆菌(Escherichia coli)菌株DH5α;酵母(Saccharomyces cerevisiae)菌株YTK12。以上菌株由海南大学植物保护学院真菌病毒与植物免疫实验室保存并提供,感受态购自Takara 生物公司.
本试验接种香蕉品种为巴西蕉(MusaAAACavendishvar.Brazilian),购自海南热作两院种业科技有限公司。本氏烟(Nicotiana benthamiana)由海南大学植物保护学院真菌病毒与植物免疫实验室保存。
1.2 试验试剂DNA 聚合酶:TaKaRaTaqTM(Takara Biotech); 2×TaqPCR Mix(TianGen Biotech);Phusion High-Fidelity DNA Polymerase(Thermo Fisher Scientific); Phanta Max Super-Fidelity DNA Polymerase(Vazyme Biotech); 2 ×KeyPo Master Mix(Vazyme Biotech);2 × Phanta Max Master Mix(Vazyme Biotech)。限制性内切酶:Restriction Endonucleases(New England Biolabs,NEB)。试剂盒:Cycle Pure Kit 纯化试剂盒与 Gel Extraction Kit 纯化试剂盒(Omega Biotech);Hi-DNAsecure Plant Kit 高效植物基因组DNA 提取试剂盒(TianGen Biotech);Eastep R Super Total RNA Extraction Kit 总RNA 提取试剂盒(Promega Biotech); RevertAid First Stand cDNA Synthesis Kit 反转录试剂盒(Thermo Fisher Scientific);SuperReal PreMix Plus 荧光定量试剂盒(TianGen Biotech); ClonExpress Ⅱ One Step Cloning Kit(Vazyme Biotech);经典酵母转化试剂盒(Coolaber Biotech);12.5% SDS-PAGE 变性丙烯酰胺彩色凝胶快速制备试剂盒(Sangon Biotech)。PDA/PDB、LB/LBA、YPDA、CMD-W 以及YPRAA培养基均参考常规方法配制。
1.3 试验引物本研究所用引物均由生工生物工程(上海)股份有限公司合成,引物序列见表1。

表1 本研究所用引物
1.4 菌株及植物培养WT-Foc4在PDA 或PDB培养基中28 ℃恒温黑暗培养。DH5a 和GV3101分别于37 ℃和28 ℃的条件下在LB 培养基中恒温黑暗培养。YTK12 在YPDA 培养基中30 ℃恒温暗培养。本氏烟在培养箱中24 ℃昼夜(16 h/8 h)交替培养。选取5~6 片叶的巴西蕉苗在(28±2) ℃的温室中昼夜交替培养。
1.5 生物信息学分析FoSSP20(FOIG_10940;Genomic Sequence: NW_022158703.1)的序列信息从NCBI 数据库下载。将FoSSP20 的氨基酸序列通过BlastP 在线比对NCBI NR 和Ensemble Fungi数据库获得同源蛋白的序列。利用MEGA11软件采用最大似然法构建系统发育树[24]。利用Clustal W 软件进行氨基酸序列比对,GeneDoc 软件对结果进行分析[25]。利用在线软件SignalP 5.0(https://services.healthtech.dtu.dk/service.php?Sig nalP-5.0)和TMHMM 2.0 (https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)对FoSSP20 的氨基酸序列进行分析[26 - 27]。
1.6 酵母表达载体构建pSUC2、pSUC2-Avr1b和pSUC2-Mg87载体由笔者所在实验室保存。将pSUC2 载体用EcoRI 和XhoI 限制性内切酶酶切,用Cycle Pure Kit 纯化试剂盒纯化回收。用FoSSP20SP-F/FoSSP20SP-R 引物KeyPo Master Mix聚合酶扩增FoSSP20 的信号肽全长,Gel Extraction Kit 纯化试剂盒纯化回收。用ClonExpress ⅡOne Step Cloning Kit 将纯化后的SP 片段克隆到pSUC2 载体中得到pSUC2-FoSSP20SP酵母分泌载体。操作方法和反应体系均参考产品使用说明书。所有载体均通过PCR 检测和上海生工测序验证其准确性。
1.7 植物表达载体构建用Eastep R Super total RNA Extraction Kit 总RNA 提取试剂盒(Promega Biotech)提取Foc4的总RNA。用RevertAid First Stand cDNA Synthesis Kit 反转录试剂盒(Thermo Fisher Scientific)将总RNA 反转录为cDNA。将pGR107-GFP载体用ClaⅠ限制性内切酶酶切,用Cycle Pure Kit 纯化试剂盒纯化回收。以Foc4的cDNA 为模板,用pGR107-GFP-FoSSP20-F、 pGR107-GFP-FoSSP20ΔSP-F 分别与 pGR107-GFP-FoSSP20-R 引物扩增FoSSP20 全长、FoSSP-20ΔSP片段。用ClonExpress Ⅱ One Step Cloning Kit 将纯化后的片段分别克隆到pGR107-GFP载体中得到pGR107-FoSSP20-GFP、 pGR107-Fo-SSP20ΔSP-GFP植物表达载体。将pBin-eGFP载体用KpnⅠ限制性内切酶酶切,用Cycle Pure Kit 纯化试剂盒纯化回收。用pBin-FoSSP20-F、pBin-FoSSP20ΔSP-F 分别与pBin-FoSSP20-R 引物扩增FoSSP20 全长、FoSSP20ΔSP片段。用ClonExpress ⅡOne Step Cloning Kit 将纯化后的片段分别克隆到pBin-eGFP载体中得到 pBin-FoSSP20-eGFP、pBin-FoSSP20ΔSP-eGFP植物表达载体。pGR107-GFP、pBin-eGFP载体由笔者所在实验室保存并提供。用Phanta Max Super- Fidelity DNA 聚合酶扩增目的基因。操作方法和反应体系均参考产品使用说明书。所有载体均通过PCR 检测和上海生工测序验证其准确性。
1.8 酵母分泌实验用酵母分泌系统对FoSSP-20 的信号肽功能进行验证[28]。将YTK12 菌株接种在YPDA 平板上划线培养,挑取单菌落接种到YPDA 液体培养基中30 ℃培养过夜。取适当菌液接种于新的YPDA 液体培养基中培养至OD600=0.4~0.5。将菌液3 000 r·min-1离心5 min 去除上清,并用灭菌的ddH2O 重新悬浮后用3 000 r·min-1离心5 min 去上清。将菌体用1.5 mL 1 mol·L-1LiAc 重新悬浮后用3 000 r·min-1离心5 min 去上清,最后用1 mL 1 mol·L -1 LiAc 悬浮得到YTK12 感受态。将pSUC2、pSUC2-Avr1b、pSUC2-Mg87和pSUC2-FoSSP20SP载体用经典酵母转化试剂盒进行转化得到含有相应载体的酵母菌株,操作步骤参考使用说明书。将含有不同载体的酵母菌株分别接种在CMD-W 和YPRAA 培养基的平板上,以验证YTK12 是否含有转化酶的活性。转化酶可将TTC(2,3,5-Triphenyltetrazolium Chloride)还原为TPF(1,3,5-Triphenylformazan)形成不可溶性红色沉淀,可以进一步验证信号肽的功能。含有pSUC2-Avr1b、pSUC2-Mg87和pSUC2的YTK12分别作为阳性对照、阴性对照和空白对照,实验设3 个生物学重复和3 个机械重复。
1.9 农杆菌介导的烟草的瞬时表达将构建好的植物表达载体通过电击法转入农杆菌GV3101 的感受态中。在含有50 μg·mg-1卡那霉素(kanamycin)和25 μg·mg-1利福平(rifampicnic)的LB 培养基中28 ℃振荡培养。反复离心(5000 r·min-1,5 min)悬浮菌液,待培养基洗净后用接种缓冲液重新悬浮,并将OD600调至0.6,室温静止2 h 后用注射器将菌液接种在4~6 周的本氏烟叶片背部。实验设3 个生物学重复和3 个机械重复,pGR107-BAX和pGR107-GFP分别作为阳性对照和阴性对照,注射后5 d 用UV 灯观察并拍照记录。注射缓冲液配方:10 mmol·L-1MgCl2、5 mmol·L-1MES(pH 5.6)和150 μmol·L-1AS(acetosyringone)。
1.10 共聚焦显微镜观察利用共聚焦显微镜对FoSSP20 的亚细胞定位进行测定,在5 周大的本氏烟中分别注射含有pBin-eGFP、pBin-FoSSP20-eGFP、pBin-FoSSP20ΔSP-eGFP的农杆菌,OD600=0.01。在注射后36 h 利用激光共聚焦显微镜(Olympus microscope TH4-200, Tokyo, Japan)观察融合蛋白的绿色荧光并拍照记录,激发波长为488 nm,接受波长为505~530 nm。
1.11 FoSSP20 的亚细胞定位(western blot)收集本氏烟叶片样品,液氮速冻,用研磨仪研磨后加入植物总蛋白裂解缓冲液(Sangon Biotech),按说明书操作提取本氏烟叶片的总蛋白。将与蛋白loading buffer 混合的蛋白样品煮沸5 min 后加入用12.5% SDS-PAGE 变性丙烯酰胺彩色凝胶快速制备试剂盒制备12.5% SDS-PAGE 蛋白胶中,电泳完成后用转膜仪转移到0.22 μm 的PVDF 膜中。用一抗Rabbit anti-GFP pAb 和二抗HRP Goat anti-rabbit IgG (Abclonal, Biotech)对蛋白进行杂交,用ECL 检测试剂盒(KeyGEN Biotech)进行检测。操作步骤参考使用说明书。
1.12 FoSSP20 的表达模式用PDB 培养基振荡培养Foc45 d,过滤菌丝得到孢子悬浮液,将孢子悬浮液调到1 × 107个·mL-1。选取长势良好根系发达的水培香蕉,对根系进行伤根处理后浸泡于Foc4的孢子悬浮液中2 h,清洗根部后重新移栽到花盆中,在温室中进行培养。收集Foc4接种后12、24、48 和72 h 的香蕉苗根部和Foc4 的菌丝和分生孢子,用Eastep R Super total RNA Extraction Kit 总RNA 提取试剂盒(Promega Biotech)提取所有样品的总RNA。用RevertAid First Stand cDNA Synthesis Kit 反转录试剂盒(Thermo Fisher Scientific)将总RNA 反转录为cDNA。香蕉的Actin 基因作为内参,使用QuantStudioTM5 Real-Time PCR 仪器(Thermo Fisher Scientific)和Super-Real PreMix Plus 荧光定量试剂盒(TianGen Biotech)进行qRT-PCR 检测,利用QuantStudioTMDesign&Analysis Software v1.5.2 软件对基因表达量进行分析。操作方法参考使用说明书。
2 结果与分析
2.1 FoSSP20 蛋白结构分析FoSSP20(FOIG_10940)基因全长1 086 bp,编码1 个含82 个氨基酸的假定蛋白,序列登录号:NW_022158705.1。生物信息学软件预测FoSSP20 的N 端含有1 个19 个氨基酸的信号肽(Signal peptide, SP),无跨膜结构域。将FoSSP20 的氨基酸序列通过BlastP对NCBI 和Ensemble Fungi 数据库进行比对。分析结果发现FoSSP20 在其他镰刀菌属(Fusarium)的真菌中比对出大量同源蛋白(图1-a),这些蛋白的氨基酸序列具有高度相似性(图1-b)。
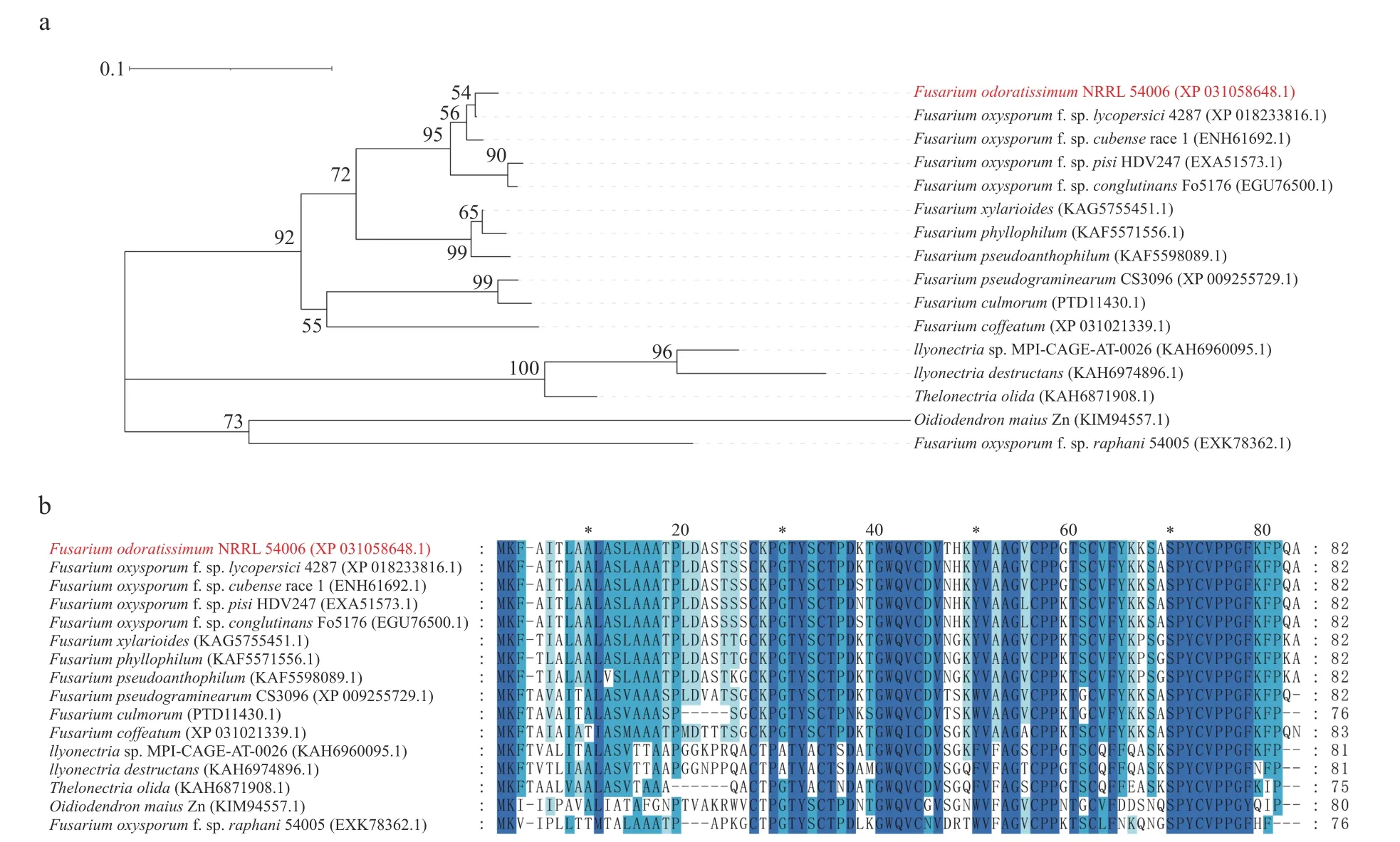
图1 FoSSP20 及其同源物的系统发育树和氨基酸比对
2.2 FoSSP20 信号肽功能验证生物信息学分析表明,FoSSP20 可能是N 端具有SP 的经典分泌蛋白。为了验证其SP 具有分泌活性,我们利用酵母分泌系统来验证FoSSP20 的SP 功能。FoSSP20的SP 全长含有19 个氨基酸,我们将SP 的全长克隆到pSUC2 载体中,得到信号肽分泌载体pSUC2-FoSSP20SP,并将pSUC2-FoSSP20SP转入酿酒酵母(Saccharomyces cerevisiae)YTK12 中,Mg87 作为阴性对照为含有稻瘟菌(Magnaporthe oryzae)Mg87 蛋白的SP 的pSUC2 载体的YTK12;Avr1b作为阳性对照为含有大豆疫霉菌(Phytophthora sojae)Avr1b 蛋白的SP 的pSUC2 载体的YTK12。实验结果表明,FoSSP20 的SP 可以使YTK12 分泌转化酶使得酵母菌株在YPRAA 平板上生长,并可以将TTC(2,3,5-Triphenyltetrazolium Chloride)还原为TPF(1,3,5-Triphenylformazan)形成不可溶解的红色沉淀(图2)。综上所述,FoSSP20 是一种经典分泌蛋白,其SP 具有分泌功能。

图2 通过酵母分泌系统验证FoSSP20 的分泌功能
2.3 FoSSP20 的亚细胞定位为了验证FoSSP20在植物细胞内的定位,对FoSSP20 进行亚细胞定位实验。将FoSSP20 和FoSSP20ΔSP克隆到pBineGFP 植物表达载体中,成功构建pBin-FoSSP20-eGFP 和pBin-FoSSP20ΔSP-eGFP 绿色荧光表达载体并将其转入农杆菌中,并将携带载体的农杆菌注射到烟草叶片中(GFP 作为对照)。注射2 d 后,用激光共聚焦显微镜观察eGFP 融合蛋白的定位情况,结果表明FoSSP20:eGFP 和 FoSSP20ΔSP:eGFP 均定位于烟草细胞的细胞核和质膜上(图3-a)。为了验证烟草叶片中蛋白的表达情况,提取了叶片的总蛋白,利用Western blot 免疫杂交检测到FoSSP20: eGFP 、 FoSSP20ΔSP: eGFP 蛋白的表达(图3-b)。

图3 FoSSP20 和FoSSP20ΔSP 的亚细胞定位
2.4 FoSSP20 抑制BAX 在本氏烟草叶片上诱导的细胞坏死利用烟草瞬时表达系统对FoSSP20 的功能进行验证,由于FoSSP20 为经典分泌蛋白,其SP 具有分泌活性,进一步验证SP 的缺失是否会影响FoSSP20 的细胞死亡抑制活性。扩增FoSSP20 的全长和缺失SP 的FoSSP20 (FoSSP20ΔSP),将2 个片段分别克隆到pGR107-GFP载体中,并成功转入根瘤农杆菌中。利用烟草瞬时表达系统,分别在本氏烟中瞬时表达FoSSP20 和FoSSP20ΔSP的GFP 融合蛋白(OD600= 0.6),并在24 h 后在相同位置注射含有pGR107-BAX的农杆菌。注射5 d 后,BAX、BAX 与GFP共注射部位开始出现细胞坏死,而FoSSP20、FoSSP20ΔSP与BAX 共注射部位没有出现细胞坏死,当用UV 灯照射叶片时,坏死部位产生黑色病斑,而未坏死部位出现绿色荧光(图4-a)。为了验证烟草叶片中蛋白的表达情况,提取了叶片的总蛋白,利用Western blot 免疫杂交对GFP 融合蛋白进行检测,杂交结果表明共注射不影响蛋白的表达(图4-b)。实验结果表明, FoSSP20 和FoSSP20ΔSP都可以完全抑制BAX 诱导的PCD。

图4 FoSSP20 和FoSSP 在烟草中瞬时表达
2.5 FoSSP20基因表达模式为了确定FoSSP-20基因在Foc4侵染时的表达变化,通过qRTPCR 检测FoSSP20的表达模式。以Foc4的分生孢子(conidia, CON)作为侵染后0 h 的样本,以FoSSP20在Foc4 的分生孢子时期的表达量作为对照。与CON 样品相比,Foc4 的菌丝(hyphae,HYP)样品中FoSSP20 基因表达无显著差异,而FoSSP20基因在侵染后12 h 表达量开始出现显著差异,在侵染后24 h 达到峰值(25.8 倍)(图5)。随后FoSSP20 的表达量开始逐渐降低。qRT-PCR 结果表明,候选效应蛋白FoSSP20 可能在病原菌的侵染阶段发挥作用。

图5 不同侵染时间的香蕉根部候选效应蛋白FoSSP20 的基因表达量
3 讨 论
目前对镰刀菌(Fusarium oxysporum,Fo)效应蛋白研究较少,研究主要集中在一类会分泌进入寄主植物的木质部中发挥作用帮助病原菌侵染的效应蛋白中,这一类效应蛋白称之为SIX(secretedin-xylem)蛋白。 在番茄枯萎病菌(Fusarium oxysporumf. sp.lycopersici,Fol)中共鉴定出14 个SIX 蛋白(SIX1~SIX14)。在所有SIX 蛋白中,SIX1 是番茄(Lycopersicon esculentum)中I-3 介导的抗性所必需的,因此也被称为Avr3,并且FocTR4 中SIX1同源基因的缺失会导致FocTR4 对香蕉致病力降低[29-30]。SIX3 蛋白也作为一种无毒基因(Avr2)能被植物的I-2 介导的抗性识别[31]。FocSge1基因可以调控Foc4中效应蛋白基因的表达,而SIX8 被证明对Foc TR4 的毒力有贡献[32]。除了已被研究的SIX 蛋白外,Foc4中还有很多其他类型的效应蛋白仍功能未知未被报道。FocM35_1 是一种金属蛋白酶类效应蛋白有助于FocTR4 毒性在病原菌侵染早期表达量上调[16]。FoSSP1 是本课题组前期研究的一个候选效应蛋白,能激发植物免疫并负调控Foc4的侵染[33]。分泌蛋白根据其分泌途径的不同可以分为经典分泌蛋白和非经典分泌蛋白。其中,经典分泌蛋白依靠N 端的信号肽引导蛋白合成分泌[34],而非经典分泌蛋白通过胞吞胞吐或其他方式分泌到细胞外,是病原菌对分泌途径进行有益的补充和替代[35]。在本研究中,鉴定了一种非SIX 蛋白的新蛋白FoSSP20,该蛋白的信号肽具有分泌功能,但信号肽的有无不影响该蛋白抑制BAX 诱导本氏烟的PCD。通过亚细胞定位实验,发现FoSSP20定位于植物细胞的细胞核和细胞膜中,并且该蛋白在Foc4侵染过程中表达量显著上调。这些结果都表明FoSSP20 可能作为Foc4的一个新的毒力因子在侵染过程中发挥作用。
通过对数据库中的序列进行比对,筛选FoSSP20 的同源蛋白并构建系统发育树。分析结果表明FoSSP20 在整个镰刀菌属中保守,并且不同物种之间FoSSP20 的同源物的序列存在差异。因此,猜测FoSSP20 蛋白及其同源物可能与Fo的进化相关。在后续的研究中,将会克隆不同种的FoSSP20 蛋白的同源蛋白,构建烟草瞬时表达载体,将FoSSP20 的同源蛋白在烟草中进行瞬时表达,验证其功能与FoSSP20 的异同。在亚细胞定位实验中,发现SP 的缺失对FoSSP20 的定位没有影响,可能是由于真菌的SP 不能在植物中发挥作用,后续会进一步构建含植物信号肽的FoSSP-20 表达载体对该蛋白的定位。此外,全长的FoSSP20 荧光强度明显弱于FoSSP20ΔSP,也可能是由于FoSSP20 的SP 发挥了功能,导致FoSSP20被分泌至植物细胞外使得荧光强度降低。在未来的研究中,将会对FoSSP20基因进行敲除回补实验,验证FoSSP20 蛋白是否是Foc4毒力所必需的,并且验证其对Foc4生长发育的影响。FoSSP-20 可以抑制本氏烟中由BAX 诱导的PCD,说明该蛋白可能会通过调控植物免疫来帮助Foc4侵染香蕉;验证FoSSP20 是否能抑制本氏烟中活性氧和胼胝质的积累,及其对植物信号通路相关基因的影响,从而明确该蛋白在Foc4调控寄主免疫反应中的作用。
