IVIM-DWI及多层螺旋CT与肝细胞肝癌微血管侵犯的相关性分析*
2024-01-23何崇保
何崇保 庞 勇 唐 煌
江油市中医医院 (四川 绵阳 621700)
原发性肝癌是一种临床最常见的恶性肿瘤,其中肝细胞癌(hepatocellular carcinoma,HCC)是最常见的,是癌症相关死亡的第3大原因[1]。尽管手术切除、射频放射治疗和肝移植等均是治疗HCC有效方法,但仍然具有很高复发率,对患者的预后产生严重影响[2]。根据相关研究显示,肝癌患者肝脏部分切除后的复发率为70%[3]。因此,HCC术后高复发率为临床困扰难题。近年来,国内外多项研究表明,微血管侵犯(microvascular invasion,MVI)发生在HCC血管侵犯早期阶段,是肿瘤侵袭早期转移的标志,也是肝癌复发的重要因素[4]。因此,明确MVI的存在对制定肝细胞癌的治疗方案具有重要意义。现阶段,HCC术前MVI检测的金标准是肝脏穿刺活检,但由于其为一种侵入性检查,患者的接受程度相对较低,且检查结果也有一定的滞后[5]。随着医学影像技术的发展,各种术前微血管影像学检查方法应运而生。体素内不相干运动扩散加权成像(intravoxel incoherent motion diffusion weighted imaging,IVIM-DWI)是一种功能性非增强成像技术,可以相对定量地评价肿瘤弥散和灌注信息,显示肿瘤组织微循环与微结构的改变,已被广泛用于肿瘤微环境评价,尤其被广泛用于评价肝脏恶性病变、转移与监测治疗效果[6]。多层螺旋计算机断层扫描(multisliecs helieal computed tomography,MSCT)在研究中已被临床证明在MVI中存在较高的使用价值[7]。但临床有关两者与HCC患者MVI相关的研究较少,基于此,本研究探讨IVIM-DWI、MSCT与HCC患者MVI的相关性分析,结果如下。
1 资料与方法
1.1 研究资料选取2019年12月至2022年12月本院收治HCC患者100例临床资料开展回顾性分析。
纳入标准:患者均接受根治性切除手术治疗,获取完整病理资料,诊断符合《原发性肝癌诊疗规范》[8]中相关标准,且为单发肿瘤;患者均在术前接受IVIM-DWI、MSCT检查,且两项检查间隔不高于3d;临床资料完整;无肝内转移与远处转移;未发现大血管癌栓。排除标准:重要脏器功能严重不全者;既往其他肿瘤相关手术治疗史;既往射线治疗史;其他恶性肿瘤史;腹腔存在大量积液者。100例患者经手术病理确诊为MVI阳性38例,MVI阴性62例。本项研究方案已取得院伦理委员会审查批准。
1.2 方法资料收集:通过患者电子档案号从病例子系统中收集相关资料,包括年龄、性别、肿瘤分化程度。
相关检查:(1)IVIM-DWI检查:检查前保持空腹8~12h,使用腹部配备有8通道相控阵线圈的MRI设备(GE Discovery 750 3.0T)进行呼吸触发扫描,扫描范围从膈肌上方约2cm至肾脏下方,患者仰卧位,足先进。扫描序列包括呼吸门控冠状T2WI(67.2ms的TE、2800ms的TR、5mm层厚、1mm层间距、38×34.2mm2的FOV、288×288的矩阵、1次奖励次数)、呼吸门控横向脂质抑制T2WI(73.8ms的TE、3750ms的TR、5mm层厚、1mm层间距、36×36mm2的FOV、320×320的矩阵、3次奖励次数)、多b值IVIM成像(57.4ms的TE、3636ms的TR、5mm层厚、1mm层间距、36×36mm2的FOV、128×128的矩阵、4次奖励次数)、呼吸门控横断面T1WI(4.9ms的TE、480ms的TR、5mm层厚、1mm层间距、36×36mm2的FOV、320×224的矩阵、1次奖励次数)、和呼吸门控断面T2WI(89.3ms的TE、8571ms的TR、5mm层厚、1mm层间距、36×36mm2的FOV、320×224的矩阵、2次奖励次数),其中多b值IVIM成像通过自由呼吸触发扫描,b值分别为0、10、20、50、....、1 000s/mm2,平均扫描时间为(3.56±6.57)分钟。
图像分析:在GE ADW 4.6工作站上进行图像处理和数据分析。分析工作由两位在放射诊断方面有10年以上经验的医生采用双盲法进行。测量感兴趣的区域在肿瘤的最大水平上包括尽可能多的肿瘤组织,选取其上、下各一层面勾勒病变边界,并分别测量,避免肉眼可见的周围血管和胆管,以及囊性变化、坏死、出血和伪影。(1)定性资料:肿瘤包膜指在延迟期或门脉期图像上观察到的肿瘤边缘的薄环状增强,分为无包膜和有包膜(包括不完全包膜)。肿瘤边缘指在肝胆期观察到的肿瘤边缘的平滑和不平滑。肝胆期瘤周低信号指肝胆期肿瘤周围的肝实质不规则低信号区。动脉周围肿瘤强化指动脉期的多边形或新月形强化,延伸到肿瘤轮廓以外,与肿瘤广泛接触[9]。(2)定量资料:扩散系数(standard,ADC)、灌注分数(perfusion fraction,f)、伪灌注扩散系数(pseudo-diffusion coefficient,D*)、真实扩散系数(true diffusion coefficient,D),每个病变的定量参数由两位医生测量三次,并以两位医生测量的平均值作为最终值。
(2)MSCT检查:检查前保持空腹4~6h,使用64排128层MSCT(Siemens Somaton Sensation)进行扫描。参数设定为120kV电压,200mA电流,0.75mm层厚,1螺距。首先,对整个肝脏进行平扫,然后以1.5mL/kg的剂量从肘部动脉注入300mgl/mL碘海醇,速率约为3mL/s。动脉扫描、门静脉扫描和延迟相扫描分别在30s、60s和120s进行。由两位具有10年以上经验的影像学医生在工作站上观察CT图像,采用双盲法进行,评估肿块大小、肿块边缘的平滑度、包膜和晕征,意见不一则相互讨论后作出诊断。光滑的肿瘤边缘是指肿瘤边缘在各个方向都有平滑的弧度;包膜是指在门脉期和延迟期有环形的、高密的、明确的肿瘤边缘,且包膜包括40%及以上的肿瘤,无包膜的环绕肿瘤面积小于40%;晕征是指在早期门脉期和晚期动脉期有带状或环状强化,在延迟期减退为等密度[10]。肿瘤大小和CT值的测量要避开囊性改变、坏死、出血区域,并取3次测量的平均值。
病理检查诊断HCC存在MVI标准:参照《原发性肝癌规范化病理诊断指南(2015年版)》[11]中相关标准执行病理取材与诊断MVI。MVI是指在标本的大体病理上未能看到血管内癌栓,但在显微镜下病理观察到小静脉(中央静脉或门静脉分支)癌栓。
1.3 观察指标比较两组IVIM-DWI、MSCT定性、定量参数分析的差异;ROC曲线分析IVIM-DWI定量参数、MSCT定量参数及联合数据对HCC存在MVI的诊断价值。
1.4 统计学处理应用SPSS 22.0进行数据分析。计数资料用(n,%)表示,行秩和检验;正态分布的计量资料用(±s)表示,组间比较分别行独立样本t检验,诊断价值评估采用ROC曲线分析;P<0.05为差异具有统计学意义。
2 结 果
2.1 两组IVIM-DWI、MSCT定性分析结果显示,两组在性别、年龄、分化程度比较差异无统计学意义(P>0.05),MVI阳性组边缘毛糙、瘤周低信号、瘤周强化、存在晕征高于MVI阴性组(P<0.05),肿瘤包膜低于MVI阴性组(P<0.05),见表1。
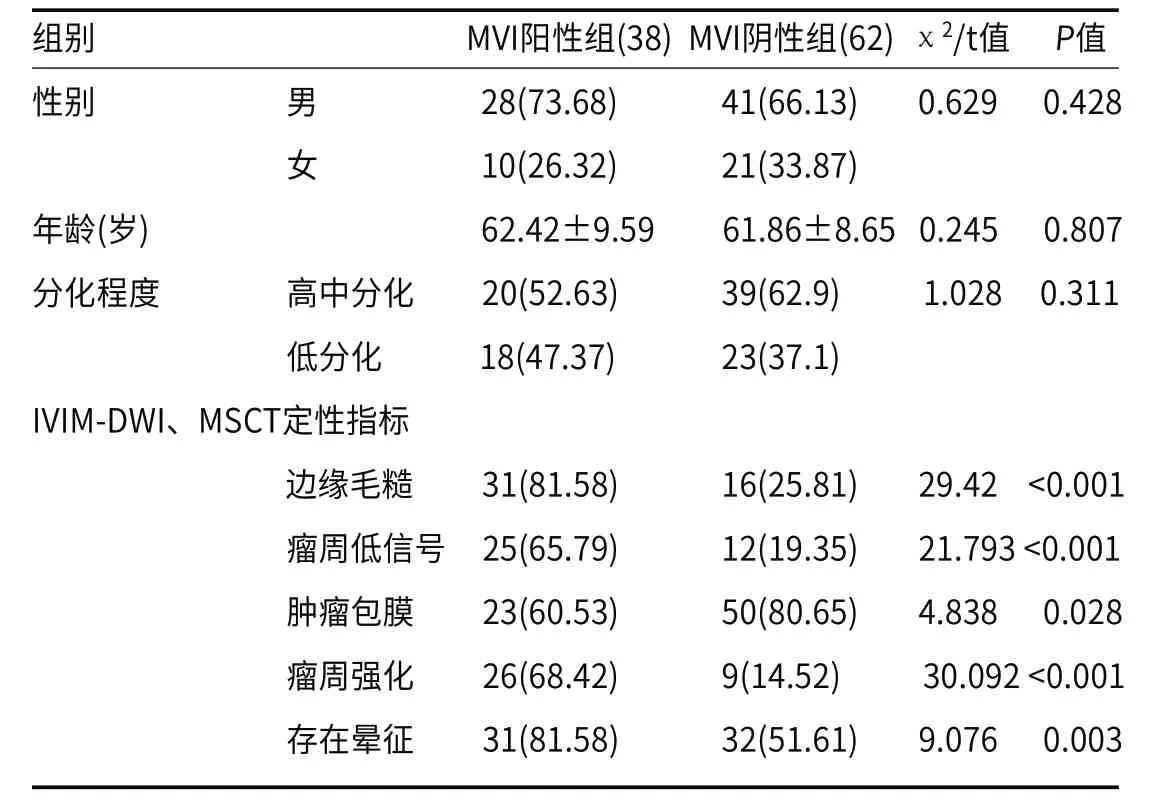
表1 两组临床资料与IVIM-DWI、MSCT定性分析
2.2 两组IVIM-DWI定量参数差异
结果显示,两组D*、F比较差异无统计学意义(P>0.05),但MVI阳性组ADC、D低于MVI阴性组(P<0.05),见表2。2.3 两组MSCT定量参数差异结果显示,MVI阳性组动脉期CT值低于MVI阴性组(P<0.05),延迟期CT值、门静脉期CT值、肿瘤大小高于MVI阴性组(P<0.05),见表3。2.4 IVIM-DWI、MSCT及联合数据对HCC存在MVI的诊断价值ROC曲线分析显示,ADC、D、D*、f、延迟期CT值、门静脉期CT值、动脉期CT值、肿瘤大小诊断HCC存在MVI的AUC分别为0.775、0.856、0.609、0.565、0.708、0.728、0.643、0.705。

表2 两组IVIM-DWI定量参数差异
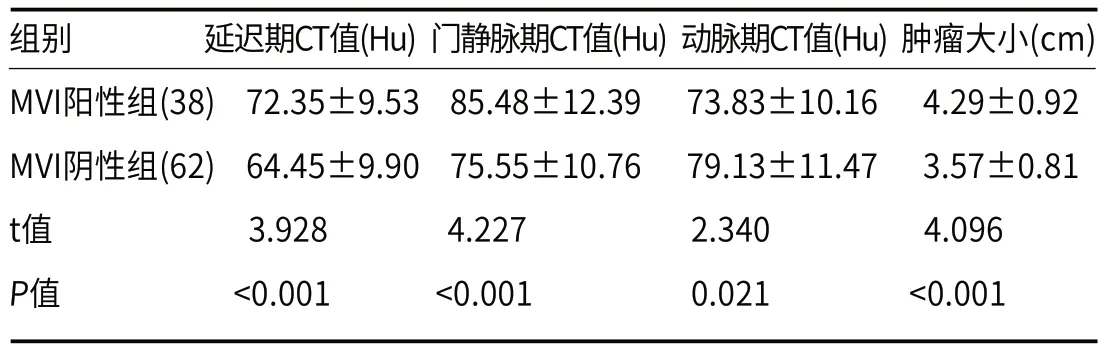
表3 两组MSCT定量参数差异
将ADC、D、D*、f、延迟期CT值、门静脉期CT值、动脉期CT值、肿瘤大小纳入Logistic回归模型,根据回归系数统计分析联合数据,MSCT参数、IVIM-DWI参数、联合数据诊断HCC存在MVI的AUC分别为0.809、0.832、0.920,均具有较好准确性。见表4和图1-2。
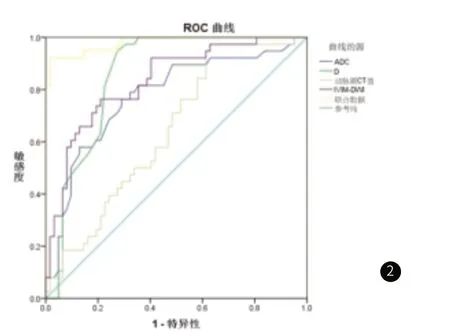
图2 ADC、D、动脉期CT值、IVIM-DWI参数、联合数据诊断MVIR的ROC曲线图
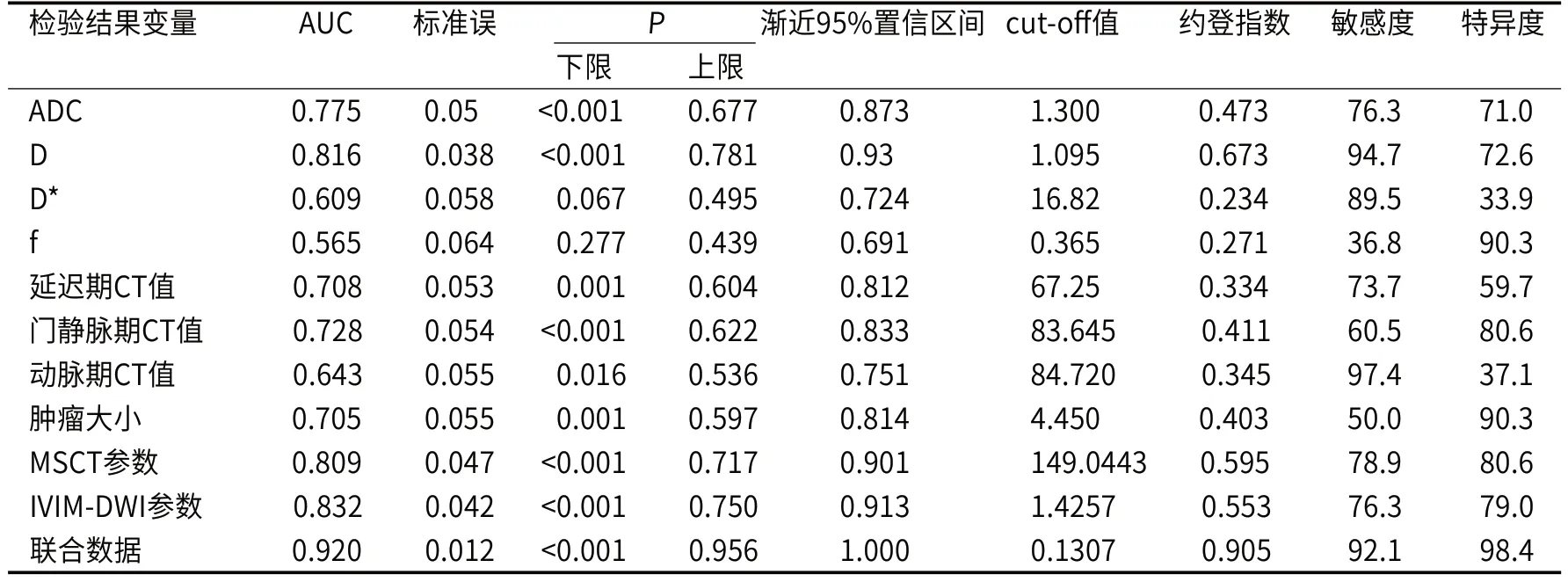
表4 CEUS、SWE定量参数预测中央区淋巴结转移效能分析
3 讨 论
在显微镜下,由内皮覆盖的血管腔内有大量的癌细胞巢团,当管腔内有不低于50个漂浮的癌细胞时,就被称为MVI[12]。早期发现MVI可以进行更广泛的手术切除或射频消融以改善预后。然而,现阶段MVI只能由术后病理证实,而术前穿刺活检虽然准确,但却是侵入性的,而且会出现取样错误,因而需寻找有效的术前无创评估MVI方式,对精准治疗HCC特别重要[5]。综合分析既往文献可知,MVI的宏观影像学征象可概括为[13-15]:(1)包膜侵犯:以往的研究表明,HCC患者的包膜主要由纤维囊和薄的血管层组成,内层是分层的胶原纤维,外层是板状肝细胞,包膜外是丰富的小血管。而相关研究证明,包膜可防止肿瘤细胞侵入周围相邻的肝实质,已被证明可有效抑制肝细胞癌的侵袭潜力,而病理结果清楚地显示出包膜缺失部分的肿瘤细胞与正常肝细胞相通,肿瘤血管也与正常的肝血窦相连,使癌栓很容易侵入并浸润到组织周围的小叶动脉和中央静脉,也会增加MVI的风险。(2)肿瘤形态结节:一方面,肿瘤结节的特征与肿瘤的血供程度相关密切,如果肿瘤的血供丰富异常,则更容易表现出更大的恶性侵袭性,肿瘤病变的边缘大多不光滑,呈现多结节状改变,发生MVI的风险更高。另一方面,肿瘤结节的出现也反映了肿瘤的克隆性来源。在单克隆起源灶肿瘤的情况下,只表现为圆形或类圆形结节,而在多克隆起源灶肿瘤的情况下,结节的数量可能会显著增加,并可能出现外单结节或在肿瘤外部出现连续的多结节变化。肿瘤的克隆性起源增加肝内组织的血管侵犯的可能性。(3)晕征:晕征是一种肝实质强化,出现在门静脉早期或动脉晚期强化过程中,延迟期的肝实质加重有所减弱。相关研究表明[15],晕征是肝癌微血管侵犯或微卫星转移的部位,也是肿瘤静脉的引流部位。如果晕征显示出扭曲或不规则等形状,则可能提示MVI的高风险。(4)其他征象:瘤周强化是MVI的另一个高危征象,是指在MSCT或MRI动态增强扫描时,可见瘤周临近肝组织增强,而强化程度在平衡期减少或消失。这一征象的病理基础与动脉的代偿性灌注异常有关。当肝癌有MVI时,肝组织中的微静脉被癌栓堵塞,导致肝动脉代偿性异常灌注,在MSCT和MRI图像上会表现为瘤周组织异常强化。本研究结果显示,MVI阳性组边缘毛糙、瘤周低信号、瘤周强化、存在晕征高于MVI阴性组(P<0.05),肿瘤包膜低于MVI阴性组。与上述具有一致性。但相关研究表明,现阶段影像学定性特征预测HCC的MVI的价值尚无一致结论[14]。因而本研究未将上述定性指标用于预测MVI,仅作为观察指标。
IVIM-DWI可以从扩散和灌注两个方面体现肿瘤的微循环状态,并可以提供定量参数[13]。本研究结果显示,MVI阳性组ADC、D低于MVI阴性组。分析原因在于:MVI阳性肿瘤的恶性程度更高,侵略性更强,生长速度更快,导致细胞密度更高,这限制了细胞间水分子的扩散;且更多的异质性肿瘤的核浆有更高比例,影响细胞内水分子的扩散;同时存在MVI的患者门静脉和肝静脉分支的微小癌栓也阻碍了水分子的自由扩散,因而ADC、D显著下降。但两组D*、F比较差异无显著差异,其中D*值是血液灌注反映指标,f值与肿瘤血管生成相关密切,两组之间的D*和f值没有差异,可能是由于MVI主要存在于微观的微血管中,微观的血流变化还不足以引起宏观的血流量变化[16]。进一步做ROC曲线分析显示,ADC、D、D*、f、IVIM-DWI参数诊断HCC存在MVI的AUC分别为0.775、0.816、0.609、0.565、0.832,均具有较好准确性。
MSCT图像清晰稳定,动态增强扫描可提供动脉、静脉和延迟期的多时相图像,对检查HCC能准确地提供肿瘤的血供,检查MVI有突出优势[17]。本研究结果显示,MVI阳性组动脉期CT值低于MVI阴性组,延迟期CT值、门静脉期CT值、肿瘤大小高于MVI阴性组。既往研究已经证实,肿瘤大小是MVI的危险因素,较大的肿瘤有更多的新生血管,肿瘤生长、侵袭和转移更快,MVI的概率更高。肿瘤增强的模式可以反映血供的特点,肝动脉和门静脉的双重供血逐渐强化延迟期CT值和门静脉期CT值,削弱了动脉期的CT值,而MVI促进肿瘤血管释放血管生成因子,使血管肿瘤新血管血液供应更加多样化[10]。进一步做ROC曲线分析显示,延迟期CT值、门静脉期CT值、动脉期CT值、肿瘤大小诊断HCC存在MVI的AUC分别为0.708、0.728、0.643、0.705。MSCT参数、IVIM-DWI参数诊断HCC存在MVI的AUC分别为0.809、0.832,均具有较好准确性。为探索最佳诊断HCC存在MVI的有效方式,本研究创新性将IVIM-DWI参数与MSCT参数联合诊断,联合数据AUC分别为0.920,高于单一检查方式诊断。
综上所述,IVIM-DWI、MSCT定性、定量参数均与HCC患者MVI相关,而IVIM-DWI、MSCT诊断MVI均具有一定价值,且联合诊断准确性更高。本研究不足之处为研究为单中心研究,且样本量有限,因此仍有待进一步行大样本研究验证。
