优宁八味散对地塞米松诱导大鼠非酒精性脂肪肝的保护作用及机制研究*
2024-01-22吴哈达曹山虎包宝光温都苏毕力格
吴哈达,曹山虎,小 芳,包宝光,温都苏毕力格
(内蒙古自治区国际蒙医医院 呼和浩特 010065)
非酒精性脂肪肝(NAFLD)可分为非酒精性单纯性脂肪肝、脂肪性肝炎、脂肪性肝硬化等[1]。NAFLD 是慢性肝损伤的主要原因,在中国,成人的NAFLD 现患率最高达45%,其中非酒精性脂肪性肝炎(Nonalcoholic steatohepatitis,NASH)最高达30%,NASH 相关肝硬化发生率为15%-25%[2]。早期干预和个体化药物治疗是延缓和阻断NAFLD 向肝纤维化、肝硬化、甚至肝细胞癌(Hepatocellular carcinoma,HCC)进展的关键。目前公认的NAFLD发病机制为二次打击“学说”,相关研究认为NAFLD 病因与氧化应激、内质网应激、脂质代谢紊乱、线粒体功能失调等相关[3]。关于NAFLD 的治疗,主要以抗炎、降低胰岛素抵抗、降脂、提高抗氧化能力等为主,但患者预后效果较差[4]。蒙医学上NAFLD 归属于通拉嘎(指食物之精华-脂肪)未消化病范畴[5-6]。治疗原则以祛巴达干赫依、清糟归精为主[7],临床上可分为巴达干赫依偏盛型、巴达干希拉偏盛型、血希拉偏盛型、巴达干血偏盛型4种。蒙医认为脂肪性肝炎阶段类似于血希拉偏盛型,属于肝热症,治疗原则为以清血希拉热为主[8],近几年,临床上治疗肝胆疾病的蒙药逐渐增多[9]。MMYBP(优宁八味散,奥优-8,郁宁-8 味,优宁-8 味丸)是蒙医传统验方,记载于蒙医经典著作《蒙医金匮》[10],具有清肝热、解毒等功效,临床上常用于肝热症,配方是绿松石(制)15 g、冰片9 g、丁香12 g、牛胆膏粉3 g、人工麝香0.24 g、葡萄干12 g、木鳖子仁(制)12 g、白檀香12 g 等八味配合组成。相关文献表明MMYBP 有改善慢性乙型、丙型肝炎主要症状、体征及肝功能的作用[11-12]。前期基础研究揭示了MMYBP 能改善四氯化碳(Carbon tetrachloride,CCl4)模型小鼠肝组织氧化应激及炎症反应[13]。目前,MMYBP 治疗NAFLD 及高脂血症方面的研究还尚未报道,且用高脂饲料结合地塞米松注射的方法建造NAFLD模型研究蒙药的文献报道也没有,本研究着眼于此,采用高脂饲料结合地塞米松注射的方法构建NAFLD大鼠模型,地塞米松腹腔注射可以诱导高脂血症和急性脂肪肝模型,使肝指数、血脂、肝组织甘油三酯(TG)短期明显增高,结合高脂饲料持续诱导可以延长脂肪肝模型时间。用MMYBP 干预,从大鼠肝指数、肝功能、血脂、脂质代谢指标以及细胞色素P4502E1(CYP2E1)表 达 等 方 面 探 讨MMYBP 对NAFLD 的治疗作用及机制,旨在探讨MMYBP 是否可以通过调节CYP2E1 蛋白,改善NAFLD 大鼠脂质代谢紊乱,提高预后效果,延缓NAFLD 向肝纤维化及肝硬化进展。
1 材料和方法
1.1 实验动物及饲料
SPF级雄性SD大鼠44只,体质量140-200 g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2019-0010,合格证号:1103242011004970,动物实验伦理编号:AWE2021122801。饲养温度:20-26℃,光照12 h,黑暗12 h,设定自由摄食、饮水。大鼠普通饲料和高脂饲料[14]由内蒙古西恩塞斯生物技术有限公司提供,普通饲料:碳水化合物53%,脂肪5%,蛋白质23%,其他营养成分19%;高脂饲料:普通饲料81%,猪油7.5%,蛋黄粉10%,胆固醇1%,胆酸钠0.3%,丙基硫氧嘧啶0.2%。
1.2 实验中使用的试剂、药品及仪器
实验中采用的试剂及药品详见表1和表2;使用的仪器详见表3。
表1 实验试剂

表2 实验药品
表3 实验仪器
1.3 分组、造模及给药
将44 只SD 大鼠随机分为正常组(A 组),模型组(B 组),易善复组(C 组),MMYBP 高剂量组(D 组)、低剂量组(E 组)5 组。A 组和B 组大鼠各10 只,其余3 组各8 只。A 组喂普通饲料,其余4 组以高脂饲料喂养,自由摄食、饮水。采用高脂饲料结合地塞米松注射的方法建造NAFLD 模型[15-16],除正常组外的其他4 组需要建模,前4天,腹腔注射地塞米松100 mg·kg-1·d-1,从第5-14 天,隔日腹腔注射地塞米松33 mg·kg-1·d-1,第15 天从A 组和B 组中各取2 只,观察肝组织病理改变确定NAFLD 造模成功后,进行药物干预,A 组和B 组用等量的蒸馏水灌胃,C 组、D 组和E 组按着易善复25.3 mg·mL-1、MMYBP 高剂量111 mg·mL-1和MMYBP低剂量66.7 mg·mL-1浓度的混悬液用灌胃法经口给药每只大鼠1 天1 mL,均需投药1 个月,投药剂量根据《药理实验方法学》计算,其他组不给药,1个月后取样本做相关检测,高脂饲料投喂到实验结束,投药开始到实验结束不用地塞米松注射。
1.4 检测指标及方法
1.4.1 取样本
从大鼠腹主动脉采血,分离血清,冷冻保存;取出大鼠完整肝脏,取大鼠肝脏右叶一部分,用4%多聚甲醛溶液固定,用于HE 染色,其余肝组织冻存备检,用于相关基因及蛋白检测。
1.4.2 肝指数
称取各组大鼠体质量和肝脏湿重,计算其肝指数。肝指数=肝脏质量(g)/体质量(g)×100%。
1.4.3 肝组织HE染色
取固定肝组织逐级进行脱水、透明、浸蜡、石蜡包埋、切片及常规染色等操作,观察肝组织病理变化情况。肝细胞脂肪变性程度判断标准参照Diehl法[17],炎症活动度计分标准参考1981 年Knodell 等[18]提出的慢性肝炎组织学活动指数(HAI),并结合王泰龄等[19]提出的慢性肝炎炎症活动度计分方案。
1.4.4 ELISA检测
按照ELISA 试剂盒说明书进行操作,检测各组大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)含量和肝组织(TG)、丙二醛(MDA)、超氧化物歧化酶(SOD)、游离脂肪酸(FFA)含量。
1.4.5 肝组织CYP2E1mRNA表达水平的检测
采用TRIzol 法提取大鼠肝组织总信使RNA(Messenger RNA,mRNA),取总核糖核酸(Ribonucleic acid,RNA)1μg 按照RT-reagent 逆转录试剂盒说明书将其逆转录成互补DNA(Complementary DNA,cDNA),用PCR 分析仪检测荧光信号,荧光标记物为SYBR Green,内参对照为β-actin,进行PCR 扩增反应,扩增条件为95℃ 30 s、95℃ 5 s、62℃ 30 s,循环次数为40 次,引物序列见表4,用2-ΔΔCt法进行相对定量,计算各基因表达量(C:Cycle,t:threshold)。

表4 引物序列表(5’-3’)
1.4.6 肝组织CYP2E1蛋白表达水平的检测
蛋白质印迹(Western Blot)法检测各组大鼠肝组织CYP2E1 蛋白表达水平,取出100 mg 肝组织置于匀浆器内,使肝组织完全匀浆,离心,取上清液,用BCA法检测蛋白浓度;每组各取40 μg行凝胶电泳,转移到PVDF 膜,脱脂牛奶封闭2 h,一抗过夜封闭12 h,二抗孵育1 h 后暗室曝光洗片,内参为GAPDH,将化学发光试剂加于膜上,在成像系统下进行曝光。
1.5 数据统计方法
用SPSS22.0 软件进行统计学分析,数据表示用均值±标准差(±s),组间比较采用t检验,P<0.05 差异有统计学意义。
2 结果
2.1 各组大鼠肝指数变化
与A 组比较,B 组肝指数显著升高(P<0.05);与B组比较,C 组、D 组、E 组肝指数显著减少(P<0.05);与C 组比较,D 组肝指数显著减少(P<0.05),E 组无显著差异,见表5。
表5 各组大鼠肝指数变化(±s,n=8)
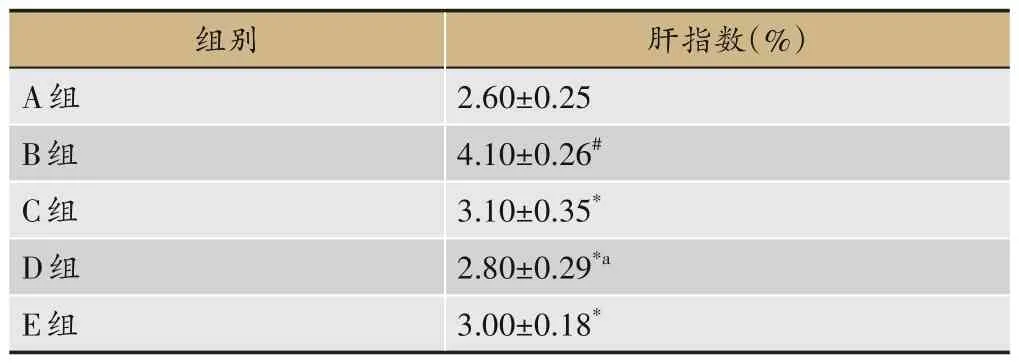
表5 各组大鼠肝指数变化(±s,n=8)
注:与A组比较,#P<0.05;与B组比较,*P<0.05;与C组比较,aP<0.05。
肝指数(%)2.60±0.25 4.10±0.26#3.10±0.35*2.80±0.29*a 3.00±0.18*组别A组B组C组D组E组
2.2 各组大鼠肝组织病理学变化
HE 染色结果显示,A 组大鼠肝小叶结构清晰,细胞索排列整齐,肝窦正常;B组大鼠肝细胞出现肿胀变性,排列无序,细胞内脂肪空泡增多,明显炎症细胞浸润。C 组、D 组和E 组肝细胞形态逐渐恢复,肿胀程度减轻,脂滴空泡减少,炎症细胞浸润减轻,C 组比D 组、E组改善较佳,见图1和表6。
表6 各组大鼠肝脏脂肪变性及炎症变化(±s,n=8)
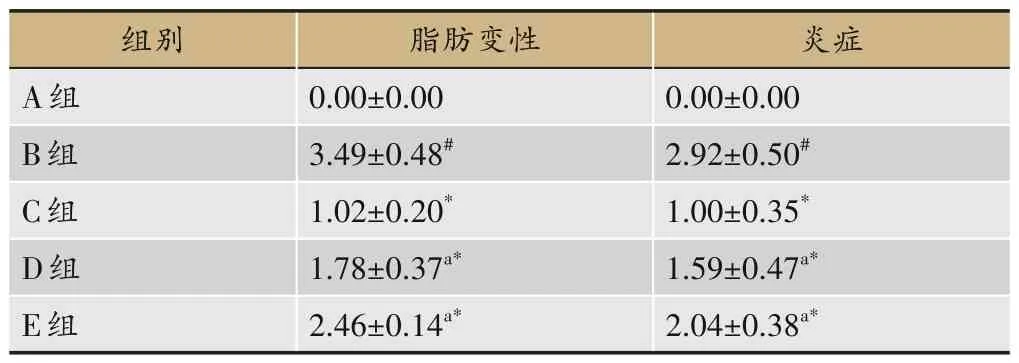
表6 各组大鼠肝脏脂肪变性及炎症变化(±s,n=8)
注:与A组比较,#P<0.05;与B组比较,*P<0.05;与C组比较,aP<0.05。
炎症0.00±0.00 2.92±0.50#1.00±0.35*1.59±0.47a*2.04±0.38a*组别A组B组C组D组E组脂肪变性0.00±0.00 3.49±0.48#1.02±0.20*1.78±0.37a*2.46±0.14a*
2.3 各组大鼠血清和肝脏TG变化
与A 组比较,B 组大鼠血清及肝组织TG 含量均显著增高(P<0.05),与B 组比较,C 组、D 组、E 组大鼠血清及肝组织TG 含量均显著降低(P<0.05);血清TG 含量方面,与C 组比较,D 组显著增高,E 组无显著差异;肝脏TG 含量方面,与C 组比较,D、E 组无显著差异,见表7。
表7 各组大鼠血清和肝脏TG变化(±s,n=8)
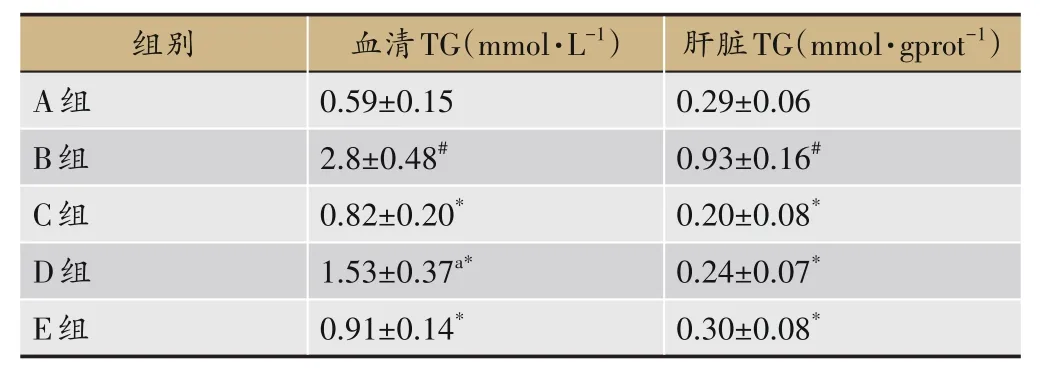
表7 各组大鼠血清和肝脏TG变化(±s,n=8)
注:与A组比较,#P<0.05;与B组比较,*P<0.05;与C组比较,aP<0.05。
组别A组B组C组D组血清TG(mmol·L-1)0.59±0.15 2.8±0.48#0.82±0.20*1.53±0.37a*肝脏TG(mmol·gprot-1)0.29±0.06 0.93±0.16#0.20±0.08*0.24±0.07*E组0.91±0.14*0.30±0.08*
2.4 各组大鼠血清AST和ALT变化
与A 组比较,B 组大鼠血清AST 和ALT 水平显著升高(P<0.05);AST 水平方面,与B 组比较,C 组、D 组、E 组显著降低(P<0.05),与C 组比较,D 组、E 组无显著差异;ALT 水平方面,与B 组比较,D 组、E 组显著降低(P<0.05),C 组无明显差异,与C 组比较,D 组、E 组显著降低(P<0.05),见表8。
表8 各组大鼠血清AST和ALT变化(±s,n=8)
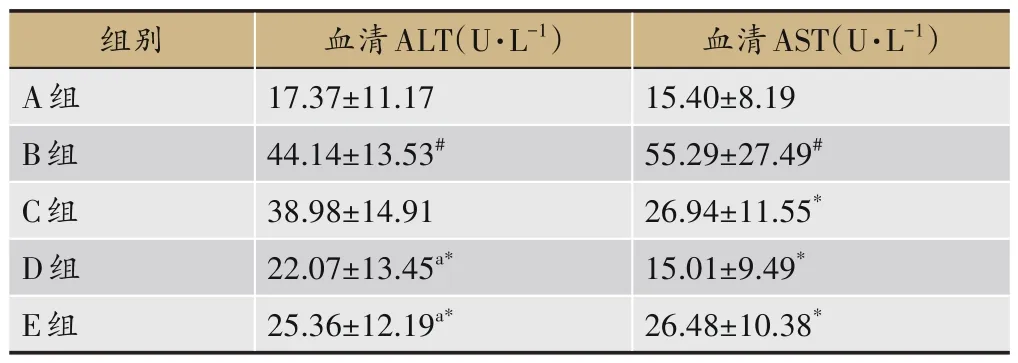
表8 各组大鼠血清AST和ALT变化(±s,n=8)
注:与A组比较,#P<0.05;与B组比较,*P<0.05;与C组比较,aP<0.05。
血清AST(U·L-1)15.40±8.19 55.29±27.49#26.94±11.55*15.01±9.49*26.48±10.38*组别A组B组C组D组E组血清ALT(U·L-1)17.37±11.17 44.14±13.53#38.98±14.91 22.07±13.45a*25.36±12.19a*
2.5 各组大鼠肝组织SOD、MDA及FFA的变化
与A 组比较,B 组大鼠肝组织MDA 和FFA 含量显著升高(P<0.05),SOD 含量显著降低;MDA 方面,与B组比较,C 组、D 组显著降低(P<0.05),E 组无显著差异,与C 组比较,D 组、E 组无显著差异;FFA 方面,与B组比较,C 组、D 组、E 组显著降低(P<0.05),与C 组比较,D 组、E 组无显著差异;SOD 方面,与B 组比较,C组、D 组、E 组无显著差异,与C 组比较,D 组、E 组无显著差异,见表9。
表9 各组大鼠肝组织SOD、MDA及FFA的变化(±s,n=8)
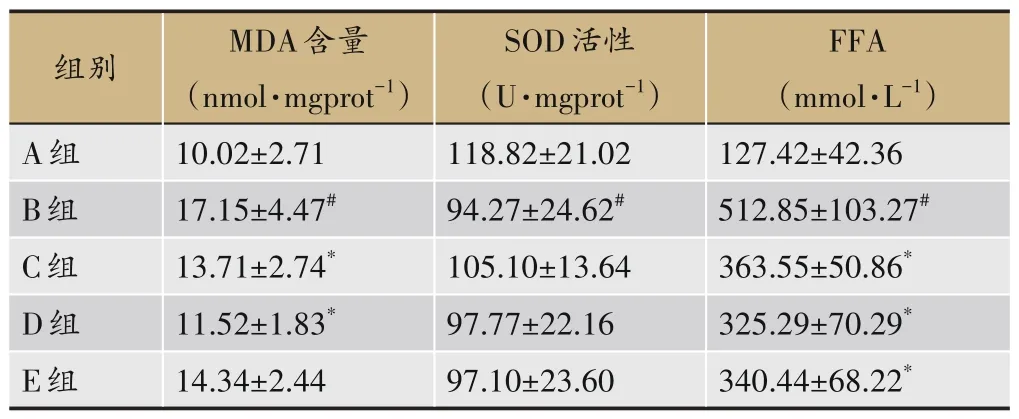
表9 各组大鼠肝组织SOD、MDA及FFA的变化(±s,n=8)
注:与A组比较,#P<0.05;与B组比较,*P<0.05。
FFA(mmol·L-1)127.42±42.36 512.85±103.27#363.55±50.86*325.29±70.29*340.44±68.22*组别A组B组C组D组E组MDA含量(nmol·mgprot-1)10.02±2.71 17.15±4.47#13.71±2.74*11.52±1.83*14.34±2.44 SOD活性(U·mgprot-1)118.82±21.02 94.27±24.62#105.10±13.64 97.77±22.16 97.10±23.60
2.6 各组大鼠肝组织CYP2E1 蛋白表达及CYP2E1 mRNA表达水平
与A 组比较,B 组大鼠肝组织CYP2E1 蛋白及CYP2E1 mRNA 表达水平明显增强(P<0.05),与B组比较,C 组、D 组、E 组 大 鼠 肝 组 织CYP2E1 蛋 白 及CYP2E1 mRNA 表达水平明显减弱(P<0.05),与C组比较,D 组大鼠肝组织CYP2E1 蛋白及CYP2E1 mRNA 表达水平明显减弱(P<0.05),E 组无显著差异,见图2 和表10。
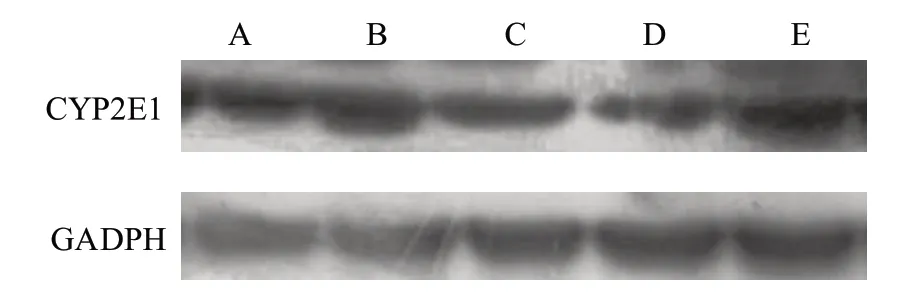
图2 各组大鼠肝脏组织CYP2E1 蛋白表达情况
表10 各组大鼠肝组织中CYP2E1 mRNA表达水平比较(±s,n=8)
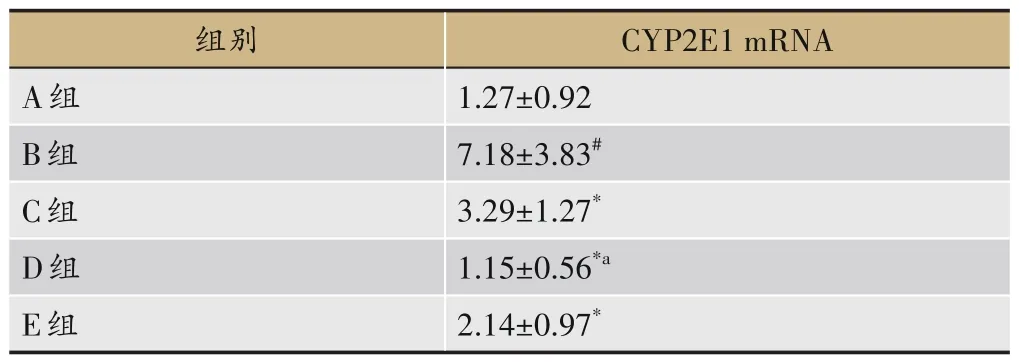
表10 各组大鼠肝组织中CYP2E1 mRNA表达水平比较(±s,n=8)
注:与A组比较,#P<0.05;与B组比较,*P<0.05。
CYP2E1 mRNA 1.27±0.92 7.18±3.83#3.29±1.27*1.15±0.56*a 2.14±0.97*组别A组B组C组D组E组
3 讨论
肝脏是碳水化合物、蛋白质、脂肪合成与水解的重要场所,任何引起脂肪代谢紊乱的因素都有可能导致肝脏脂肪异位堆积,产生脂肪肝。其中,NAFLD 发展迅速,易从单纯性脂肪肝演变成脂肪性肝炎、肝硬化等,甚至可能恶化成肝癌,对人类健康、生命安全有严重威胁。与此同时,近年来,NAFLD 在我国的发病率逐年上升,且有年轻化的趋势,这就进一步凸显了NAFLD研究的重要性。
目前,医学界普遍公认的NAFLD 发病机制为Day等[20]提出的“二次打击”学说。第一次打击主要是肝细胞脂肪变;第二次打击是发生脂质过氧化反应、氧化应激等改变,引起脂肪性肝炎,再进展为肝纤维化、肝硬化等[21-22]。第一次打击中胰岛素抗脂解作用受到障碍,肝细胞的甘油三酯合成增加、摄取FFA 增多,导致肝脏脂肪变性。第二次打击是由于脂质代谢紊乱而引起氧化应激和脂质过氧化反应,造成肝细胞损伤和炎症反应[23]。CYP2E1 是肝脏代谢过程的主要酶系之一,在NAFLD 发病过程中CYP2E1 是参与脂质代谢的重要代谢酶[24]。肝细胞内FFA 含量的增多导致CYP2E1 活性增加,引起肝脏脂肪变、炎症、坏死及纤维化等[25-26]。NAFLD 的发病过程中CYP2E1 的表达增强使MDA 含量升高,CYP2E1 与肝组织脂质代谢紊乱、炎症及纤维化进程密切相关[27]。
高脂饲料加地塞米松腹腔注射诱导大鼠NAFLD模型,特点是地塞米松诱导后模型形成快,加上高脂饲料可以防治模型自愈,有利于药效观察[15]。本实验采用此方法制作大鼠NAFLD 模型,第15 天开始肝组织出现明显的脂肪变性,与正常组比较,模型组大鼠血清AST 和ALT 水平显著升高,提示动物模型制作成功。
在NAFLD的临床治疗方面,目前使用较多的药物包括胰岛素增敏剂、减肥药物、调血脂药、肝细胞保护剂、抗氧化剂等,这些药物均具有一定的临床疗效,但往往会导致患者出现一定的不良反应,如下肢水肿、肝脏毒性、转氨酶增高等,进一步寻求安全性更高的治疗手段非常必要[28-29]。
蒙药优宁八味散(MMYBP)是内蒙古自治区国际蒙医医院制剂室配制的蒙药传统药方,包含绿松石(制)、冰片、丁香、牛胆膏粉、人工麝香、葡萄干、木鳖子仁(制)、白檀香八味蒙药,其中绿松石可清热解毒、消炎止血,冰片可去翳明目、消肿止痛,丁香可温中降逆、补肾助阳,牛胆膏粉为蒙医特色专用品种,可平息希拉、愈伤、解毒,麝香可活血通经、消肿止痛,葡萄干可滋肾益肝,木鳖子仁具有消肿散结、祛毒等功效,白檀香可畅膈宽胸,温胃散寒。诸药结合,具有清热解毒、助消化等作用,临床多用于血希拉型肝胆疾病的治疗,有着非常广泛的应用,是为蒙药名方。
MMYBP 在临床上治疗肝热症疗效显著,前期研究发现MMYBP 能改善CCl4模型小鼠肝损伤,但没有MMYBP 治疗高脂饲料结合地塞米松注射构建的NAFLD 动物模型的相关文献报道,本研究采用高脂饲料结合地塞米松诱导NAFLD 大鼠模型,观察MMYBP对NAFLD 模型大鼠相关指标的影响,结果发现,MMYBP组与NAFLD模型组大鼠比较,MMYBP组能明显降低肝指数,恢复肝细胞形态,减轻肝细胞肿胀程度,血清和肝组织TG、MDA、FFA、CYP2E1水平均显著降低,肝功指标ALT、AST水平显著下降,提示MMYBP可以明显改善NAFLD 预后,MMYBP 对NAFLD 模型大鼠能调控脂质代谢紊乱,具有降脂保肝等治疗作用,其作用机制可能与MMYBP 调节 CYP2E1 表达、抑制氧化应激反应有关,其他相关靶点及信号通路仍需进一步研究[30-31]。
综上所述,结合本次研究结果,可以认为MMYBP能降低NAFLD 脂质代谢相关CYP2E1 蛋白及CYP2E1 mRNA 的表达水平,改善肝功能及脂质代谢紊乱,对NAFLD 有降脂保肝的作用,延缓NAFLD 向肝纤维化及肝硬化进展,但其具体相关机制及靶点还有待进一步研究。
