大黄酸抑制线粒体分裂和EMT减缓乳腺癌细胞迁移*
2024-01-22李小波陈金霞娄兴凤苗春龙郑衍芳
李小波,谢 艳,陈金霞,娄兴凤,苗春龙,范 庆,郑衍芳
(1.遵义医科大学珠海校区诊断学教研室 珠海 519000;2.遵义医科大学珠海校区生物工程系 珠海 519000;3.遵义医科大学珠海校区数理教研室 珠海 519000;4.遵义医科大学珠海校区生理学教研室 珠海 519000)
2020 年全球乳腺癌(Breast cancer,BC)新发病例高达226 万例,超过了肺癌的220 万例,成为全球第一大癌[1]。乳腺癌是全世界女性中最常见的癌症,在我国女性乳腺癌的发病率逐年增高,其发病率位居女性肿瘤的第1 位,每年有超过30 万的新发患者,其死亡率为女性肿瘤第4位[2-3]。约90%以上的癌症相关死亡是由转移引起的。诊断为远处转移的乳腺癌患者中仅有27%存活5 年。因此,抑制癌症转移的驱动因素至关重要,对提高生存率有重大意义。
癌症转移是一个多步骤的过程,涉及肿瘤与微环境之间的相互作用。转移进展的初始步骤是癌细胞转化为具有迁移和侵袭细胞的特征,称为上皮-间充质转化(Epithelial-mesenchymal transition,EMT)。线粒体是细胞的能量工厂,产生ATP 供能。线粒体在细胞骨架上不断融合、分裂和移动,形成线粒体网络。融合由有丝分裂融合蛋白1(Mitofusi1,Mfn1)、有丝分裂融合蛋白2(Mitofusi2,Mfn2)等催化,而分裂由动力相关蛋白(Dynamin-related protein1,Drp1)和线粒体分裂 蛋白1(Mitochondrial fission protein 1,Fis1)等调控[4-6]。线粒体分裂可以促进EMT,研究表明线粒体分裂形成片段,以便在细胞前沿运输和积累,产生更多的ATP,促进癌细胞迁移和转移[7]。与乳腺细胞MCF-10A 相比,乳腺癌细胞MDA-MB-231 高表达Drp1,低表达Mfn2[8]。三阴性乳腺癌细胞相较低转移性的非三阴性乳腺癌细胞Drp1 升高更明显。敲除Drp1 可抑制乳腺癌细胞迁移,同时敲除MFN2/1减缓这种作用[9]。
大黄酸(Rhein)化学名为4,5-二羟基2-羧酸蒽醌,属单蒽核类1,8-二羟基蒽醌衍生物,主要分布于中药大黄、何首乌等。现代研究表明,大黄酸可通过影响Stat/Snail、PI3K/AKT 信号通路,抑制癌细胞的增殖、迁移和侵袭[10-11]。大黄酸可导致线粒体膜电位升高,产生更多的ROS,促进癌细胞凋亡[12]。然而,目前尚不明确大黄酸是否通过影响线粒体动力学失调和EMT,从而抑制乳腺癌转移。本研究使用MDA-MB-231乳腺癌细胞,检测大黄酸是否通过调控线粒体动力学和EMT,从而减缓癌细胞迁移。探索大黄酸对乳腺癌的作用机制,提高大黄酸对乳腺癌的应用开发前景。
1 材料与方法
1.1 材料
1.1.1 细胞株来源
人乳腺癌癌细胞MDA-MB-231(货号:HYC3553)购自和元生物技术有限公司。
1.1.2 药物和试剂
BCA 蛋白浓度测定试剂盒(批号:P0010)购自中国上海碧云天生物技术有限公司;一抗:Mfn2(批号:PB0264);Vimentin(批号:PB9359);E-cadherin(批号:BA0475)、β-actin(批号:BM0627)、羊抗兔 IgG(HRP)二抗(批号:BA1054)购自武汉博士德公司。Drp1(批号:ab56788)购于美国Abcam 公司。大黄酸(批号:DD002901,HPLC≥98%)购自成都德思特公司,CCK-8试剂盒(货号:K0301)购自MedChem Express公司。
1.1.3 仪器
SW-CJ-2F 洁净工作台(苏州安泰空气技术有限公司);HF90 型CO2培养箱(上海力申科学仪器有限公司);3K15型高速冷冻离心机(湘仪实验室仪器开发有限公司);M5 02868型多功能酶标仪(广东省农垦集团进出口有限公司);IX71型荧光倒置显微镜(日本奥林巴斯);Mini-PROTEAN 蛋白电泳系统(美国Bio-Rad公司);HT7700透射电子显微镜(日本日立公司)。
1.2 方法
1.2.1 CCK8实验
将对数生长期细胞细胞接种于96孔板,每组3个复孔。加入不同浓度梯度的大黄酸继续培养24 h后,每孔避光加10 μL CCK8溶液,37℃中继续培养2 h。酶标仪下检测波长为490 nm处的吸光度(A)值,计算细胞存活率。根据实验结果选择效果明显的浓度进行后续实验。
1.2.2 克隆形成实验
取700个cells/孔接种于6孔板,保证每个细胞均分散成单个细胞,分别加入100 μmol·L-1、200 μmol·L-1的大黄酸,并设置0 μmol·L-1大黄酸为对照组,连续培养7天。PBS轻洗两次,每孔加入1 mL的4%多聚甲醛,室温固定30 min。用0.1%结晶紫染色10 min,弃掉染液,用ddH2O清洗2-3次,晾干后观察克隆数,拍照并统计克隆形成数。克隆形成率=(克隆数/接种细胞数)×100%
1.2.3 划痕实验
6孔板底部外侧用黑色标记笔均匀划三条横线,将每孔三等分。待细胞密度大约为90%时,用200 μL枪头轻轻均匀划竖线划痕,使其与标记的横线垂直。PBS洗2遍去除悬浮的细胞后在倒置显微镜下拍摄此时划痕宽度,记为0 h。重新加入100 μmol·L-1、200 μmol·L-1的大黄酸,并设置0 μmol·L-1大黄酸为对照组,继续细胞培养箱中培养。在加药24 h记录细胞划痕宽度变化。
1.2.4 透射电镜观察线粒体形态
将对数生长期细胞接种至6孔板,培养24 h后添加200 μmol·L-1大黄酸处理24 h,并设置0 μmol·L-1大黄酸为对照组,培养24 h后弃去培养液,加入电镜固定液4℃固定4 h,细胞低速离心提取细胞,1%琼脂糖包裹,1%的锇酸0.1 mol·L-1磷酸缓冲液PB固定2 h。梯度乙醇脱水、渗透、包埋。切80 nm超薄切片,铀铅双染色,切片室温干燥过夜。透射电子显微镜下观察拍片。
1.2.5 免疫印迹法检测相关蛋白的表达
将对数生长期细胞接种至6孔板,培养24 h后,加入100 μmol·L-1、200 μmol·L-1大黄酸处理24 h,并设置0 μmol·L-1大黄酸为对照组,培养完成后PBS 缓冲液清洗2 次,加入适量RIPA 裂解液,离心10 min,取上清,BCA 蛋白定量试剂盒测定蛋白浓度,加20 μL蛋白上样在10% SDS-PAGE 中电泳,湿转法将蛋白转移至PVDF膜,将膜浸在封闭液中低速摇匀封闭2 h,膜取出直接放入一抗中,4℃封闭过夜;PBST洗膜,5 min 10次;膜转入二抗中,室温孵育2 h;PBST洗膜,5 min 10次;用化学发光法(ECL)显影。
1.3 统计方法
本实验数据的统计分析采用SPSS 21.0 和GraphPadPrism 8.0 软件,结果以均值±标准差(±s)表示,多组间比较采用单因素方差分析,组内两两比较用SNK-q检验,分析各组糖酵解酶表达的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度大黄酸对MDA-MB-231细胞生长的影响
采用CCK8 实验,检测不同浓度梯度的大黄酸(0 μmol·L-1、12.5 μmol·L-1、25 μmol·L-1、50 μmol·L-1、100 μmol·L-1、200 μmol·L-1、400 μmol·L-1)作 用24 h后MDA-MB-231 细胞活力。如图1 所示,较高浓度大黄酸产生抑制细胞生长作用。在100 μmol·L-1和200 μmol·L-1时可以显著抑制细胞活性(P<0.01),因此后续实验选择这两个剂量为给药浓度,给药时间为24 h(图1)。

图1 大黄酸对MDA-MB-231细胞活力的影响
2.2 细胞克隆实验
克隆实验可以表达细胞增殖的情况,结果显示大黄酸处理后7天,与对照组比较,大黄酸组细胞克隆数量明显减少(P<0.05),200 μmol·L-1剂量抑制效果更明显。说明大黄酸可以剂量依赖性的抑制乳腺癌细胞的生长(图2)。

图2 大黄酸对MDA-MB-231细胞增殖的影响
2.3 细胞迁移实验
细胞迁移能力变化采用划痕实验进行评估,迁移的距离代表了细胞的迁移能力。结果显示大黄酸作用MDA-MB-231 细胞24 h 后,与对照组相比,大黄酸组划痕较宽,细胞迁移距离小;大黄酸高浓度组,较低浓度组细胞迁移距离小,表明大黄酸对MDA-MB-231细胞的迁移能力有明显浓度依赖抑制作用,差异均有统计学意义(图3)。

图3 大黄酸对MDA-MB-231细胞的迁移影响
2.4 大黄酸对线粒体形态的影响
为了进一步直观研究大黄酸对乳腺癌癌细胞线粒体动力学的影响,运用透射电子显微镜观测乳腺癌细胞内部的线粒体形态和分布。结果如图4 显示,对照组乳腺癌细胞的胞质中出现许多气泡样的空泡,线粒体过度分裂,线粒体呈碎片化,分布在细胞膜旁和细胞前沿,大黄酸治疗后,线粒体数目减少,多分布在细胞质内。这可能是大黄酸影响线粒体动力学途径,抑制乳腺癌细胞迁移的潜在原因。
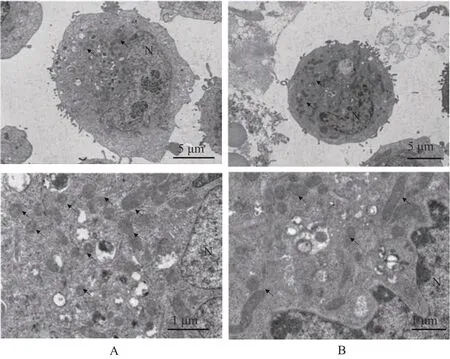
图4 大黄酸处理后乳腺癌细胞超微结构变化
2.5 大 黄 酸 对MDA-MB-231 细 胞Drp1、Mfn2、Ecadherin、Vimentin蛋白表达的影响
免疫印迹法结果(图5)显示,大黄酸作用于乳腺癌癌细胞24 h 后,与对照组0 μmol·L-1大黄酸组比较,乳腺癌细胞Drp1、Vimentin蛋白表达量较对照组显著降低(P<0.05),Mfn2、E-cadherin蛋白升高。与100 μmol·L-1大黄酸组比较,200 μmol·L-1大黄酸组效果更显著(P<0.05)(图5)。
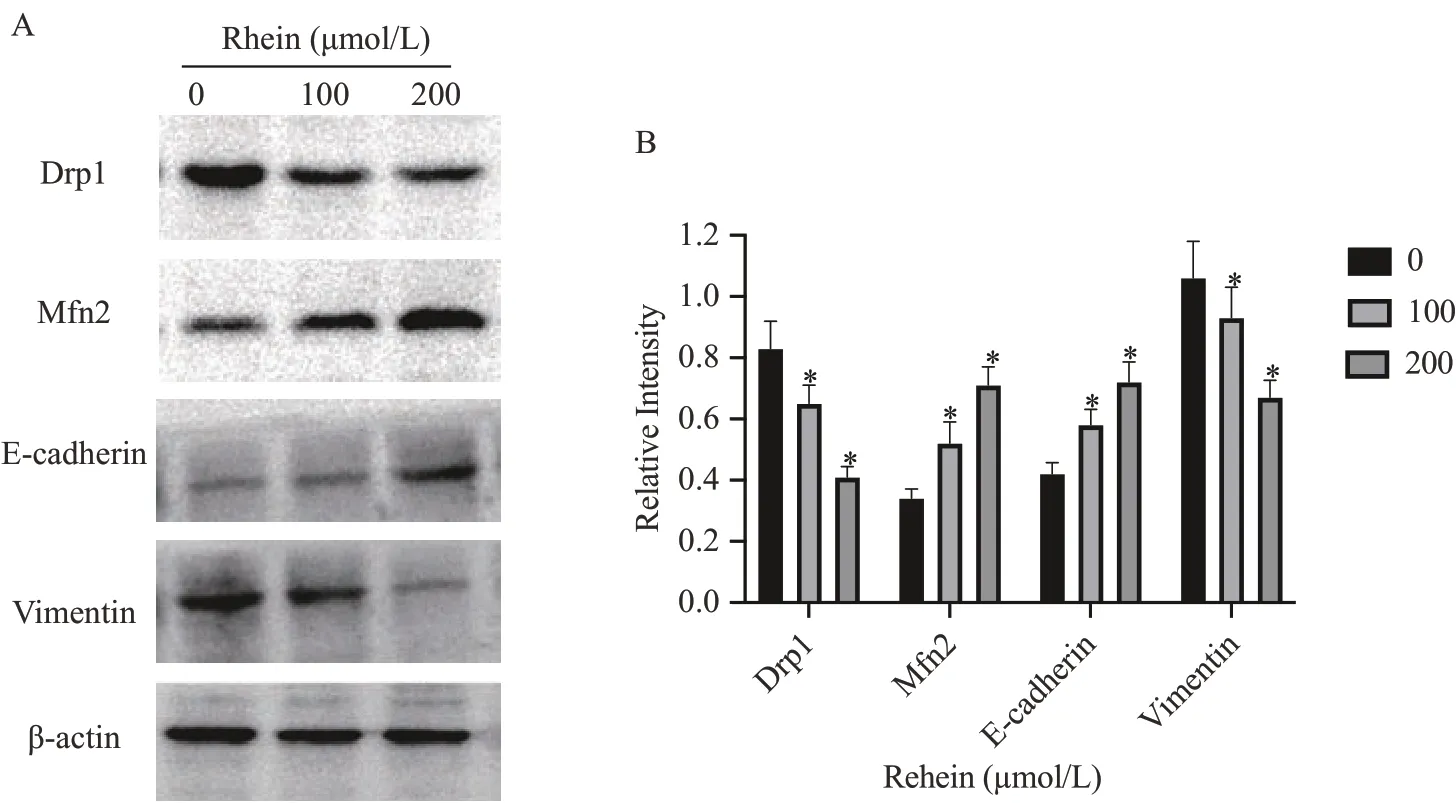
图5 大黄酸对MDA-MB-231细胞中Drp1、Mfn2、E-cadherin、Vimentin蛋白表达的影响
3 讨论
中医药具有几千年的历史,积累了丰富的临床实践经验,乳腺癌属“乳岩”。中医认为乳癖的发生是由于情志不畅、久郁伤肝、肝气郁滞、痰凝血瘀所致,进一步发展气滞阴虚,毒瘀互结从而形成乳岩。治则多为祛瘀散毒等。现代药理学发现,大量的中药提取物可有效防治肿瘤,而在传统医学中,这些植物常用于治疗炎症、淤血、症瘕积聚等,大黄酸是一种从大黄、何首乌等中药中提取的蒽醌。越来越多的研究表明,大黄酸可以在体外和体内抑制乳腺癌、宫颈癌、结肠癌、肺癌、卵巢癌等,其机制与调节癌细胞中多种信号通路和抑制癌基因活性和表达有关,比如可以通过抑制癌细胞的增殖、迁移和侵袭,阻止血管生成而减缓癌症的进展[13-14]。最新研究表明大黄酸可以联合化疗药物,增强化疗药物的效果。Wang 等[15]将阿霉素和大黄酸联合制备为纳米颗粒,两者联合治疗通过抑制NF-κB 和MMP-9 的表达,不仅有效抑制原发性肿瘤生长,而且在体外和体内均显著抑制肿瘤转移,并更加安全。本研究结果证实大黄酸抑制乳腺癌细胞增殖可呈剂量依赖性,并可减缓乳腺癌细胞迁移。
乳腺癌转移级联是由癌细胞扩散到周围组织引起的,涉及癌细胞和微环境交互的多个步骤。癌细胞利用EMT 过程获得侵袭性和干细胞性是启始步骤。EMT 是一个进化保守的可逆生物过程,导致从上皮表型向间充质表型的转换。形态学上,EMT 表现为细胞失去极性、粘附性和紧密接触,导致细胞脱离基底膜,同时大量的细胞骨架重排,将上皮细胞的形态改变为成纤维细胞样的纺锤形细胞,使其具有更大的运动潜能,从而侵入周围组织使其迁移到远处。本研究发现大黄酸可以降低间质标志蛋白Vimentin 表达,升高上皮标志蛋白E-cadherin表达。说明大黄酸可以抑制乳腺癌细胞的上皮细胞转分化。EMT 具有很大的可塑性即可以逆转,这个过程叫做间充质-上皮转化(Mesenchymal-epithelial transition,MET)。迁移后,细胞可以通过MET 在新位置形成肿瘤。所以EMT 不仅有助于癌细胞的侵袭和转移,而且增强癌细胞的耐受性和存活率,使它们能够在远处形成新的肿瘤[16]。因此大黄酸抑制肿瘤细胞EMT,阻止细胞可塑性的瞬时动态过程有助于阻断转移级联反应,防止癌细胞扩散和转移性生长[17]。
线粒体是一种动态变化的细胞器,在细胞生命过程中融合和分裂,要么呈长椭圆形,要么以形成网络的细长分支的形态出现,在正常细胞内,通过相关蛋白调节,实现分裂-融合动力学平衡,稳定线粒体形态及在细胞中的分布,从而维持线粒体能力代谢,机体的正常生理功能[18]。但在癌症发生发展过程中,线粒体的动力学失衡,乳腺肿瘤中线粒体过度分裂,融合减退,线粒体呈碎片化,且在细胞内分布异常,线粒体在细胞前沿运输和积累,在那里促进ATP 的局部产生,这对于板状足形成、细胞迁移和转移形成至关重要[19],促进乳腺肿瘤生长和转移[4]。研究证实大黄酸可以降低Drp1 蛋白表达,升高Mfn2 蛋白表达,抑制线粒体分裂和影响线粒体在细胞内的分布。
Drp1 是与线立体分裂密切相关的蛋白,属于动力学GTPase超家族。在胞质和线粒体外膜上均有分布,大部分分布在胞质中,线粒体外膜上的Drp1位于线粒体分裂部位,通过不断溢缩促使线粒体膜分裂。乳腺癌患者高表达Drp1,抑制Drp1表达可以显著减低线粒体自噬,代谢重编程,说明Drp1 在调节乳腺癌细胞代谢和生存中起重要作用[8]。线粒体分裂增加和线粒体网络缺失被描述为致瘤转化和癌症侵袭性增加的特征,与非转移性癌细胞相比,转移性癌细胞中驱动线粒体裂变的Drp1明显上调。癌症进展过程中,线粒体需要作为单个单位,脱离紧密的网络组织在细胞内移动。在EMT 过程中,细胞膜下线粒体的积聚是促进丝状足和板状足形成的必要条件。研究发现通过敲低Drp1,可促进乳腺癌细胞融合,抑制线粒体在细胞核和迁移细胞前沿之间的前定位,减缓细胞的侵袭和转移程度[7]。大黄酸降低Drp1表达,抑制线粒体分裂,使细胞运动性和侵袭能力明显受损,促进EMT 从而推动癌细胞转移。
Mfn2 定位于线粒体外膜,调控线粒体的融合,维持线粒体形态的动态平衡。同时属于GTPase超家族,N 端为保守的GTP 酶结构域,C 端为螺旋-螺旋结构。融合过程中,其C端与线粒体外膜结合,形成反式同源或异源的寡聚复合体,介导线粒体外膜的融合。有研究证实剔除Mfn基因可使线粒体融合效率下降,导致线粒体片段化及线粒体的移动能力减弱。在乳腺癌患者中发现低表达Mfn2 的预后劣于高表达的患者,敲除Mfn2基因的MCF7细胞生长快,集落形成迅速,肿瘤的浸润性强,Mfn2可能是通过mTORC2/AKT通径调节肿瘤细胞的凋亡,增殖[20-21]。本研究证实,对于三阴性乳腺癌细胞MDA-MB-231,大黄酸升高Mfn2 蛋白表达,调节线粒体功能和细胞增殖,但大黄酸如何通过信号通路调节乳腺癌细胞的线粒体功能,尚需进一步研究。
综上所述,大黄酸可以降低Drp1 水平,升高Mfn2蛋白表达水平,从而减少线粒体分裂;降低间质标志蛋白Vimentin 表达,增高上皮标志蛋白E-cadherin,从而抑制上皮细胞转分化。研究表明,大黄酸多靶点降低乳腺癌细胞增殖和迁移的能力,抑制乳腺癌的发展,具有较好的基础研究前景和临床应用价值。
