干细胞源性细胞外囊泡治疗早发性卵巢功能不全的机制研究进展
2024-01-21曾文卓黄欣怡徐数理孙晓峰
曾文卓,黄欣怡,徐数理,孙晓峰
湖南中医药大学医学院,湖南长沙 410208
早发性卵巢功能不全(premature ovarian insufficient,POI)指女性在40岁前出现的卵巢功能减退,主要表现为月经异常、促性腺激素(FSH)水平升高(>25 U/L)、雌激素水平波动性下降,其终末阶段称为卵巢早衰(premature ovarian failure,POF),此阶段表现为闭经、激素严重紊乱(FSH>40 U/L)并伴不同程度的围绝经期症状[1-2]。POI 患者雌激素水平的降低可增加代谢性骨病、心血管疾病及神经系统疾病的患病风险[3],降低患者的生活质量。同时,POI 也是不孕症的重要病因之一。当前,我国人口老龄化形势严峻,提高人口出生率势在必行,因此,女性生殖健康问题不仅是患者的自身健康问题,更是事关人口结构优化的社会问题。目前常用的针对POI 的治疗及辅助生殖技术均存在不同程度的局限性。因此,亟需找到一种安全可靠的治疗方法以解决POI 带来的一系列问题。来源于干细胞的细胞外囊泡(extracellular vesicles,EVs)不仅具有其亲代干细胞的治疗功效,且免疫原性低、可跨越细胞屏障,近年来已成为多种疾病治疗研究的热点[4]。本文从POI的治疗现状及前景入手,基于改善卵巢功能、影响颗粒细胞(granulosa cells,GCs)增殖及凋亡、促进卵巢血管生成、减轻氧化应激反应、影响生育能力及后代等方面对干细胞来源的EVs 治疗POI 的机制进行综述,旨在为EVs用于POI的临床治疗提供依据。
1 POI的治疗现状及前景
激素替代疗法(hormone replacement therapy,HRT)是临床上应用最广泛的POI治疗方法,可调节激素紊乱,缓解各种更年期症状,但无法从根本上恢复卵巢功能和生育能力,且存在诱发静脉血栓及癌症等风险[5]。对于有生育需求的POI 患者,常在HRT 治疗的基础上借助辅助生殖技术和生育力保存方法。有效的辅助生殖技术为赠卵体外受精-胚胎移植技术(IVF-ET),生育力保存方法包括胚胎冷冻、卵细胞冷冻及卵巢组织冷冻等[1]。但此类方法仍存在技术、管理、安全性及伦理上的问题,促排卵药物的使用还可使患者面临卵巢过度刺激综合征的风险。随着干细胞研究的深入,大量研究提示,干细胞移植在动物模型中可修复损伤卵巢组织、改善内分泌,从而恢复卵巢功能[6-7]。在膝骨关节炎、移植物抗宿主病及糖尿病等疾病中干细胞治疗已进入临床试验阶段[8],在POI中也已有少量不完善的初期临床研究[9-11]。但干细胞移植的局限性如伦理争议、移植细胞存活率低、异体移植排斥、侵入性操作及肿瘤转化等[12]限制了其进一步应用。EVs 是干细胞移植治疗的重要旁分泌机制之一。一项关于心脏修复的研究证实,EVs 具有其亲代诱导多能干细胞的治疗功效,且无致瘤性[13]。多项研究也证实EVs 没有致瘤风险[14-15]。EVs能包裹活性物质、隔绝外界酶的影响,在血液循环和远距离治疗中更安全稳定,是理想的药物载体[16]。此外,EVs 具有干细胞的多种治疗功效,又能弥补干细胞移植的劣势,有望成为干细胞移植的优势替代方法。对于肿瘤患者,EVs可作为临床诊断和预后评估的标志物[17]。在POI 的治疗中,EVs 已被多项动物实验研究证实能通过改善卵巢功能、影响GCs 增殖凋亡等不同机制恢复卵巢功能。因此,EVs 作为一种新兴的细胞间通信方式,可能成为打破POI治疗瓶颈的关键。
2 干细胞来源的EVs
EVs 是一种可由多种细胞分泌的具有脂质双分子膜结构的纳米级囊泡[18],根据大小、释放方式及表面标记物的不同,可分为微囊泡(microvesicles,MVs)、 外 泌 体(exosomes, EXOs)、 凋 亡 小 体(apoptotic bodies,ABs)等多种亚群。MVs是膜蛋白重塑出芽分离出的具有脂质双分子层的囊泡,其直径一般为150~1000 nm;外泌体直径一般为40~150 nm,早期在细胞内形成多泡体(multivesicular bodies,MVBs),其内包含有多个腔内囊泡(intraluminal vesicles,ILVs)即外泌体的前体,MVBs与细胞膜融合后释放出的ILVs 即为外泌体;凋亡小体直径一般为1~5 μm,是通过发芽脱落机制或自噬体形成机制使胞膜皱缩内陷,包裹胞质、DNA 及细胞器形成的泡状小体[19-20]。EVs广泛分布在母乳、血液等生物体液中,可由干细胞、上皮细胞等多种细胞分泌[21],而考虑到低免疫原性及可大量扩增等优势,干细胞是目前相关研究工作中EVs 的主要来源。干细胞来源的EVs可包含各种生物活性物质,如蛋白质、脂质、DNA、微小RNA(microRNAs,miRNAs)、长链非编码RNA(long non-coding RNAs,lncRNAs)等,能通过传递内容物参与细胞间通信,进而影响靶细胞的表型及功能[22]。
3 EVs治疗POI的机制
多项动物实验证实,各种干细胞来源的EVs 可通过不同机制对POI 起到治疗作用。具体机制及治疗效果可见表1[21,23-34]。
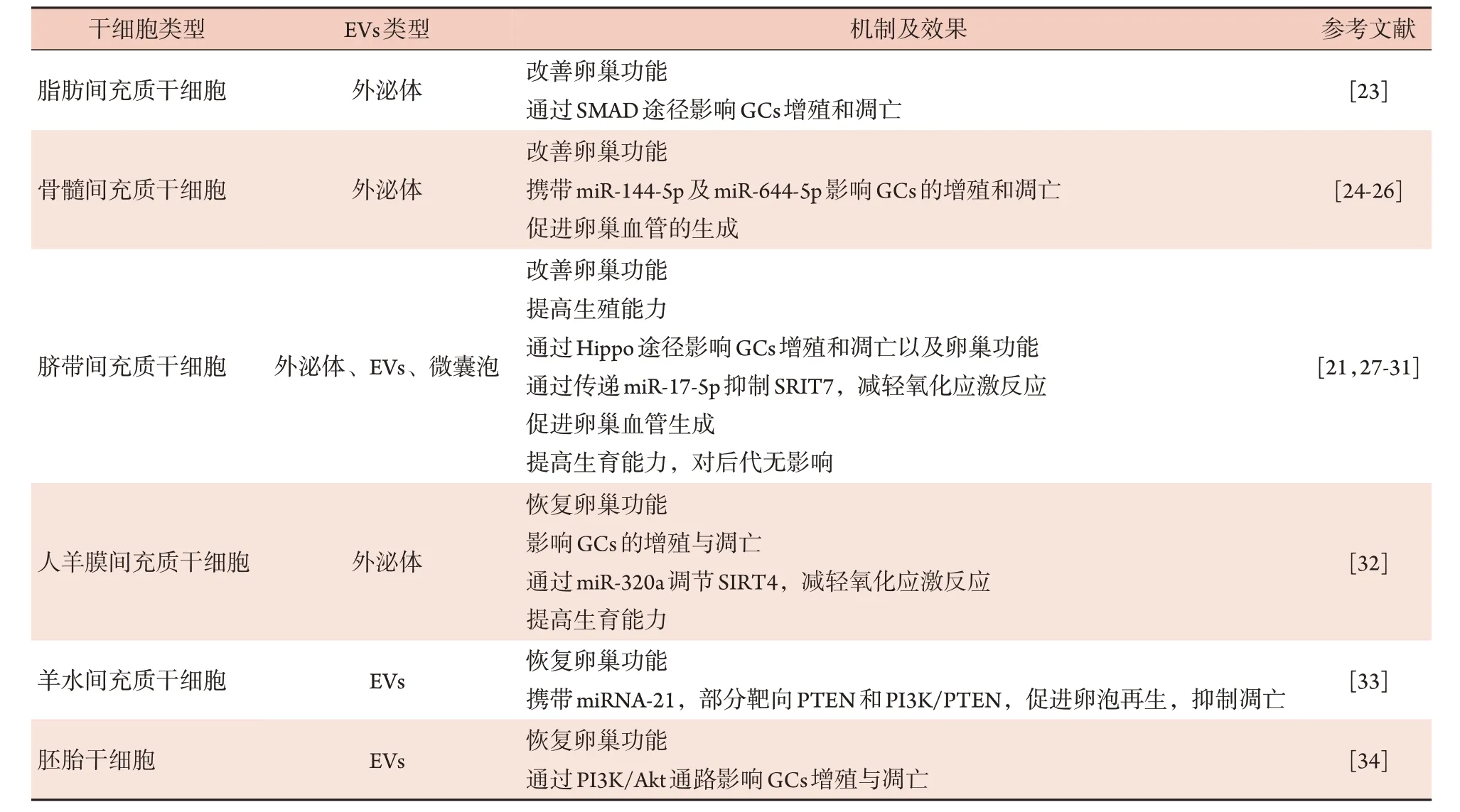
表1 不同干细胞来源的EVs治疗早发性卵巢功能不全的机制及效果Tab.1 Mechanism and effect of extracellular vesicles from different stem cells in treatment of POI
3.1 改善卵巢功能 EVs 及其携带的活性物质可恢复损伤卵巢的重量及形态、增加卵泡数量、调节激素分泌及改善异常发情周期。Huang 等[23]将人脂肪间充质干细胞来源的外泌体注射到环磷酰胺(cyclophosphamide,CTX)诱导的POI 模型小鼠卵巢中,4周后卵巢卵泡数量明显增多,雌二醇(E2)和抗缪勒管激素水平升高,FSH 水平下降。另一项研究则是通过腹腔注射将骨髓间充质干细胞来源的外泌体移植入CTX诱导的化疗源性POF大鼠模型中,结果发现POF 大鼠发情周期及激素水平恢复正常,健康卵泡数量增加,卵巢功能得到改善[24]。也有学者将人脐带造血干细胞来源的EVs 分离鉴定后经尾静脉注入POI模型小鼠,结果显示小鼠体重明显增加,卵巢质量提高,卵母细胞及胚胎数增多,E2水平升高,FSH 水平降低[27]。羊水间充质干细胞(amniotic fluid mesenchymal stem cells,AFMSCs)是从羊水中获取的干细胞。Thabet 等[33]证实,AFMSCs 来源的EVs与AFMSCs 一样,可恢复激素水平及发情周期,且EVs 与AFMSCs 均可通过增强miRNA-21 的表达,降低miRNA-21下游的PTEN和casepase-3的表达,最终改善化疗诱导的卵巢储备功能损伤。
目前,临床前实验研究中大部分EVs 移植是通过原位组织注射或静脉注射两种方式,结果显示EVs均有效[35-37],但两种移植方式的选择仍需进一步探索。一项人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUCMSC)修复化疗性大鼠卵巢损伤模型的研究对比了卵巢注射及尾静脉注射两种移植方式的治疗效果,结果发现静脉注射创伤更小,且有助于修复化疗性的多器官损伤,因而更具优势[38],但EVs 移植是否优先考虑静脉注射仍值得探讨。
3.2 影响卵巢GCs 的增殖及凋亡 POI 患者卵巢生理功能及生殖能力常因卵泡耗竭、闭锁而减弱[29]。卵泡由核心的卵母细胞及周围的GCs 和卵泡膜细胞构成。卵母细胞为生殖细胞,GCs 对卵母细胞有重要的营养和支持作用。GCs分泌包括E2、生长因子、细胞因子在内的多种活性因子,对卵泡的发育至关重要,同时GCs 的凋亡会诱发卵泡闭锁[39]。因此,GCs 对卵泡生长、发育、闭锁极为重要,其增殖与凋亡必然会影响卵巢的生理功能及生育能力。
多项研究表明,干细胞来源的EVs 对GCs 有促进增殖和抑制凋亡的作用。Sun 等[25]发现,骨髓间充质干细胞来源的外泌体通过传递miR-644-5p 靶向p53可抑制卵巢GCs凋亡,并改善卵巢功能。另一项研究证实,GCs 能有效吸收HUCMSC 来源的外泌体,调节凋亡相关的蛋白,从而保护卵巢GCs 免受顺铂诱导的损伤;此外,该研究进一步预测分析显示,microRNA-24、microRNA-106a、microRNA-19b、microRNA-25 可能与细胞凋亡有关[28]。有研究者用CTX 诱导建立小鼠POI 模型后,通过腹腔注射移植HUCMSC来源的外泌体,恢复了小鼠激素水平和发情周期,并通过Hippo 通路恢复了GCs 促卵泡激素受体的表达,从而促进GCs 在体内的增殖,最终改善了POI 小鼠的卵巢功能[29]。Zhang 等[21]将HUCMSC衍生的EVs 加入顺铂诱导的GCs 化疗损伤模型中进行培养,结果显示EVs 成功整合到GCs 中,并通过调节Bcl-2/Bax 比例和抑制caspase-3 介导的凋亡级联反应保护了GCs 免受化疗诱导的损伤,提示EVs 在GCs合成和分泌类固醇激素过程中发挥了重要作用。一项探讨月经血源性基质细胞(menstrual bloodderived stromal cells,MenSCs)衍生外泌体对POI 影响的研究将分离出的外泌体经尾静脉注入经4-乙烯基环己烯二环氧化物(VCD)诱导的SD 大鼠POI 模型中,结果显示,MenSCs衍生外泌体可促进卵泡发育及GCs 增殖,抑制GCs 凋亡,且该外泌体具有卵巢皮质倾向性,可调节卵巢生理功能及卵巢微环境[40]。经尾静脉注射来源于胚胎干细胞的EVs 可恢复POF模型小鼠的卵巢功能,并通过激活PI3K-Akt 通路促进GCs增殖,抑制GCs凋亡[34]。
3.3 促进卵巢血管的形成 卵巢功能依赖复杂的卵巢血管系统和持续性的血管重塑,以为卵泡和黄体提供所必需的营养、氧气及激素支持[41]。优势卵泡的产生也与初级卵泡中丰富的血管网络有关[31]。由此可见,促进卵巢血管形成及重塑对POI 的治疗具有重要作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)、胰岛素样生长因子1(insulinlike growth factor-1,IGF-1)、血管生成素是重要的血管生成因子,尤其是血管生成素可明显刺激新生血管生成,从而参与卵泡的发育[42]。Yang 等[31]从HUCMSC 内提取出MVs 作用于POI 模型小鼠,结果发现,HUCMSC-MVs 移植后血管生成因子(包括VEGF、IGF-1、血管生成素)表达水平明显升高,且可能通过PI3K-Akt 通路诱导血管生成来恢复卵巢功能。此外,Park 等[26]用骨髓间充质干细胞的条件培养基(MSC CM)处理人卵巢内皮细胞,结果发现,MSC CM 可促进卵巢内皮细胞的增殖及血管生成标记物的表达,并通过PI3K-ALK 通路促进血管生成,且采用小管形成实验验证了MSC CM 对卵巢内皮细胞成血管能力的促进作用。但该研究未对培养基的具体作用成分进行分析。此外,考虑到血管生成可促进肿瘤生长,EVs 的促血管作用是否有致癌作用值得进一步探讨。
3.4 减轻氧化应激反应 生理状态下,活性氧(reactive oxygen species,ROS)与抗氧化剂保持平衡状态,当ROS 过量导致平衡被打破时,机体产生氧化应激反应(oxidative stress,OS),使卵泡发生衰老[43],因此,氧化应激可能是多种生殖疾病的启动因素,并参与卵泡闭锁、减数分裂异常等病理过程[44]。在各种表观遗传事件中,microRNA是控制氧化应激和细胞衰老的重要参与者[45]。目前已有研究证实,外泌体可通过传递microRNA抑制ROS的积累,进而改善卵巢功能。Ding 等[30]证实,来源于人脐带干细胞的外泌体可通过miRNA-17-5p的表达下调SIRT7及下游靶基因(PARP1、γH2AX、XRCC6)的表达,抑制ROS 的积累,改善POI 患者的卵巢功能,且其作用具有剂量依赖性。而人羊膜间充质干细胞来源外泌体中的miRNA-320a则可通过抑制GCs和卵母细胞中的氧化应激调节因子STRT4来降低ROS的水平[32]。
3.5 对生育能力及后代的影响 生育能力的恢复及后代的健康问题是育龄期POI 患者关注的重点。Li等[28]发现,HUCMSC 来源的外泌体可提高POI 小鼠的妊娠率,增加后代数量并缩短怀孕时间。Liu等[27]首次利用体外受精和交配实验检测POI 小鼠的生育能力,并评估其在接受HUCMSC EVs 移植后子代的情况,结果发现EVs 移植增加了卵母细胞和胚胎的数量,缩短了小鼠的怀孕时间,且子代小鼠的生长及即时工作记忆和识别记忆均未受到明显影响,提示EVs 治疗并不会导致后代的认知缺陷。但是相关研究仍需更全面、更系统地验证及更长期的随访,以确保其安全性。
4 总结与展望
EVs通过各种机制对POI发挥治疗作用,以上实验研究共同表明EVs 在未来POI 的临床治疗中拥有巨大的潜力。EVs 是一种理想的药物载体,并有望成为干细胞移植的优势替代方法,通过运输miRNA等活性物质恢复卵巢功能、提高生育能力,为POI患者带来了希望。但就目前的研究现状来看,EVs想要实现临床应用,仍存在许多待解决的难题:(1)EVs 携带的活性成分及作用机制研究不全;(2)EVs提取与修饰的技术与标准不规范;(3)给药途径、剂量及标准不确定。此外,EVs 的应用还需更加严谨的临床研究以评估其安全性。总之,EVs 在POI的治疗中表现出巨大的潜力,相信关于EVs的研究将会给POI的临床治疗注入新的活力。
