优化溃结方对溃疡性结肠炎气滞血瘀模型大鼠的影响及其作用机制研究
2024-01-21张帅李娜沈江立柳越冬吴宪树王磊盛天骄徐红俊安胜军
张帅,李娜,沈江立,柳越冬,吴宪树,王磊,盛天骄,徐红俊,安胜军*
1.050091 河北省石家庄市,河北中医药大学
2.712000 陕西省咸阳市中心医院
3.110005 辽宁省沈阳市,辽宁中医药大学附属第三医院
4.021008 内蒙古自治区呼伦贝尔市中蒙医院肛肠科
5.110005 辽宁省沈阳市,解放军北部战区总医院中医科
相关统计资料显示,近年来我国溃疡性结肠炎(ulcerative colitis,UC)患者数量持续增加,发病率约为13.3/100 万[1]。对于UC,临床常采用氨基水杨酸类、糖皮质激素类药物等进行治疗,虽然其近期疗效尚可,但不良反应较大,且经治疗后容易复发。优化溃结方由黄芪、(炒)白术、苍术、青黛、败酱草、白头翁、红花组成,是柳越冬教授用以治疗UC 脾虚湿热证的经验方,疗效确切、证据成链[2-5]。实验研究表明,优化溃结方可有效改善UC 模型大鼠症状,并通过调节细胞外信号调节激酶(extracellular-signal regulated protein kinase,ERK)、白介素1β 等改善肠道炎症[3];网络药理学研究表明,优化溃结方对肠道免疫应答的调控涉及白介素17 免疫信号通路、Toll 样受体信号通路[4-6]。此外,优化溃结方含有益气活血的常用对药黄芪和红花,但其对UC 气滞血瘀型患者的作用机制尚不明确。本研究旨在探讨优化溃结方对UC 气滞血瘀模型大鼠的影响,并通过比较干预后大鼠结肠组织趋化因子受体4(C-X-C chemokine receptor 4,CXCR4)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、转化生长因子激酶1(transforming growth factor kinase 1,TAK1)表达水平而探索其作用机制,以期为临床应用优化溃结方治疗UC 气滞血瘀型患者提供参考。
1 材料与方法
1.1 实验动物及分组
2023 年9—10 月,选取体质量为200~240 g 的SPF级雄性SD 大鼠70 只(西安交通大学医学实验动物中心提供,合格证号:2018-001),采用随机数字表法将其随机分为正常组、模型组、柳氮磺胺吡啶组、低剂量组、标准剂量组、益气组、活血组,每组10 只。所有大鼠饲养于清洁系统内,室温保持在(20±2)℃,相对湿度保持在50%~60%;大鼠的饲养及观察均在咸阳市中心医院实验中心进行;本实验方案经陕西中医药大学实验动物伦理委员会审议并批准(审批号:SUCMDL20231316003)。
1.2 UC 气滞血瘀型模型的建立
采用三硝基苯磺酸(thiobarbituric acid reactive substances,TNBS)/乙醇二次致炎法结合束缚法[2]建立UC 气滞血瘀模型:大鼠适应性饲养1 周后限制其四肢活动度(约8 h/d),造模前禁食不禁水24 h,称重后采用戊巴比妥钠3 mL/kg 进行麻醉,然后将灌胃针自大鼠肛门插至距肛门8 cm 处,采用60 mg/kg TNBS/乙醇溶液缓慢灌肠以诱导急性结肠炎;15 d 后(造模第16 天)采用同样方法进行30 mg/kg TNBS/乙醇溶液灌肠以诱导复发性结肠炎。需要注意的是,两次灌肠后均需注入空气0.5 mL 并使大鼠保持倒立位3~5 min,然后放回饲养笼并保持仰卧位、正常饲养,造模过程中大鼠若有死亡则及时补足。依据大鼠血液流变学指标、疾病活动指数(disease activity index,DAI)评分验证UC 气滞血瘀模型大鼠造模是否成功[2]。
1.3 优化溃结方的制备
本研究所用柳氮磺胺吡啶由上海福达制药有限公司生产,用量为6 g,使用前需加水浸泡一段时间并浓缩、定容至6 mL,之后灌入清洁玻璃容器中,封口、经高压灭菌后于4 ℃条件下冷藏备用,此时柳氮磺胺吡啶药液浓度为1 g/mL。
优化溃结方药物组成:黄芪20 g、(炒)白术15 g、苍术10 g、青黛3 g、败酱草20 g、白头翁15 g、红花10 g。自咸阳市中心医院中药房购买上述中药材后加水浸泡45 min,文火煎煮40 min 后滤取药液,然后加入药渣同体积水继续煎煮30 min 并再次滤取药液,将2 次所得滤液混合并浓缩、定容至93 mL,之后灌入清洁玻璃容器中,封口、经高压灭菌后于4 ℃条件下冷藏备用,此时优化溃结方药液浓度为1 g/mL。60 kg 人与200 g 大鼠药物剂量折算比为 6.25∶1,据此换算得出优化溃结方标准剂量为1.674 g·kg-1·d-1[6-7]。
单独自咸阳市中心医院中药房购买黄芪、红花各10 g,各加水浸泡30 min,文火煎煮40 min 后滤取药液,然后加入药渣同体积水继续煎煮30 min 并再次滤取药液,各将2 次所得滤液混合并浓缩、定容至10 mL,之后灌入清洁玻璃容器中,封口、经高压灭菌后于4 ℃条件下冷藏备用,此时黄芪、红花药液浓度均为1 g/mL。
1.4 干预方法
正常组大鼠在造模时使用0.9%氯化钠溶液灌肠,并与其他组大鼠进行同步抓取、固定,在造模成功后给予等体积水灌胃,1 次/d,共灌胃14 次;模型组大鼠在造模成功后给予等体积水灌胃,1 次/d,共灌胃14 次;柳氮磺胺吡啶组、低剂量组、标准剂量组、益气组、活血组大鼠分别在造模成功后给予柳氮磺胺吡啶药液0.54 g/kg、低剂量优化溃结方药液0.837 g/kg、标准剂量优化溃结方药液1.674 g/kg、黄芪药液1.8 g/kg、红花药液0.9 g/kg 灌胃,均为1 次/d,均灌胃14 次。
1.5 大鼠结肠组织超微结构变化
造模后第15 天处死7 组大鼠并钳取其结肠组织2~3 块(大小:1 mm×1 mm×1 mm),采用2.5%戊二醛、1%锇酸依次固定,切片后采用高精度透射电镜观察结肠组织超微结构变化并摄片、保存。
1.6 大鼠结肠组织CXCR4、VEGFA、TAK1 蛋白表达水平
采用蛋白免疫印迹法(Western blot)检测7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白表达水平:将钳取的大鼠结肠组织块用预冷的磷酸盐(PBS)缓冲液洗涤数次后剪成小块(大小:1 mm×1 mm)并置于匀浆管中,再放入1~2 个3 mm 的匀浆珠并倒入提前制备的10 倍于结肠组织块体积的裂解液,并进行匀浆处理;若要制备高浓度蛋白,放入少量裂解液即可。上述操作结束后及时取出匀浆管,放置于冰上0.5 h,每隔3~5 min 震荡1 次以使样本充分裂解,然后于4 ℃条件下低速离心10 min,离心力为14000×g;最后收集蛋白溶液并进行浓度测定、蛋白变性、电泳等。大鼠结肠组织CXCR4、VEGFA、TAK1 蛋白表达水平以灰度比值表示。
1.7 大鼠结肠组织CXCR4、VEGFA、TAK1 mRNA表达水平
采用荧光定量PCR 检测大鼠结肠组织CXCR4、VEGFA、TAK1 mRNA 表达水平:将大鼠结肠组织匀浆、研磨后提取总RNA,测定浓度及纯度后进行反转录及PCR 检测;采用2-∆∆Ct法计算CXCR4、VEGFA、TAK1 mRNA 相对表达量,CXCR4、VEGFA、TAK1 PCR 引物序列见表1。

表1 CXCR4、VEGFA、TAK1 PCR 引物序列Table 1 PCR primer sequences of CXCR4,VEGFA and TAK1
1.8 统计学方法
采用SPSS 26.0 软件进行统计学分析。计量资料以(±s)表示,多组间比较采用单因素方差分析并进行方差齐性检验,方差齐时两两比较采用LSD-t 分析,方差不齐时采用非参数检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠结肠组织超微结构变化
造模后第15 天正常组大鼠肠上皮细胞未见明显肿胀,细胞膜完整,胞内基质电子密度均一,细胞器丰富;微绒毛排列整齐,局部区域稀疏;肠屏障结构尚可;胞核异染色质增加,核膜模糊;线粒体数量适中,结构尚可;粗面内质网未见明显扩张(图1A)。
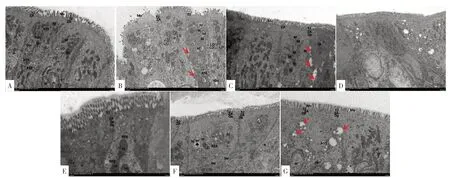
图1 7 组大鼠造模后第15 天结肠组织超微结构变化(投射电镜,×5000)Figure 1 Change of ultra microstructure in colonic tissue in the seven groups after 15 days of the establishing
造模后第15天模型组大鼠肠上皮细胞中重度水肿,细胞器丰富、明显肿胀;微绒毛局部稀疏、紊乱、大量缺失,部分明显肿胀;细胞间紧密连接及中间连接结构不明显,未见明显桥粒结构,细胞间隙明显增加(图1B 箭头所示),肠屏障结构异常。
造模后第15 天柳氮磺胺吡啶组大鼠肠上皮细胞未见明显肿胀,细胞膜完整,胞内基质电子密度均一,细胞器丰富;微绒毛排列整齐,长短均一;细胞间紧密连接结构模糊,中间连接张力丝少量减少,桥粒数量丰富(图1C)。
造模后第15天低剂量组大鼠肠上皮细胞轻度肿胀,细胞膜完整,胞内基质电子密度均一,细胞器丰富;微绒毛排列整齐,数量丰富,略显肿胀;细胞间紧密连接、中间连接及桥粒局部可见、结构清晰,肠屏障结构受损(图1D)。
造模后第15 天标准剂量组大鼠肠上皮细胞线粒体数量适中、未见明显肿胀、基质较为均匀,个别肿胀线粒体基质较多溶解;粗面内质网未见明显扩张、表面可见核糖体附着,肠屏障结构尚可(图1E)。
造模后第15 天益气组大鼠肠上皮细胞中度水肿,微绒毛略显肿胀,排列不整齐,普遍较短;细胞间紧密连接及中间连接结构模糊,细胞间隙狭窄,连接复合体结构正常,肠屏障结构尚可;部分基质较多溶解,嵴部分断裂、消失(图1F)。
造模后第15 天活血组大鼠肠上皮细胞未见明显肿胀,细胞膜完整,胞质内细胞器丰富、结构正常;微绒毛排列整齐、长短均一,无明显萎缩、脱落,局部区域略显稀疏;细胞间可见紧密连接、中间连接、桥粒,多处细胞间隙明显增宽(图1G 箭头所示),连接复合体张力微丝略减少。
2.2 大鼠结肠组织CXCR4、VEGFA、TAK1 蛋白表达水平
7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1蛋白灰度比值比较,差异有统计学意义(P<0.05),见图2、表2。模型组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白灰度比值高于正常组,差异有统计学意义(P<0.05);柳氮磺胺吡啶组、低剂量组、标准剂量组、益气组、活血组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白灰度比值低于模型组,差异有统计学意义(P<0.05);标准剂量组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白灰度比值低于柳氮磺胺吡啶组,差异有统计学意义(P<0.05)。
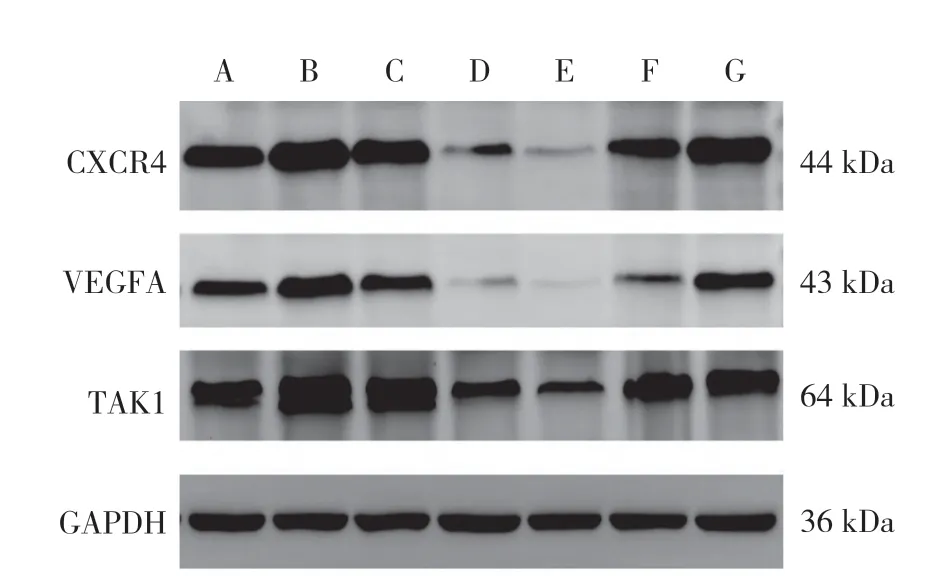
图2 7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白电泳图Figure 2 Electrophoretogram of CXCR4,VEGFA and TAK1 in colonic tissue in the seven groups after intervention
表2 7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白灰度比值(±s)Table 2 Comparison of gray ratios of proteins of CXCR4,VEGFA and TAK1 in colonic tissue in the seven groups after intervention
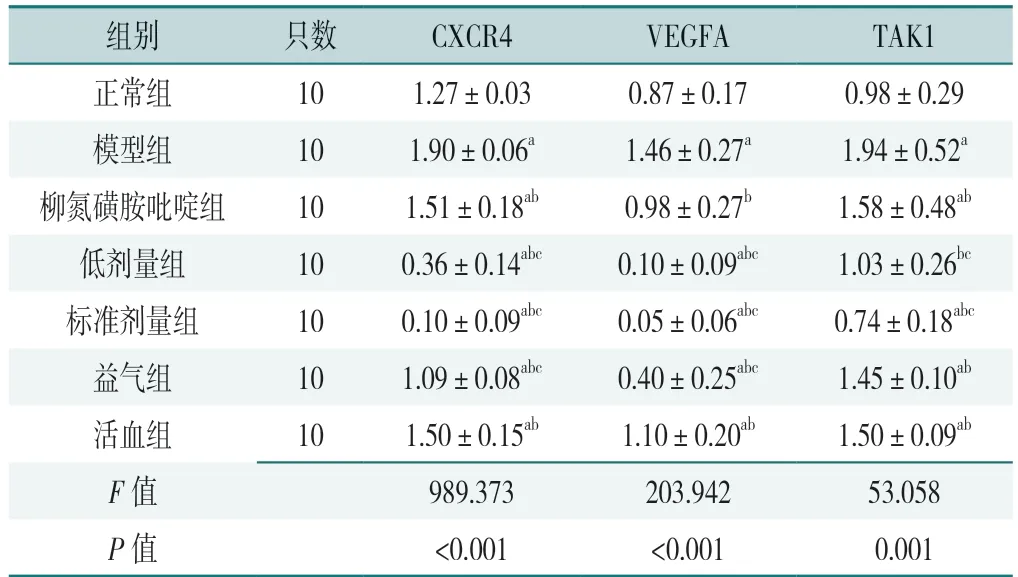
表2 7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白灰度比值(±s)Table 2 Comparison of gray ratios of proteins of CXCR4,VEGFA and TAK1 in colonic tissue in the seven groups after intervention
注:a 表示与正常组相比P<0.05;b 表示与模型组相比P<0.05;c 表示与柳氮磺胺吡啶组相比P<0.05。
组别 只数 CXCR4 VEGFA TAK1正常组 101.27±0.030.87±0.170.98±0.29模型组 101.90±0.06a 1.46±0.27a 1.94±0.52a柳氮磺胺吡啶组 101.51±0.18ab 0.98±0.27b 1.58±0.48ab低剂量组 100.36±0.14abc 0.10±0.09abc 1.03±0.26bc标准剂量组 100.10±0.09abc 0.05±0.06abc 0.74±0.18abc益气组 101.09±0.08abc 0.40±0.25abc 1.45±0.10ab活血组 101.50±0.15ab 1.10±0.20ab 1.50±0.09ab F 值 989.373203.94253.058 P 值 <0.001 <0.0010.001
2.3 大鼠结肠组织CXCR4、VEGFA、TAK1 mRNA表达水平
7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 mRNA 相对表达量比较,差异有统计学意义(P<0.05),见表3。模型组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 mRNA 相对表达量高于正常组,差异有统计学意义(P<0.05);低剂量组、标准剂量组、益气组、活血组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 mRNA相对表达量低于模型组,活血组大鼠干预后结肠组织VEGFA、TAK1 mRNA 相对表达量低于柳氮磺胺吡啶组,差异有统计学意义(P<0.05)。
表3 7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 mRNA 相对表达量比较(±s)Table 3 Comparison of relative mRNA expression quality of CXCR4,VEGFA and TAK1 in colonic tissue in the seven groups after intervention
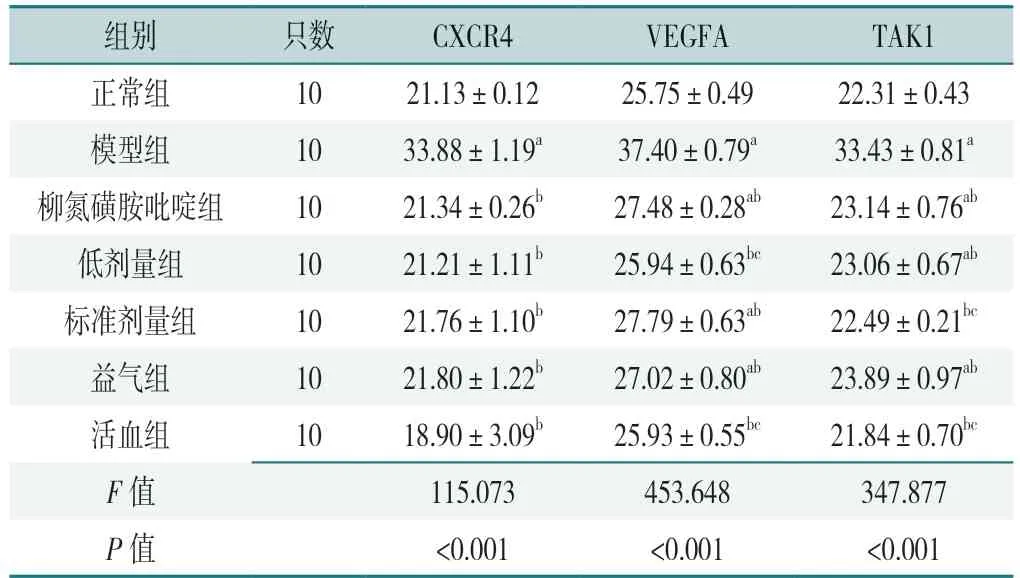
表3 7 组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 mRNA 相对表达量比较(±s)Table 3 Comparison of relative mRNA expression quality of CXCR4,VEGFA and TAK1 in colonic tissue in the seven groups after intervention
注:a 表示与正常组相比P<0.05;b 表示与模型组相比P<0.05;c 表示与柳氮磺胺吡啶组相比P<0.05。
组别 只数 CXCR4 VEGFA TAK1正常组 1021.13±0.1225.75±0.4922.31±0.43模型组 1033.88±1.19a 37.40±0.79a 33.43±0.81a柳氮磺胺吡啶组 1021.34±0.26b 27.48±0.28ab 23.14±0.76ab低剂量组 1021.21±1.11b 25.94±0.63bc 23.06±0.67ab标准剂量组 1021.76±1.10b 27.79±0.63ab 22.49±0.21bc益气组 1021.80±1.22b 27.02±0.80ab 23.89±0.97ab活血组 1018.90±3.09b 25.93±0.55bc 21.84±0.70bc F 值 115.073453.648347.877 P 值 <0.001 <0.001 <0.001
3 讨论
UC 是一种慢性肠道炎性疾病,患者主要临床表现包括腹泻、黏液脓性或血性大便、里急后重、腹痛等,严重影响患者生活质量。目前,UC 的确切发病机制尚不完全明确,临床上尚无根治UC 的药物[3],对于活动期UC 患者,临床治疗以提高患者生活质量、诱导维持临床缓解、促进肠黏膜愈合、预防相关并发症为主。
优化溃结方是柳越冬教授根据UC 的主要病因病机研制的[7-12],贯穿健脾、祛湿、益气、活血的治则,临床用以治疗UC 脾虚湿热证取得良好疗效,已成为治疗UC 的经验方。优化溃结方中败酱草具有清热解毒、祛瘀排脓功效,白头翁具有清热解毒、凉血止痢功效,共为君药;黄芪具有补气固表、托毒排脓、利尿、生肌功效,为臣药;红花具有活血通经、去瘀止痛功效,青黛具有清热解毒、凉血功效,共为佐药;(炒)白术具有健脾益气、燥湿利水功效,苍术具有燥湿健脾、祛风散寒功效,共为使药;全方药物配伍,共奏健脾除湿、行气活血、清热、止痛之功。
CXCR4 属于趋化因子受体亚家族,广泛表达于多种细胞和组织。CXCR4激活后不仅可通过核因子(nuclear factor,NF)-κB 信号通路促进细胞迁移和炎性细胞活化,也可促进JAK/STAT 信号通路的激活并进一步调控免疫细胞的迁移和活化;此外,CXCR4 与基质细胞衍生因子1(stromal cell-derived factor-1,SDF-1)结合后还会趋化炎性细胞穿过血管内皮到达炎症部位。研究表明,UC 患者外周血CD4+T 淋巴细胞CXCR4 表达水平明显高于健康人,通过SDF-1/CXCR4 信号轴可促进表达CXCR4 的CD4+T 淋巴细胞沿着受损结肠组织中的SDF-1 浓度梯度迁移至损伤部位,进而发挥免疫抑制作用,而CXCR4 的特异性拮抗剂T140 可通过阻断SDF-1/CXCR4 信号轴减轻葡聚糖硫酸钠诱导的结肠炎模型大鼠的炎性反应,并抑制促炎性细胞因子的产生[6]。VEGFA 是促进血管生成的关键因子,也是UC发生发展过程中的重要促炎性细胞因子之一。有研究表明,UC 患者体内活化血小板的α 颗粒释放血管生成调节蛋白可促进VEGF 的表达,进而加重炎性反应[4]。TAK1 属于MAP3K 家族,具有丝氨酸/苏氨酸蛋白激酶活性,是NF-κB 信号通路中的重要调节因子。研究表明,TAK1 激活后不仅可促使NF-κB 核转位并调节靶基因转录,进而引发炎性反应,还可通过激活JAK/STAT 信号通路参与细胞增殖、巨噬细胞激活及炎性反应[5]。上述信号通路之间的交叉调控与相互作用使得VEGFA、TAK1、CXCR4 在UC 的发生、发展中发挥着重要作用,但具体的信号通路交叉机制可能因细胞类型、疾病状态和微环境不同而有所变化[6,13-15]。
实验研究表明,优化溃结方能有效降低TNBS/乙醇诱导的UC 大鼠结肠组织促炎性细胞因子白介素1β、肿瘤坏死因子(tumor necrosis factor,TNF)-β1 表达水平,提高结肠组织VEGF 表达水平,进而抑制肠道炎性反应,促进肠道受损黏膜修复与溃疡愈合[16]。基于已知蛋白质相互作用(protein-protein interaction,PPI)网络或分子相互作用数据库的预测算法表明,优化溃结方中药物成分主要通过CXCR4、VEGFA、TAK1 等靶蛋白及炎症、免疫等相关的关键信号通路发挥治疗作用。本研究结果显示,柳氮磺胺吡啶组、低剂量组、标准剂量组、益气组、活血组大鼠干预后结肠组织CXCR4、VEGFA、TAK1 蛋白灰度比值及mRNA 相对表达量均低于模型组,活血组大鼠干预后结肠组织VEGFA、TAK1 mRNA 相对表达量低于柳氮磺胺吡啶组,提示优化溃结方及其益气、活血组分可有效降低UC 气滞血瘀模型大鼠CXCR4、VEGFA、TAK1 表达水平,分析其作用机制可能如下:黄芪含有黄酮类化合物、多糖类、氨基酸、三萜类化合物等活性成分,不仅可通过抑制VEGFA 而减少结肠组织血管供应,还可通过抑制TAK1 信号通路而减轻结肠组织损伤;红花含有羟基香豆素、芸香甙、胡萝卜素、红花黄酮等活性成分[17],对血管生成过程中关键信号分子VEGF 和血管细胞黏附分子1(vascular cell adhesion molecule-1,VCAM-1)表达水平具有调节作用[18-19],可通过下调VEGF 和VCAM-1 表达水平而抑制新生血管形成、氧化应激反应等[20-21]。需要指出的是,由于前期研究已证实标准剂量的优化溃结方即具最佳疗效,增加剂量不仅不会明显提升疗效,反而会增加皮肤发红、皮疹等不良反应发生风险[7-12],因此本研究不再进一步探讨优化溃结方的剂量问题,更多的是关注其药物组成、配伍及作用机制等,未再设置加倍剂量组等。
细胞超微结构线粒体数目和核糖体脱颗粒变化可以反映细胞活性与活力变化。一般情况下,细胞能量代谢减弱或细胞凋亡会导致线粒体数目减少或结构破坏,而蛋白质合成减缓或停止则会导致核糖体脱颗粒。因此,通过透射电镜观察结肠组织线粒体数目和核糖体脱颗粒变化可用以评估和监测肠黏膜损伤情况。此外,细胞超微结构高尔基体的主要功能是对蛋白质进行修饰和分泌,高尔基体囊膜轻度扩张可能是细胞负荷过大或发生某些病理变化的表现,常见于蛋白质分泌增加、感染或缺氧等。本研究结果显示,造模后第15 天模型组大鼠肠上皮细胞中重度水肿,细胞器丰富、明显肿胀;微绒毛局部稀疏、紊乱、大量缺失,部分明显肿胀;细胞间紧密连接及中间连接结构不明显,未见明显桥粒结构,细胞间隙明显增加,肠屏障结构异常,提示UC 气滞血瘀模型大鼠造模成功;低剂量组、标准剂量组大鼠结肠组织超微结构趋于正常,但存在不同程度的肠屏障结构受损;益气组大鼠结肠组织超微结构中存在线粒体损伤,但活血组大鼠结肠组织超微结构中未发现线粒体损伤,分析其原因如下:黄芪活性成分黄芪素等可能会诱发线粒体损伤,而红花活性成分具有抗氧化、抗炎和保护细胞膜等作用,优化溃结方中同时使用黄芪、红花,在保证疗效的前提下减少了对线粒体的损伤,配伍科学、合理,安全性较高。
中医理论认为,气血是人体生命活动的基础。《血证论》阴阳水火气血论有言:“人之一身,不外阴阳,而阴阳二字,即是水火,水火二字,即是气血”。《医林改错》[21]中有言:“治病之要诀,在明白气血,无论外感、内伤,要知初病伤人何物,不能伤脏腑,不能伤筋骨,不能伤皮肉,所伤者无非气血。”在UC 等胃肠疾病治疗过程中,中医重视调畅气血,常会在具有活血化瘀功效的方剂(如血府逐瘀汤、膈下逐瘀汤)中加用一些补气行气之品,如当归、黄芪、党参、甘草、白术等,也会在具有益气功效的方剂中加用一些活血化瘀之品,如桃仁、红花、乳香、没药、蒲黄、五灵脂、麝香、赤芍、丹皮等。肠道免疫是机体免疫系统的重要组成部分,有研究发现黄芪多糖可促进肠道上皮细胞分化和免疫球蛋白A 的生成,进而增强肠道屏障功能,保护肠道黏膜免受有害物质、细菌等的侵袭[22];此外,黄芪多糖还可以提高小鼠肠道前列腺素E2 含量,进而促进肠道免疫细胞生长和增殖[23]。因此,笔者推测优化溃结方中的益气组分具有调理脾胃、增强肠道免疫功能及肠道屏障功能等作用,活血组分具有改善肠道黏膜微循环、平调气血等作用,配伍使用有利于促进UC 患者结肠组织损伤及肠上皮细胞的修复,益气组分与活血组分具有一定协同增效作用。
综上所述,优化溃结方及其益气、活血组分可有效降低UC 气滞血瘀模型大鼠结肠组织CXCR4、VEGFA、TAK1 表达水平,其治疗作用可能是益气组分、活血组分通过协同调节结肠组织中CXCR4、VEGFA、TAK1 表达水平而实现的。目前优化溃结方的具体化学成分尚未完全明确,需要进一步探索,而随着近年来对肠道菌群与肠道炎症、肠道屏障功能关系的研究深入,优化溃结方对肠道菌群的调节作用也是未来研究方向之一,并有可能为深入了解其治疗作用及作用机制研究等提供新的思路。
作者贡献:张帅、李娜提出研究目标,负责研究的构思与设计,数据收集与论文撰写;沈江立、柳越冬、吴宪树、王磊、盛天骄负责数据录入及统计分析;徐红俊负责文章的审校;张帅、李娜、安胜军负责文章的质量控制与审校,对文章整体负责。
本文无利益冲突。
