输尿管软镜引导腹膜透析管置入的比较研究*
2024-01-20韩孝洲刘剑新田长海胡华军
韩孝洲 赵 诚 邱 瑾 刘剑新 林 钐** 张 勇 田长海 刘 旺 胡华军
(上海中医药大学附属上海市中西医结合医院泌尿外科,上海 200082)
腹膜透析(peritoneal dialysis,PD,简称腹透)是终末期肾病(end stage renal disease,ESRD)有效的肾脏替代治疗方式之一,由于其对血流动力学影响较小、居家即可进行透析操作,在患者中的接受度较高[1]。常规切开置管应用金属导丝引导腹透管置入,术者不能观察到腹腔内全貌,包括腹透管头端所需要放置的直肠膀胱陷凹/直肠子宫陷凹,容易造成导管位置不正确或损伤腹腔内脏器。为了更加安全、准确地留置腹透管,我们采用输尿管软镜代替导丝引导腹透管置管,效果满意。本研究回顾性分析2019年5月~2023年3月54例ESRD腹透管置管的资料,其中常规导丝引导23例,软镜引导31例,探讨输尿管软镜代替导丝引导的应用价值。
1 临床资料与方法
1.1 一般资料
纳入标准:ESRD选择腹透行腹透管置入;术前无腹腔感染及全身感染;术前未应用抗凝及活血药物。
排除标准:非首次留置腹透管;既往有腹部手术史;联合其他手术;合并未经控制的恶性肿瘤;合并血液系统疾病或凝血功能障碍。
本组54例,男30例,女24例。年龄44~73(58.8±8.2)岁,体重指数17.9~25.7(21.3±1.8)。ESRD原因:糖尿病肾病25例,高血压肾病13例,肾小球肾炎7例,其他疾病9例。术前血清肌酐664~1086(849.2±106.5) μmol/L(正常参考值男性57~111 μmol/L,女性41~81 μmol/L)。责任医生将2种置管方式及特点充分告知,导丝引导置管是最传统和基本的方式,成功率和安全性都很高,软镜引导置管为近年创新的方式,需要增加内镜使用费,由患者选择手术方式。软镜组31例,常规组23例,2组性别、年龄、体重指数、ESRD原因和术前肌酐差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 2组基本资料比较
1.2 手术方法
2组术者为同一人,助手为同一医疗组成员。
常规组:去枕仰卧位,腹部手术区域消毒,铺无菌巾。以距离耻骨联合上方11 cm处的腹中线旁开2 cm为切口中心点,20%盐酸利多卡因5 ml沿中心点上下纵行5 cm皮下局部浸润麻醉。切开皮肤、皮下组织和腹直肌前鞘,血管钳钝性分开腹直肌,切开腹直肌后鞘,分离腹膜外脂肪,显露腹膜并做0.6 cm纵切口,距离腹膜切口周围1.0 cm处穿入连续缝合线留作荷包结扎线。将前端呈135°的弧形硬质金属导丝插入腹透管内,导丝前端距离腹透管腹腔端内约3 cm,将腹透管紧贴腹壁向腹腔内推送,至有阻力感或患者有排尿或排便感时退出导丝。排出腹腔内空气,向腹腔内灌注腹透液200 ml,如腹透液呈线状流出,则将荷包缝线结扎固定腹透管;如腹透液引流不畅,则用导丝调整腹透管位置,或拔出腹透管、插入导丝后重新置管,直至腹透液呈线状流出,证实置管成功。荷包缝线结扎固定腹透管后,缝合腹直肌后鞘,将第1个涤纶套纵行放置于腹直肌内,缝合腹直肌前鞘。隧道扩张器做皮下隧道,将第2个涤纶套放置在距离皮肤出口3 cm处。缝合皮下组织和皮肤,无菌纱布覆盖切口,腹透管外接钛接头、腹透短管以及接口保护套,腹部腹带加压包扎。
软镜组:腹透管置入前操作同常规组。7.5Fr输尿管软镜代替导丝插入腹透管内,软镜前端与腹透管腹腔端平齐,在软镜直视下将腹透管紧贴腹壁送入直肠膀胱陷凹(男性)或直肠子宫陷凹(女性),软镜观察有无腹腔内出血、脏器损伤和粘连等异常,如有则进行相应处理。退出软镜,排出腹腔内空气,判断置管成功方法和后续操作同常规组。
1.3 腹透方法
使用Baxter公司1.5%或2.5%葡萄糖乳酸盐透析液,双联系统管路。术后回病房当日开始小剂量腹透,每次500~1000 ml腹透液进腹,保留2~3 h后放出,每日8次。术后7日转为正常剂量(2000 ml/次,每日3~4次)腹透,依据血肌酐水平选择日间不卧床腹透或持续性不卧床腹透[2]。
1.4 术后护理与随访
住院期间切口隔日更换敷料,保持切口干燥清洁;术后3~7日出院,出院前摄腹部平片(KUB)明确腹透管位置。术后2周复查血肌酐,每月门诊或电话随访一次。
1.5 观察指标
置管成功率(腹透管置入腹腔,腹透液进出通畅),手术时间(手术记录单),术中术后出血和术后输血,术后止痛药用药情况,切口愈合情况,术后2周肌酐下降值,术后腹透管漂移、腹透管阻塞、腹透液渗漏、腹腔感染等腹透管相关并发症。
1.6 统计学方法
采用SPSS25.0软件对数据进行统计分析。计量资料以均数±标准差表示,采用独立样本t检验;计数资料采用χ2检验。P<0.05为差异具有统计学意义。
2 结果
2组均成功置入腹透管,术中均无明显出血。软镜组术中见2例大网膜与腹壁粘连,1例肠管与腹壁粘连,均通过软镜工作通道置入钬激光光纤成功进行粘连分解。2组术中局麻耐受性均较好,软镜组1例术后曲马多50 mg止痛一次,常规组1例术后吲哚美辛栓100 mg止痛一次,1例曲马多50 mg止痛一次,其余术后均未使用止痛药。术后切口愈合良好,无红肿、渗血及感染。
2组观察指标比较见表2。2组手术时间、术后应用止痛药、术后2周肌酐下降值、随访时间差异均无统计学意义(P>0.05)。软镜组腹透管相关并发症总发生率低于常规组(P<0.05),但各并发症发生率2组差异无统计学意义(P>0.05)。常规组2例术后腹透液引流稍红,予药物止血治疗2天治愈,2组均无输血。软镜组1例术后2周腹透管漂移,常规组2例出院前、1例术后3周腹透管漂移,经缓泻通便治疗、按摩法、下楼梯法、踮脚法以及连续踮脚灌液法等保守方式成功复位;常规组1例术后2周腹透管漂移,经上述保守方式不能复位,在腹腔镜下成功复位。软镜组1例术后3个月腹透管阻塞伴腹腔感染,常规组1例术后3个月腹透管阻塞、1例术后2个月腹透管阻塞伴腹腔感染,均经腹透管冲洗和抗感染治疗治愈。2组术后中位随访时间10个月(3~24个月),均未见腹透液渗漏、肠穿孔、腹腔内出血等并发症。
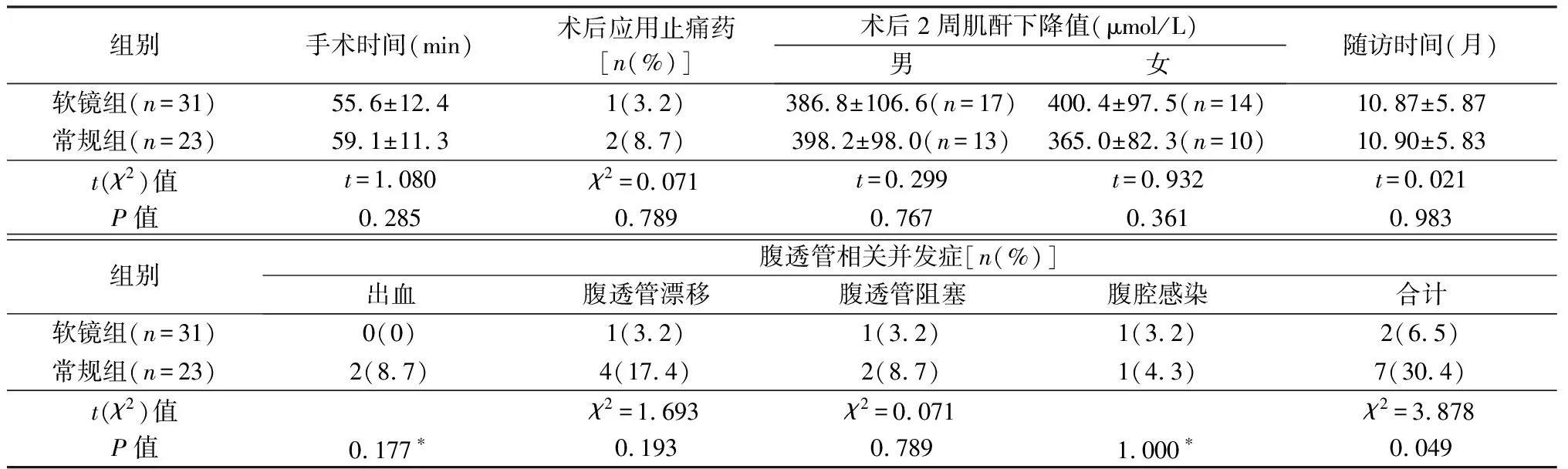
表2 2组观察指标比较
3 讨论
腹透是ESRD重要而有效的肾脏替代治疗方式之一[3],具有简便、安全、有效和可居家治疗的优点,在全世界尤其是发展中国家得到广泛应用[4~6]。安全有效地建立腹透通路,是保证腹透长期顺利进行的关键[1]。腹透通路的建立主要有手术切开置管、经皮穿刺置管(Seldinger法)和腹腔镜置管[7~9]。
手术切开置管是腹透置管医生必需掌握的基本术式,具有操作时间较短、对设备要求低、成本效益高的优点,在临床中的应用最为广泛[10];缺点在于置管时不能观察到腹腔内全貌,置管操作依靠术者手感,导管定位不易准确。Seldinger法具有切口小、操作时间短、患者疼痛轻的优点,特别适合于紧急启动的腹透[11];缺点在于盲视下操作穿刺针和扩张鞘有损伤腹壁血管和腹腔器官的风险,B超或X线辅助Seldinger法能够减少上述并发症的发生率[12,13]。腹腔镜置管在镜下操作,可以确保腹透管位置正确[14],并且能够发现和处理腹腔内合并的疾病[15],特别适合肥胖或者既往有腹部手术史的患者;缺点是需要具备腹腔镜设备,需要全身麻醉,手术操作复杂,腹壁切口多,增加了麻醉风险和出血、腹透液渗漏、腹壁疝等并发症的风险[16,17]。
近年来,输尿管镜在临床广泛应用[18]。有学者[19,20]采用输尿管硬镜辅助Seldinger法放置腹透管,在穿刺套管针进入腹腔后,将输尿管硬镜插入穿刺鞘内,确保穿刺鞘位置正确后,再置入腹透管;然而该方法需要具备Peel-Away穿刺套管器材,且套管针在穿刺进入腹腔时仍为盲操作,有损伤腹壁血管和腹腔脏器的风险。受输尿管软镜技术在泌尿外科应用的启发[21,22],为了更加安全方便地留置腹透管,我们在手术切开置管的基础上采用输尿管软镜代替金属导丝引导腹透管置管,取得了良好的效果。本研究显示,软镜引导腹透管置管的手术时间短于常规手术切开置管,原因可能在于常规置管组导管置入后腹透液灌注试验提示部分腹透管位置不佳,需要重新操作。软镜引导置管将切开置管与腹腔镜置管两者的优点集中,在软镜监视下引导腹透管进入腹腔,能够准确地将腹透管放置到直肠膀胱陷凹(男性)或直肠子宫陷凹(女性),并避免腹透管对腹壁和腹腔脏器的损伤。输尿管软镜具有可视、引导和治疗多重作用,不仅可以引导腹透管放置到正确位置,而且可以观察到腹腔内的粘连、出血等异常情况并及时进行处理。本研究中软镜组3例置管时见腹腔内肠管或大网膜与腹腔前壁粘连,均通过软镜工作通道插入钬激光光纤将粘连部位成功松解。本研究软镜组腹透管相关并发症的总发生率低于常规法(6.5% vs.30.4%)。常规法腹透管相关并发症主要为腹透管漂移[23~25],漂移最常见的原因是导管置入位置不佳,而软镜置管可以在监视状态下确保将腹透管置入到正确的位置,因此减少腹透管漂移。
综上,输尿管软镜代替导丝引导腹透管置入是一种安全、可视、定位准确的置管方式,可以降低腹透管相关并发症,发现并处理腹腔内合并症,值得在临床中应用。
