运用价层电子对数判断分子构型及π键
2024-01-19李军
李 军
(北京市十一学校)
在《普通高中化学课程标准》(2017年版2020年修订)中,提出了化学学科的五个核心素养,“证据推理与模型认知”是其中之一,即模型是化学学科重要的分析、解决问题的方法。关于分子空间结构的内容要求是:“几何实例了解共价分子具有特定的空间结构,并可运用相关理论和模型进行解释和预测。”价层电子对互斥理论是培养学生模型认知的非常好的载体,学生在学习过程中能够充分体会模型是对客观世界的简单描述,是为了预测、解释客观世界的一种阐释,是人类思维创造的结果。
“结构决定性质,性质反映结构”,主族元素原子的最外层电子也就是价电子比较容易影响元素的化学性质,最外层电子数也和物质的空间结构有一定联系。近年来,有关分子或离子中大π键的判断屡次出现在高考化学试题中。价层电子如何书写,价层电子如何影响分子的空间结构,又如何运用价层电子解释并推测分子的空间结构和化学键?如何快速确定分子或离子中的大π键?本文通过价层电子将这些问题一一呈现,让读者借助简单的价层电子便可掌握从电子式书写到分子空间结构、杂化类型及化学键一系列知识。
一、电子式的由来及电子式的书写
1.电子式的由来:主族元素的性质由原子的最外层电子即价电子决定,为了强调最外层电子的重要性,在元素符号周围用“·”或者“×”来表示元素原子的最外层电子。结合稀有气体的稳定结构,演变出了现在的电子式。
2.原子的电子式书写规则:主族元素的价电子为s、p层电子,最多为8个。按照价电子排布式,把原子的最外层电子全部排在元素符号周围,在元素符号上、下、左、右四个方向写上电子,每个方向一般不超过2个电子,电子式可写为:
或者书写其激发态,当少于4个的时候每个方向先各排一个,多于4个则每个方向先各排一个然后再逐一成对。
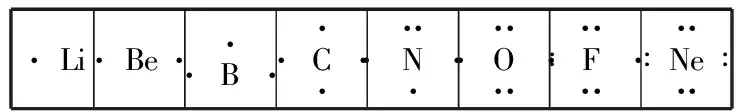
·Li·Be··B···C····N·····O·····∶F·····∶Ne····∶
二、价层电子对互斥理论
单个原子因为存在单电子所以不稳定,非金属原子之间可通过共用电子形成共价键降低能量。价层电子对互斥理论认为,分子的空间结构是中心原子周围的“价层电子对”互相排斥的结果,即价层电子对在空间上尽可能远离。“价层电子对”是指分子中的中心原子与结合原子间的σ键电子对和中心原子上的孤电子对。多重键只计算其中的σ键电子对,不计算π键电子对。
(一)用价层电子对互斥理论确定分子或离子空间构型的一般步骤
(1)确定分子或离子的价层电子对数;
(2)根据价层电子对数确定价层电子对的空间构型(VSEPR模型);
(3)略去VSEPR模型中心原子上的孤对电子即可得到分子或离子的空间构型。
(二)价层电子对的计算方法
价层电子对数(VP)、成键电子对数(BP)和孤电子对数(LP)基本关系:VP=BP+LP。
对于分子ABx,BP可由化学式直接确定:BP=中心原子结合的电子数=σ键电子对数,即电子对数为x。

(三)杂化类型
杂化轨道理论是一种价键理论,指原子内部能量相近的原子轨道重新组合生成与原子轨道数目相等的一组新轨道的过程,因为杂化轨道只能用于形成σ键或者用来容纳孤对电子,所以杂化轨道数等价于价层电子对数,所以杂化类型可以根据价层电子对进行判断。
杂化类型和VSEPR模型均由价层电子对数确定,杂化轨道数目和价层电子对数相等,价层电子对有几对,杂化轨道就有几个。
三、π键数及大π键的确定
(一)π键形成条件
(1)所有参与形成π键的原子在同一平面上。中心原子只能采取sp或sp2杂化。
(2)所有参与形成π键的原子必须提供一个或两个相互平行的p轨道。
(3)形成π键的p电子总数小于p轨道数的两倍。
(二)π键数的计算
对于分子ABx,π键计算:π键数=总键数-σ键数。

(三)大π键
由三个或三个以上的原子上互相平行的p轨道连贯地“肩并肩”重叠在一起形成的π键叫大π键。大π键电子在参与成键的多个原子形成的分子或离子骨架中运动。
(四)计算及表示方法
方法一:计算法,第一步:确定分子中总价电子数;第二步:画出分子中σ键及不参与成键的孤对电子数;第三步:总价电子数减去这些σ键电子数和孤对电子数,剩余的即为填入离域π键的电子数。
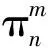
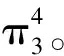
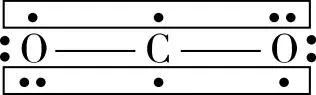
方法二:等电子体法,等电子体是指原子数、价电子数相等的分子或离子。等电子体之间往往具有相同的结构特征,这里的“结构特征”既包括分子的立体结构,又包括化学键的类型。
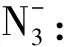
沿着微粒→BP→LP→VP→杂化类型→空间构型→π键数→大π键的思路逐一分析,就可以很好地解决高考中的空间构型、杂化轨道类型及π键问题。
具体举例如表:

分子BPLPVP杂化形式分子空间构型总键数σ键数π键数大π键CO2202sp直线形4222Π43SO3303sp2平面三角形431Π64SO2213sp2V形321Π43CH4404sp3正四面体形4400NH3314sp3三角锥形3300H2O224sp3V形2200
四、高考题再现
【例1】(2023年湖北卷,9题)价层电子对互斥理论可以预测某些微粒的空间结构。下列说法正确的是
( )
A.CH4和H2O的VSEPR模型均为四面体
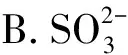
C.CF4和SF4均为非极性分子
D.XeF2与XeO2的键角相等
【答案】A
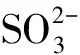
【例2】(2023年山东卷,16题节选)
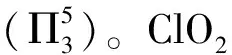
【答案】sp2> ClO2中存在大π键,Cl2O中只存在σ键,所以ClO2中Cl—O键键长较短
【解析】由于ClO2分子中存在5电子3中心的大π键,而Cl原子与2个O原子还分别形成σ键,所以Cl原子未成键电子数为2,即1个孤电子对,所以Cl原子价层电子对数为3,则其杂化方式为sp2杂化。Cl2O分子中O原子核外有2个孤电子对,所以杂化方式为sp3,所以键角:O—Cl—O>Cl—O—Cl。ClO2分子中既存在σ键又存在大π键,而Cl2O中只存在σ键,所以ClO2中Cl—O键键长较短。

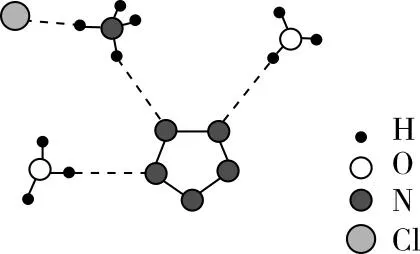

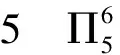

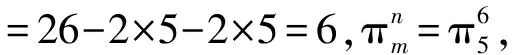
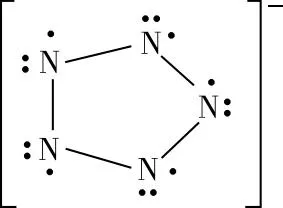
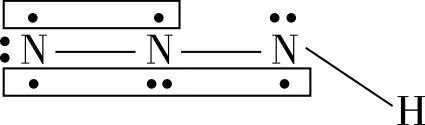
【变式2】叠氮酸的结构式如下,其中存在的大π键应表示为什么?

五、总结
通过对常见微粒的空间构型和价层电子对数计算的理解,学生熟练掌握价层电子对理论这一重难点知识,能够进行轨道杂化类型和π键及大π键推理以及对陌生微粒空间构型的分析,提升学生的理解能力。
