菌酶协同转化白酒丢糟制备微晶纤维素及Nisin工艺条件优化
2024-01-19张小利黄银峰张鹏翔张华应李雅丽巩东辉白果云
张小利,黄银峰,张鹏翔,张华应,李雅丽,巩东辉,白果云
(1.内蒙古科技大学 生命科学与技术学院,内蒙古 包头 014010;2.内蒙古自治区生物质能源化利用重点试验室,内蒙古 包头 014010;3.包头海关综合技术服务中心,内蒙古 包头 014010;4.包头市辽禾渊酒厂,内蒙古 包头 014060)
我国白酒生产企业每年产生的酒糟约3 600万t以上[1]。国内中小企业通常采取直接将白酒糟低价(约0.5元/kg)销售给养殖户;然而相比其他农副产品,牲畜难以消化吸收鲜酒糟,而且酒糟含水量高,极易腐败霉变,因此,酒糟并不受养殖户欢迎[2]。除此之外,酒糟还被用来作为营养物质、有机肥、可发酵碳源、制备微晶纤维素(microcrystalline cellulose,MCC)等[3-6]。虽然这些酒糟的处理方法有一定的成效,但相关产品附加值低,收益微薄,以致于出现中小白酒企业再度丢弃酒糟的现象。酒糟中富含粗纤维、粗淀粉、粗蛋白、粗脂肪等有机质[7],是一种极具开发潜力的可再生资源,研究一条体系化、高值化、环保的丢糟高值化利用途径迫在眉睫。
MCC具有独特的理化性质,在食品、日用化工和医药领域有广泛应用[8]。制备MCC方法主要有酸水解法、酶水解法、近临界水法等[9-11]。其中,酸水解法对设备有很强的腐蚀性,废液的排放容易造成环境污染,用强酸制备MCC已不符合新时代发展的要求。近临界水法需要在高压高热环境中进行,设备昂贵、能耗大、成本高,不适宜工业化生产。酶水解法制备MCC反应条件温和、副反应较少[10],而且多种酶耦合使用可以有效除去目标物中的蛋白质、淀粉、脂肪等其他物质而得到MCC[7,11];制备过程中产生的废水是可以被生物直接利用的生物质。乳酸链球菌素(Nisin)是由乳酸乳球菌(Lactococcus lactis)产生的一个多肽抗菌物质,是国际上允许商业化生产食品防腐剂,具有极高的商业价值[12]。目前,有菌酶协同发酵酒糟生产蛋白饲料的研究报道[13-14],但未见菌酶协同将丢糟转化为MCC和Nisin的研究。
本研究以包头市辽禾渊酒厂“粹五烧”酒的丢糟为研究对象,采用单因素试验及正交试验对复合酶耦合乳酸乳球菌协同制备微晶纤维素(MCC)的工艺条件进行优化,并对MCC的结构进行表征。以乳酸乳球菌生物量为评价指标,采用MCC制备过程中废水培养基培养乳酸乳球菌产Nisin,并采用单因素试验及响应面法对其培养基组分进行优化。以期实现菌酶协同高值化利用丢糟,为实现原料丢糟高值化利用、控制污染问题和增加效益的一体化技术体系提供指导。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
白酒丢糟(酿酒原料由稻米、小麦、高粱、玉米和豌豆构成):包头市辽禾渊酒厂“粹五烧”牌;乳酸乳球菌(Lactococcuslactissubsp.lactis)F44、藤黄八叠球菌(Sarcina lutea):中国普通微生物菌种保藏管理中心。
1.1.2 试剂
碱性蛋白酶(200 000 U/g):北京索莱宝科技有限公司;脂肪酶(酶活20 000 U/g)、酸性木聚糖酶(酶活200 000 U/g)、漆酶(酶活700 U/g)、α-中温淀粉酶溶液(酶活4 154 U/mL):山东苏柯汉生物工程公司;纤维素酶(酶活3 U/mg):美国Worthington公司。
1.1.3 培养基
乳酸乳球菌产Nisin的培养基[12]:酵母浸粉15 g/L、蛋白胨15 g/L、蔗糖15 g/L、KH2PO420 g/L、NaCl 1.5 g/L和MgSO4·7H2O 0.15 g/L。121 ℃、0.11 MPa条件下灭菌20 min。
1.2 仪器与设备
S-4800场发射扫描电子显微镜:日本日立公司;KDN-08消化炉:上海洪纪仪器有限公司;KDN型-102C定氮仪:上海纤检有限公司;1833品氏黏度计:上海宝山启航玻璃仪器厂;UV-7504可见分光光度计:上海欣茂仪器有限公司;GmbH高速冷冻离心机:德国Sigma公司。
1.3 试验方法
1.3.1 复合酶制备白酒丢糟基MCC[7,11,15-17]
称取100 g白酒丢糟,105 ℃烘干、粉碎过20目筛,以料液比为1∶10(g∶mL)加水,煮沸半小时备用;按照2 U/g丢糟的α-中温淀粉酶,保持pH 5.0和60 ℃条件下振摇(50 r/min、8 min)去除淀粉;按照30 000 U/g丢糟的比例加入碱性蛋白酶,保持在其pH 9.5和40 ℃条件下振摇(50 r/min、5 h)去除蛋白质;按照700 U/g丢糟的比例加入脂肪酶,在40 ℃下振摇(50 r/min、6 h)去除脂肪;按照10 000 U/g丢糟的比例加入酸性木聚糖酶,在pH 9.5和40 ℃条件下振摇(50 r/min、1 h),降解半纤维素;再按照70 U/g丢糟的比例加入漆酶,在pH 4.5和40 ℃条件下振摇(50 r/min)保温2 h,降解木质素;之后,调节溶液pH值为9.5,加入次氯酸钠使溶液中次氯酸钠的终浓度为10%,室温下作用3 h,直至纤维素漂成白色。最后,用醋酸使溶液pH值降至5.0,在50 ℃作用1 h消除次氯酸根,再用蒸馏水倾泻洗涤法清洗3遍,烘干得丢糟基粗纤维。所得粗纤维加入1 000 mL蒸馏水,在pH 5.0、55 ℃条件下经纤维素酶酶解30 min,酶解完成后于5 000 r/min离心30 min并用蒸馏水冲洗,于真空干燥箱中干燥(60 ℃、6 h)获得MCC。收集粗纤维及MCC制备过程中产生的废水,每处理100 g丢糟约产生和收集2 000 mL废水。
1.3.2 白酒丢糟基MCC酶解工艺条件优化
单因素试验:按照上述制备粗纤维工艺流程,准确称取所得丢糟基粗纤维,加入适量蒸馏水,调整pH在最佳,以所得丢糟基MCC的聚合度(degree of polymerization,DP)为评价指标,考察纤维素酶添加量(0、12 U/g、18 U/g、24 U/g、30 U/g和36 U/g)、酶解时间(0.5 h、1 h、3 h、5 h、7 h、9 h、11 h和13 h)和料液比(1∶10、1∶15、1∶20、1∶25和1∶30)(g∶mL)进行酶水解丢糟基粗纤维制备MCC的最佳工艺条件。
正交试验:依据单因素试验结果,以所得丢糟基MCC的聚合度(degree of polymerization,DP)(Y)为评价指标,选取纤维素酶添加量(A)、酶解时间(B)和料液比(C)3个因素按L9(33)正交表进行试验。正交试验因素与水平见表1。
1.3.3 白酒丢糟中各有机成分的测定
粗纤维的测定:参考GB/T 5009.10—2003《植物类食品中粗纤维的测定》;淀粉的测定:参考GB/T 5009.9—2008《食品中淀粉的测定》;蛋白质的测定:参考GB 5009.5—2010《食品中蛋白质的测定》;脂肪的测定:参考GB/T 5009.6—2003《食品中脂肪的测定》;木质素的测定:参考GB/T 20805—2006《饲料中酸性洗涤木质素的测定》。
1.3.4 纤维素含量、持水力、白度和膨胀度的测定
白度:采用白度仪进行检测。
纤维素含量的测定:参考文献[18]。其计算公式如下:
式中:V1为硫酸亚铁铵标液的消耗量,mL;X为试样中纤维素的含量,%;m为所取试样质量,mg;V2为滴定时消耗硫酸亚铁铵标液的体积,mL;V1为空白试验消耗硫酸亚铁铵标液的体积,mL。
持水力的测定:参考据文献[15]。其计算公式如下:

式中:3为丢糟基MCC的质量,g;V1为量筒中平整微晶纤维素体积,mL;V2:加入蒸馏水微晶纤维素在室温下放置24 h后的体积,mL。
1.3.5 聚合度的测定
聚合度(DP)的测定按照GB/T 1548—1989《纸浆粘度的测定法》,配制铜乙二胺溶液,通过测定黏度换算聚合度[19],用毛细血管黏度,取的测试时间平均值。根据时间换算得到η/η0,查黏度表得到[η]*c,再除以浓度c,得到[η],DP计算公式如下:
DP0.905=0.75[η]
1.3.6 结构特性分析
将所得样品粉末喷金后在场扫描电子显微镜上进行MCC的形貌和结构特性观测[20]。
1.3.7 乳酸乳球菌产Nisin废水培养基组分优化单因素试验
在乳酸乳球菌产Nisin的种子培养基基础条件下,经预试验,以稀释3倍的MCC废水替代蒸馏水且不添加NaCl,分别考察复合氮源添加量(酵母浸粉和蛋白胨比例为1∶1)(0、5 g/L、10 g/L、15 g/L、20 g/L和25 g/L)、蔗糖添加量(0、2.5 g/L、5.0 g/L、7.5 g/L、10.0 g/L、12.5 g/L和15.0 g/L)、KH2PO4添加量(0、5.0 g/L、10.0 g/L、15.0 g/L、20.0 g/L、25.0 g/L、30.0 g/L和35.0 g/L)和MgSO4·7H2O添加量(0、0.05 g/L、0.10 g/L、0.15 g/L、0.20 g/L、0.25 g/L、0.30 g/L和0.35 g/L)对菌株F44生物量和Nisin产量的影响。
1.3.8 乳酸乳球菌产Nisin废水培养基组分优化响应面试验
在单因素试验结果的基础上,确定影响乳酸乳球菌生长的主要因素氮源添加量(A)、蔗糖添加量(B)和KH2PO4添加量(C),以乳酸乳球菌生物量(Y)为响应值进行响应面试验,响应面试验因素与水平见表2。

表2 培养基组分优化响应面试验设计因素与水平Table 2 Factors and levels of response surface experiments for medium components optimization
1.3.9 乳酸乳球菌生物量及其Nisin效价的检测
生物量检测:以稀释涂布平板法计算乳酸乳球菌数量[12]。Nisin效价检测:以藤黄八叠球菌为指示菌,使用管碟法通过对平板抑菌圈直径的测量,以Nisin标准品液效价的对数值(Y)为纵坐标,抑菌圈的直径(X)为横坐标,绘制标准曲线,得到标准曲线回归方程为:Y=0.187 9X-0.827 7(相关系数R2=0.992 8),通过测量待测样品的抑菌圈直径,代入相应标准曲线方程计算,即可得到Nisin效价。
2 结果与分析
2.1 白酒丢糟中有机质的测定结果
包头市辽禾渊酒厂“粹五烧”牌白酒丢糟中各类有机质含量(以干基计)为纤维素23.5%、淀粉1.39%、蛋白质13.07%、脂肪7.41%、木质素14.30%。此丢糟中纤维素含量达23.50%。由此可知,此丢糟为制备MCC的良好来源。然而丢糟中含有较多的木质素、蛋白质、淀粉和脂肪,这些物质是制备MCC过程中需要去除的杂质。
2.2 白酒丢糟基MCC制备工艺条件优化单因素试验结果
纤维素酶的酶解时间、纤维素酶添加量及料液比对MCC聚合度影响的单因素试验结果见图1。

图1 白酒丢糟基微晶纤维素制备工艺条件优化单因素试验结果Fig.1 Results of single factor experiments for optimization of preparation process conditions of Baijiu distiller's grains to prepare microcrystalline cellulose
由图1A可知,随着酶解时间在0~7 h内的延长,聚合度在不断下降,说明丢糟微晶纤维素在不断降解,解离速度较快,其原因可能是,中性盐离子(Na+)等对纤维素酶具有激活作用[21]。当酶解时间为7 h,聚合度为137;当酶解时间>7 h,聚合度下降比较平缓。这是因为随着酶解时间的增加,剩余丢糟的木质纤维包被结构[11],导致在开始阶段使酶很难结合到其内部的酶反应结合位点,反应速率较低;当酶作用一段时间后,剩余木质纤维结构被逐步破坏,使酶结合位点增加;但随着水解产物的增加,对酶解反应有抑制作用,丢糟MCC的平衡聚合度的酶解时间为7 h。因此,最佳酶解时间为7 h。
由图1B可知,纤维素酶的添加量为0~12 U/g,聚合度快速下降,丢糟纤维素剧烈降解;纤维素酶的添加量为12 U/g时,聚合度为150;纤维素酶添加量>12 U/g,聚合度的下降趋势趋于平缓,丢糟MCC的解离基本达到平衡聚合度,其原因可能是,在酶解反应过程中,纤维素酶催化的产物有纤维二糖及葡萄糖,能降低酶解程度,抑制酶解反应[22],这是导致酶解效率不高的主要因素。因此,最佳纤维素酶添加量为12 U/g。
由图1C可知,当料液比为1∶10、1∶15、1∶20(g∶mL)时,聚合度有所下降,其原因可能是,随着料液比的减小,混合酶体积增加,体系流动性加强,而且相同浓度酶液中的酶分子数量增加,提高了酶与底物的接触面积和反应几率,酶解作用加强[11];当料液比为1∶20(g∶mL)时,丢糟微晶纤维素的聚合度值最低(230),其原因可能是料液较小时,反应底物浓度较高,体系流动性较差,溶液难以搅拌均匀,阻止了酶向纤维结构内部的渗透,致使酶与纤维素接触面积变小,纤维素酶难以和底物充分接触,难以发生酶解反应,导致酶解反应速率变慢[11]。当料液比为1∶20、1∶25、1∶30(g∶mL)时,聚合度增加,其原因可能是溶液又经过稀释,引起纤维素酶浓度降低。因此,最佳料液比为1∶20(g∶mL)。
2.3 白酒丢糟基MCC制备工艺条件优化正交试验结果
根据单因素试验结果,以丢糟基MCC聚合度为评价指标,选取纤维素酶的添加量(A)、酶解时间(B)和料液比(C)3个因素进行L9(33)正交试验。正交试验结果与分析见表3。

表3 白酒丢糟基微晶纤维素制备工艺条件优化正交试验结果与分析Table 3 Results of orthogonal experiments for optimization of preparation process conditions of microcrystalline cellulose from Baijiu distiller's grains to prepare
由表3可知,3个因素对丢糟基MCC影响的主次顺序为酶解时间>加酶量>料液比。另外,由k值可知,得到的最优组合为A3B3C2。即加酶量24 U/g,酶解时间9 h,料液比为1∶20。对最优酶解条件进行验证,所得MCC的聚合度为118。
2.4 白酒丢糟基MCC的结构特性和主要性能指标参数
MCC的持水力为521%,膨胀度为1.27 mL/g,白度为88。丢糟基MCC扫描电镜图见图2。由图2可知,丢糟基MCC原来的纤维结构被破坏,现呈棒状,粒径约为20 μm。试验所得丢糟基MCC与文献[23]中由稻秸秆制成的MCC形态相似(图3a);与文献[24]中由废棉制成的纤维素形态有所差异,文献中MCC形态(图3b)没有脱去木质素,所得MCC粒径更大(20~50 μm),外观较为平滑。

图2 白酒丢糟基微晶纤维素扫描电镜图Fig.2 Scanning electron microscope of microcrystalline cellulose from Baijiu distiller's grains

图3 文献中的微晶纤维素扫描电镜图Fig.3 Scanning electron microscope of microcrystalline cellulose in literature
2.5 制备白酒丢糟基MCC过程废水中有机质的含量
100 g丢糟制取MCC过程收集到约2 000 mL的废水,废水中各有机质含量为:总糖11.59g/L、蛋白质21.11g/L、脂肪酸2.10 g/L。另外,在粗纤维素漂白后Na+终浓度为0.12 mol/L。
2.6 乳酸乳球菌产Nisin废水培养基组分优化
2.6.1 单因素试验结果
由图4A可知,随着氮源添加量在5~15 g/L范围内的增加,菌株的生物量明显上升;氮源添加量为15 g/L时,生物量达最高值,为4.0×107CFU/mL;当氮源添加量>15 g/L时,菌株的生物量有所下降。因此,最适氮源添加量为15 g/L。由图4B可知,当蔗糖的添加量为0~7.5 g/L时,生物量逐渐增加;当蔗糖添加量为7.5 g/L时,生物量为6.3×107CFU/mL;当蔗糖添加量>7.5 g/L时,生物量变化不明显。因此,最适蔗糖添加量为7.5 g/L。由图4C可知,当KH2PO4的添加量为0~15 g/L时,生物量逐渐增加;当KH2PO4添加量为15 g/L时,生物量达最大值,为6.3×107CFU/mL;当KH2PO4添加量>15 g/L时,生物量逐渐下降。因为酒糟中含有丰富的微量元素,这些元素的存在,代替了一部分KH2PO4的作用,相对种子培养基的用量(20 g/L)降低了25%。因此,确定最适KH2PO4添加量为15 g/L。由图4D可知,硫酸镁的添加量为0~0.15 g/L时,生物量逐渐增加;硫酸镁的添加量为0.15 g/L时,生物量达到最大值,为6.2×107CFU/mL;当硫酸镁的添加量>0.15 g/L时,生物量逐渐下降。因此,确定最适硫酸镁添加量为0.15 g/L。
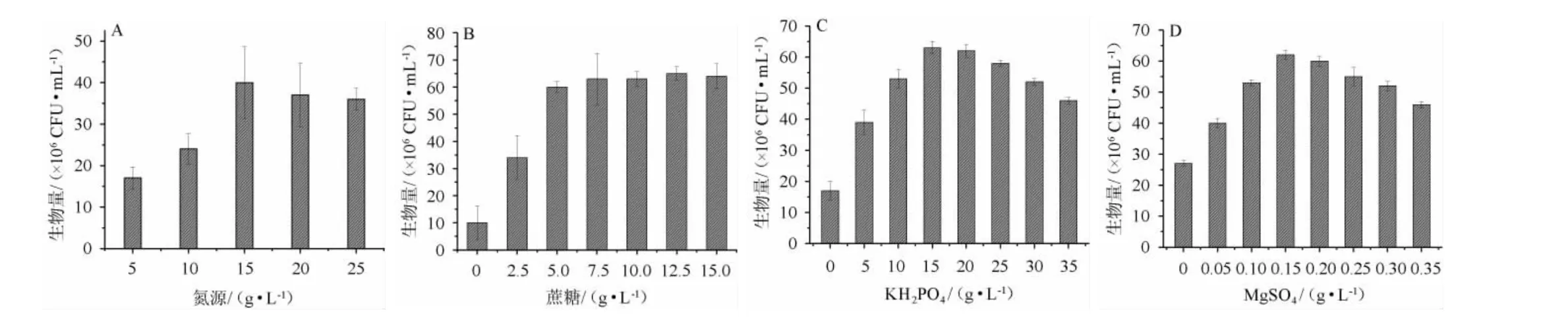
图4 培养基组分优化单因素试验结果Fig.4 Results of single factor tests for medium component optimization
2.6.2 响应面试验结果
在单因素试验结果基础上,以生物量(Y)为响应值,选取氮源添加量(A)、蔗糖添加量(B)和KH2PO4添加量(C)3个自变量,采用中心组合试验设计优化废水培养基组分。培养基组分优化响应面试验设计与结果见表4,回归模型方差分析见表5。

表4 培养基组分优化响应面试验设计与结果Table 4 Design and results of response surface tests for medium component optimization
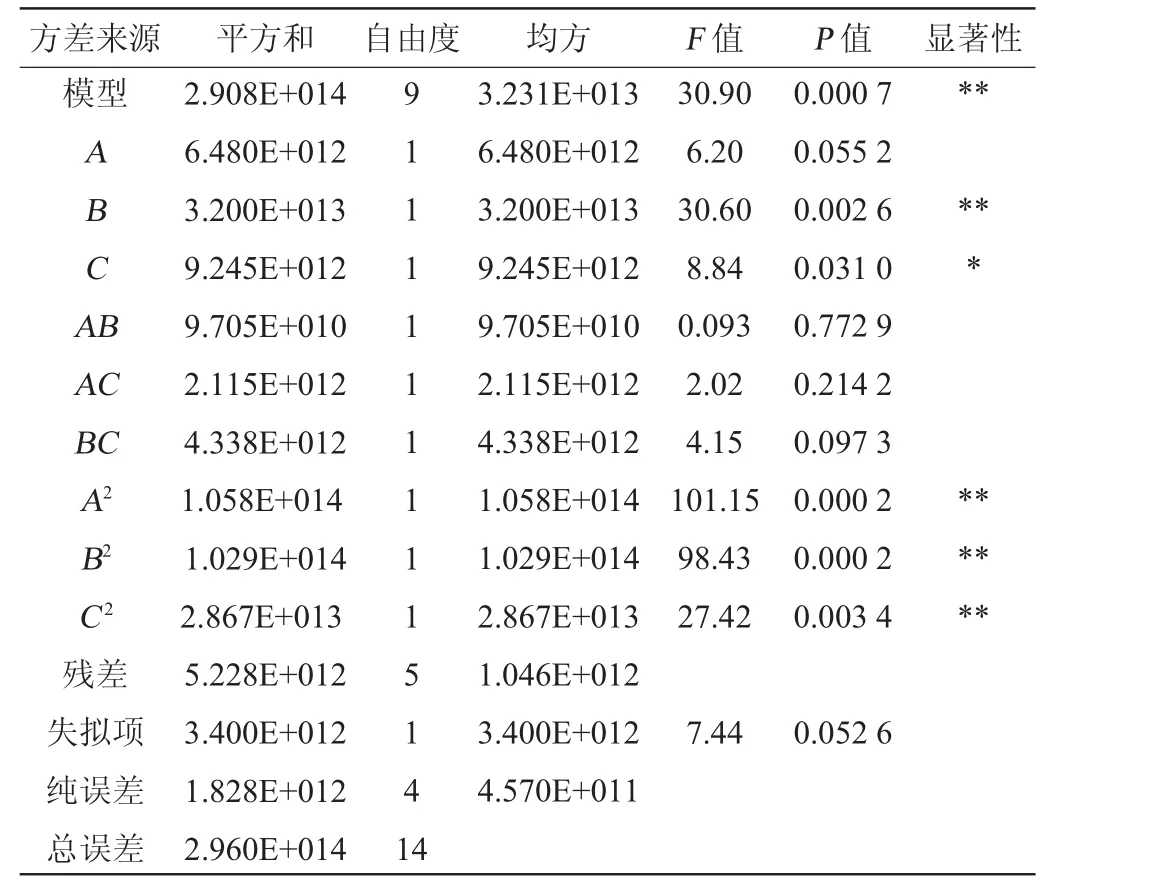
表5 回归模型方差分析Table 5 Variance analysis of regression model
通过Design-Expert8.0.6软件对表3试验数据进行多元回归拟合,得到乳酸乳球菌生物量与氮源添加量、蔗糖添加量、KH2PO4添加量之间的二次多项回归模型为:
由表5可知,模型的P值<0.001,表明该回归模型极显著;失拟项P值=0.052 6>0.05,不显著,说明试验设计可靠。决定系数R2=0.979 9,调整决定系数R2adj=0.943 8,表明该模型拟合度良好,由P值可知,一次项B、二次项A2、B2、C2对结果影响极显著(P<0.01),一次项C对结果影响显著(P<0.05)。由F值可知,3个因素对乳酸乳球菌生长量的影响顺序依次为蔗糖添加量(B)>KH2PO4添加量(C)>氮源添加量(A)。
各因素间交互作用对菌株生物量影响的响应曲面和等高线见图5。响应面图越陡峭,等高线图越接近椭圆,说明两因素间交互作用对菌株生物量的影响越大。由图5可知,蔗糖添加量(B)与KH2PO4添加量(C)响应曲面图较陡峭,说明两者具有一定交互作用。
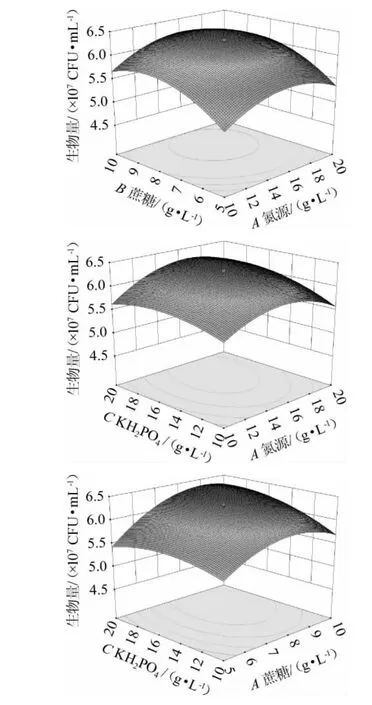
图5 各因素间交互作用对菌株生物量影响的响应曲面和等高线Fig.5 Response surface plots and contour lines of effects of interaction between each factors on biomass of strain
2.6.3 验证试验
通过响应面软件分析,得到最优培养基组分为:氮源16.78 g/L、蔗糖8.99 g/L、KH2PO419.10 g/L,在此优化条件下,乳酸乳球菌的生长量预测值为6.4×107CFU/mL。考虑实际应用,将最佳培养基组分修正为:氮源16 g/L、蔗糖9 g/L、KH2PO419 g/L,进行5次平行验证试验,得到乳酸乳球菌的生长量实际值为6.3×107CFU/mL,与预测值相差不大,因此,可用该模型对培养基组分进行预测。
2.7 不同培养基培养乳酸乳球菌产Nisin的结果
试验测出工业常用培养乳酸乳球菌的种子培养基、本研究优化的废水培养基和不外加氮源和碳源的培养基产生Nisin效价分别为487.75 IU/mL、732.52 IU/mL和49.23 IU/mL。Nisin效价与乳酸乳球菌生长量呈正相关,在上述效价值下乳酸乳球菌的生物量分别为6.4×107CFU/mL、6.3×107CFU/mL和0.4×107CFU/mL。优化的废水培养基与种子培养基培养乳酸乳球菌在生物量上相差不大,但是优化的废水培养基产Nisin的效价比种子培养基高了50.18%。可能是白酒丢糟废水中除了含有蛋白质、淀粉、脂肪、木质素、纤维素外,还含有丰富的微量元素,这些微量元素对乳酸乳球菌的生长可能有非常好的促进作用,并且能大幅度提高nisin的产量。这类nisin产品主要应用于饲料防腐,尤其是猪饲料中。
3 结论
MCC的最佳制备工艺条件为纤维素酶加酶量0.8%,酶解时间9 h,料液比为1∶20(g∶mL),在此条件下,MCC聚合度为118,其结构呈棒状。确定最佳酶解丢糟制备MCC过程中产Nisin的培养基组分为:酵母粉8 g/L和蛋白胨8 g/L、蔗糖9 g/L、KH2PO419 g/L、硫酸镁为0.15 g/L,在此优化条件下,乳酸乳球菌生物量为6.3×107CFU/mL,Nisin效价为732.52 IU/mL。本研究利用酶法制备出的MCC与硝酸-乙醇法[9]制备丢糟MCC相比聚合度更低,绿色环保,并且对环境零负荷;同时把丢糟制备MCC过程产生的废水用于培养乳酸乳球菌的碳氮源,进而转化为高附加值的生物防腐剂Nisin。本研究真正实现了白酒丢糟的高值化利用,为发展以丢糟为原料的轻工产业,实现洁净生产、原料高值化利用、控制污染问题和增加企业效益的一体化技术体系提供思路和方法指导。
