高产酯酶细菌的筛选、鉴定及复合诱变选育
2024-01-19汤秀娟吴成泽叶光斌张楷正
汤秀娟,吴成泽,陈 聪,叶光斌,张楷正,邹 伟,3*
(1.四川轻化工大学 生物工程学院,四川 宜宾 644005;2.乐山职业技术学院 现代农业学院,四川 乐山 614000;3.四川轻化工大学 四川省酿酒生物技术及应用重点实验室,四川 宜宾 644005)
酯酶(EC 3.1.1.1)具有催化多种底物的裂解和酯键形成的功能,也称酯化酶,是脂肪酶、酯合成酶、酯分解酶、磷酸酯酶的统称[1-2]。酯酶在催化酯类物质合成时,其催化作用会受到反应介质、产物浓度等因素的影响[3]。酯酶具有广泛的工业应用,一般被用于提升白酒质量[4],以及作为食品工业的催化剂,比如黄油制造、奶酪增香剂和合成风味酯[5],同时还可以应用于化妆品、制药和造纸等领域[6-7]。在白酒的酿造过程中,酯酶可以发挥极为强大的合成作用,促进己酸乙酯等酯类物质的生成,增强白酒风味,提升白酒品质。因此,筛选出产酯酶能力较强的功能菌株将酯酶制剂应用于白酒生产过程,可有效缩短发酵时间,减少用曲量,提高生产效率,增加己酸乙酯的含量,为酒质的提升提供理论依据[8]。微生物酯化酶广泛存在于多种细菌中,包括链球菌、葡萄球菌、新型隐球菌、乳酸菌、魏斯氏菌等,不同种属的菌种产酯酶的产量和性质不同[9-10]。现已知的产酯酶微生物资源种类有限,对产酯酶细菌的研究较少,大多数细菌代谢产生的酯酶最适pH较广,稳定范围一般在pH 4.0~11.0,且细菌所产的酯酶作用温度较高[11]。
紫外(ultraviolet,UV)诱变是微生物育种中常用和有效的诱变方法之一[12]。常压室温等离子体(atmospheric and room temperature plasma,ARTP)是近年来发展出的一种新的菌种诱变育种方法[13],利用均匀分布的活性粒子作用于微生物细胞壁或细胞膜,通过提高通透性及损伤基因影响微生物的遗传物质[14]。ARTP-UV复合诱变同时诱发菌体,使突变株具有更高突变率、更强的遗传稳定性,且操作简单、安全,对环境无污染、危害[15]。
本实验从大曲中筛选高产酯酶细菌,对其进行形态和分子生物学鉴定,利用ARTP-UV复合诱变选育出稳定优良的突变株,提升突变株的产酯酶能力,为酯酶的工业应用和脂肪酸乙酯类化合物的生成提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大曲:四川某浓香型酒厂。
1.1.2 化学试剂
三丁酸甘油酯、聚乙烯醇、制霉菌素(均为分析纯):上海麦克林生化科技有限公司;牛肉膏、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;氯化钠、磷酸氢二钾、硫酸镁、硫酸亚铁、硫酸铵(均为分析纯):成都市科隆化学品有限公司。
1.1.3 培养基
筛选培养基[16]:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,乳化液20%,制霉菌素质量浓度25 μg/mL,自然pH。
种子液培养基[17]:牛肉膏3 g/L,蛋白胨10 g/L,氯化钠5 g/L,自然pH。
发酵培养基[18]:葡萄糖20 g/L,牛肉膏20 g/L,氯化钠5 g/L,K2HPO41.0g/L,(NH4)2SO41.0 g/L,MgSO4·7H2O 1.0 g/L,FeSO4·7H2O 0.01 g/L,pH7.0。121 ℃高压灭菌15 min。
1.2 仪器与设备
IIIS常压室温等离子体(ARTP)诱变仪:无锡源清天木生物科技有限公司;V-1000可见分光光度计:翱艺仪器(上海)有限公司;HZ150L型恒温培养摇床:武汉瑞华仪器设备有限责任公司;MJ-250恒温培养箱、TG-16医用离心机:四川蜀科仪器有限公司;LS-50HJ立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;HH-6D数显恒温水浴锅:常州普天仪器制造有限公司;SW-CJ2D超净工作台:上海苏净实业有限公司;DHG-9023A电热干燥箱:上海琅歼实验设备有限公司。
1.3 方法
1.3.1 菌种的筛选
将大曲样品均匀混合并研细后,称取5 g样品于45 mL生理盐水中,置于摇床中振荡2 h,静置30 min,将其稀释为10-1~10-7菌悬液,并涂布于筛选培养基平板上,每个梯度涂布3个平行,在37 ℃恒温培养箱中培养3~5 d,同时观察菌落周围产生透明圈的情况,选取透明圈较大的菌落在筛选培养基上划线分离至纯种。
1.3.2 菌株的活化及培养
将分离出的纯种菌株勾取一环于25 mL种子液培养基中,37 ℃、180 r/min摇床培养24 h,同上条件连续活化3次以后,吸取0.8 mL菌悬液于装有1 mL体积分数40%甘油的甘油管中,置于-80 ℃冰箱中保存菌种,并做好斜面保藏,同时转接5 mL种子液于50 mL发酵培养基中,37 ℃、180 r/min摇床培养48 h后,吸取4 mL发酵液经5 000 r/min离心10 min,将上清液保存在4 ℃条件下,备用。
1.3.3 酯酶酶活力的测定
酯酶酶活力的测定采用滴定法。取4 mL 3%聚乙烯醇-三丁酸甘油酯乳化液(将3%聚乙烯醇与三丁酸甘油酯以体积比4∶1均匀混合)与5 mL磷酸缓冲溶液(0.025 mol/L,pH7.5)于锥形瓶中混匀,将锥形瓶置于40 ℃水浴锅中预热5 min,加入1 mL提前制备好的粗酶液,反应15 min后取出锥形瓶,再加入15 mL 体积分数95%乙醇,滴加2~3滴酚酞指示剂,最后用0.05 mol/L的NaOH标准溶液滴定,空白组加入等量灭菌后的无菌水[19]。酯酶酶活计算公式如下:
式中:V1为消耗的NaOH溶液体积,mL;V2为空白对照体积,mL;n为稀释倍数;t为反应时间,min。
酯酶酶活力的定义:40 ℃、酯酶每15 min水解4 mL3%三丁酸甘油酯乳化液所需的酶量为1个酶活力单位(U)。
1.3.4 菌种鉴定
筛选出产酯酶酶活力最高的菌株进行形态学观察,观察菌落的大小,颜色、表面形态、边缘形状、质地等并记录。同时挑取平板培养的单菌落,通过革兰氏染色法在光学显微镜下观察菌株形态。
对目的菌株进行分子生物学鉴定,将目的菌株在筛选培养基上划线至培养出单菌落,培养3 d后送至派森诺有限公司进行菌种鉴定。采用16S rDNA测序,主要步骤如下:采用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-CTACGGCTACCTTGTTACGA-3')对目的菌株的16S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)1 μL,10×Buffer 5.0 μL,Taq聚合酶1 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)1.0 μL,引物1.5 μL,去离子水39 μL。PCR扩增条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,72 ℃终延伸7 min,循环35次。取目的菌种纯化后的PCR产物,使用测序仪ABI3730-XL进行DNA 测序。将拼接结果提交至美国国家生物信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对搜索,选择同源性较高的模式菌株的16S rDNA基因序列使用MEGA11.0软件,选择邻接(neighbor-joining,NJ)法构建系统进化树。
1.3.5 菌悬液的制备
在进行ARTP-UV复合诱变时,需要制备菌株对数期的菌悬液。从保藏的斜面上挑取目的菌株并接种至种子液培养基中,于37 ℃、180 r/min摇床培养至对数期后,吸取5 mL菌液于无菌离心管中,5 000 r/min离心10 min,无菌操作下吸取上清液并废弃,加入4 mL磷酸盐缓冲溶液(phosphate buffered solution,PBS),振荡均匀后,同上条件离心,废弃上清液,反复操作3次后,最后用PBS重悬菌体,控制菌悬液OD600nm值为0.6~1.0。
1.3.6 ARTP-UV复合诱变
移取10 μL菌悬液于金属载片表面,用专用镊子将菌液载片转移至载物台,设定ARTP参数,射频功率130 W,工作气流为10L/min,等离子体发射源与载物台距离为2mm,操作温度为室温(20~30 ℃),处理时间为0、10 s、20 s、30 s、40 s、50 s、60 s、70 s、80 s、90 s、100 s、110 s、120 s、130 s。将诱变完成的载片转移至装有1 mL无菌PBS的EP管中,振荡均匀后,稀释至10-1~10-3的菌悬液,再各吸取100 μL均匀涂布于平板筛选培养基中,每个梯度做3个平行,37 ℃恒温培养48 h后菌落计数,计算致死率。选择致死率在90%以上的时间对菌悬液按照上述方法对目的菌株进行ARTP诱变,将涂布后的平板在37 ℃恒温培养箱中培养5 d后测量其透明圈直径(D)及菌落直径(d),选择D/d值较大的菌落进行UV诱变。
多种诱变方式复合使用,诱变位点增多,获得高产菌株的几率增多[23]。所以,将酶活较高的ARTP突变株按照上述步骤中的操作制成菌悬液,吸取5 mL菌悬液于无菌培养皿中,并将培养皿置于磁力搅拌器上,距离UV诱变灯50 cm左右进行紫外照射,照射时间分别为0、20 s、40 s、60 s、80 s、100s、120s、150s、180s、200s。照射完成后,避光稳定10min,再从培养皿中吸取1 mL诱变后的菌液,进行梯度稀释至10-1~10-3的菌悬液,再移取100 μL涂布在筛选培养基平板上,于37 ℃恒温培养箱中培养48 h后,计数菌落数并计算致死率。选择致死率在90%以上的照射时间对菌悬液按照上述方法进行UV诱变,将诱变后的菌悬液涂布在筛选培养基平板上,37 ℃恒温培养箱中培养5 d后测量其透明圈直径[17,21]。致死率计算公式如下[20]:
1.3.7 数据处理
采用Design-Expert 13.0、IBM SPSS Statistics 27.0、MEGA 11、Origin 2021对数据进行分析。
2 结果与分析
2.1 菌种筛选
菌株的酯酶酶活力可以通过透明圈菌落直径比(D/d)的大小来反应[22]。通过D/d值大小比较,得到10株D/d值较大的菌株,结果见表1。由表1可知,菌株S3-51的D/d值最大,为2.15±0.02,对筛选出的10株产酯酶菌的酶活力进行测定,结果表明,菌株S3-51酶活力最高,为(13.73±0.04)U/mL,其他菌株酶活力为(10.75±0.03)~(12.55±0.02)U/mL。以菌株S3-51作为出发菌株,对其进行形态学观察、分子生物学鉴定、ARTP-UV复合诱变试验及遗传稳定性试验。

表1 产酯化酶菌株透明圈直径与菌落直径之比Table 1 Transparent circle diameter and colony diameter ratio of esterifying enzyme-producing strains
2.2 菌株形态学观察及菌株分子生物学鉴定
菌株S3-51经筛选培养基培养1 d后,其菌落、细胞形态见图1。由图1a可知,菌株S3-51产透明圈,菌落为淡黄色,较小,表面光滑,低凸起,菌落规则,有光泽,质地黏稠,易挑取,菌落周围与边缘颜色一致,不透明。由图1b可知,经革兰氏染色后,为红色,是革兰氏阴性菌,在100倍油镜下观察,呈短杆状,无芽孢。

图1 菌株S3-51菌落(a)及细胞(b)形态Fig.1 Colony (a) and cell (b) morphology of strain S3-51
提取菌株S3-51的DNA进行PCR扩增,扩增得到的电泳图无拖尾、分子质量大小为2 000 bp。上机测序,测得的基因序列在NCBI当中进行比对,将同源性较高的序列下载后利用MEGA 11.0进行分析,采用NJ法系统发育树,菌株S3-51的系统发育树见图2。由图2可知,菌株S3-51与Sphingomonas paucimobilis聚于同一支,最大序列相似度为100%。因此,菌株S3-51被鉴定为少动鞘氨醇单胞菌(Sphingomonas paucimobilis)。SMALLEY D L[23]证实了少动鞘氨醇单胞菌(Sphingomonas paucimobilis)具有酯酶(C4)、酯酶脂肪酶(C8)、碱性磷酸酶和酸性磷酸酶的活性。此前有学者在活性污泥中分离出的鞘氨醇单胞菌具有多种降解基因和高活性酶、优质的流变特性和多功能性,广泛应用于食品和日用品行业[24-27]。黄丹等[28]从浓香型大曲中分离得到一株血红鞘氨醇单胞菌,初筛酯酶酶活为15.35 U/mL。本次筛选得到的S.paucimobilisS3-51酯酶酶活为(13.73±0.04)U/mL。

图2 菌株S3-51基于16S rDNA基因序列的系统发育树Fig.2 Phylogenetic tree of strain S3-51 based on 16S rDNA gene sequence
2.3 ARTP-UV复合诱变及选育
2.3.1 ARTP-UV复合诱变致死率与时间的关系
对菌株S3-51进行ARTP-UV复合诱变,测定不同诱变时间下菌株的致死率,结果见图3。由图3可知,随着ARTP和UV诱变时间的增加,菌株致死率增加,在ARTP诱变时间为90~120 s时,菌株的致死率在90%以上,ARTP诱变时间为130 s时,致死率为100%。为了达到较理想的诱变效果,此后在进行ARTP诱变时,选择菌株致死率在90%左右时作为后续诱变的处理时间[32]。因此,ARTP诱变时间选择90~120s。在进行UV诱变时,当诱变时间增加到150~180s,菌株的致死率在92%~96%,诱变时间为200 s时,致死率为100%。因此,在进行UV诱变时,诱变时间选择150~180 s。

图3 不同ARTP和UV诱变处理时间下菌株S3-51的致死率Fig.3 Lethal rates of strain S3-51 under different ARTP and UV mutation time
2.3.2 ARTP-UV复合迭代诱变选育
对出发菌株S3-51进行ARTP诱变,诱变完成后,在筛选培养基平板上选择D/d值较大的菌落进行活化并测定酶活。制备酶活力较高突变株的菌悬液,然后对其进行UV诱变,用筛选培养基平板进行初步筛选并对D/d值较大的突变株液态发酵测定酯酶酶活力。选择酶活力较高的突变株进行保存,完成ARTP-UV复合第一轮诱变。重复上述操作,对突变株进行第二轮及第三轮ARTP-UV复合诱变,最后选择酶活最高的突变株进行遗传稳定性测试。对同一菌株进行传代培养过程中,若连续培养三代的产物产量无显著性差异,即认为突变株具有较好的稳定性[33]。
ARTP-UV复合迭代诱变突变株酯酶酶活力测定结果见图4。

图4 ARTP-UV复合迭代诱变突变株酯酶酶活力Fig.4 Esterase activities of mutant strains by ARTP-UV composite iterative mutation
进行ARTP第一轮诱变后,对D/d值较大的菌株进行划线分离,接种至发酵培养基发酵2 d后测定其酶活力,如图4a所示,突变株均出现了正向突变,将突变株活化后制成菌悬液,其中菌株AR1-18酶活力最高,为(16.58±0.02)U/mL,其他突变株酶活力为(15.05±0.04)~(16.53±0.02)U/mL。对突变株AR1-18进行UV诱变,共计筛选了31株透明圈较大的突变株并测定其酶活,如图4b所示,相对于原始菌株,均出现了正向突变,突变株ARUV1-27酶活力最高,为(17.32±0.02)U/mL,其余突变株酶活力为(15.97±0.03)~(17.29±0.03)U/mL。
将ARTP-UV复合第一轮诱变后酶活力最高的突变株ARUV1-27制成菌悬液,进行第二轮ARTP-UV复合诱变,如图4c、图4d所示,部分突变株开始出现负向突变。在ARTP第二轮诱变后,酶活力最高的是菌株AR2-13,酶活力为(17.53±0.03)U/mL,其次是菌株AR2-2,酶活力为(17.52±0.04)U/mL,其余突变株酶活力为(15.07±0.03)~(17.49±0.01)U/mL。随后进行UV第二轮诱变,其中突变株ARUV2-21酶活力最高,为(18.07±0.03)U/mL,其余突变株酶活力为(14.57±0.03)~(18.06±0.03)U/mL,为了保证菌株产酶能力的稳定性,对第二轮复合诱变酶活力最高的ARUV2-21进行第三轮ARTP-UV复合诱变。
在进行ARTP-UV复合第三轮诱变以后,如图4e和图4f所示,部分突变株的产酯化酶酶活力在不断上升,说明随着ARTP-UV复合诱变次数的增加,菌株产酯化酶能力具有一定的累加效应,有部分突变株产酯化酶能力趋于稳定,但也有部分突变株产酯化酶能力依然出现负向突变。第三轮ARTP-UV复合诱变的突变株中,ARUV3-2酶活力达到(19.41±0.02)U/mL,相比于初筛提高了41.37%,其余突变株酶活力为(13.21±0.02)~(18.78±0.03)U/mL。因此,得到高产酯化酶突变菌株ARUV3-2。
2.3.3 遗传稳定性试验
ARTP-UV复合诱变选育出的突变株在传代过程中会出现负向突变,使得筛选出来的高产酯化酶的突变株在传代过程中产酶性能下降。对产酯酶酶活力最高的突变株ARUV3-2进行遗传稳定性测试,连续传代培养15代并测定其产酯酶酶活力,比较不同传代次数突变株产酯酶酶活力的高低,以确定其遗传是否稳定,结果见图5。由图5可知,突变株ARUV3-2在经过第一次传代以后,酯化酶酶活力由(19.21±0.18)U/mL下降至(18.01±0.30)U/mL。再经过14次传代,突变株ARUV3-2所产酯化酶酶活力稳定在(17.42±0.32)~(17.84±0.28)U/mL,相比于原始菌株S.spaucimobilisS3-51初筛酶活(13.73±0.04)U/mL,突变株ARUV3-2酶活提升了26.88%~29.93%。由此可见,本次选育出的突变株ARUV3-2的遗传稳定性良好。高荣等[30]以高产褐藻胶裂解酶海藻类芽孢杆菌(Paenibacillus algicola)HB172198T作为原始菌株,利用ARTP诱变技术选育获得2株褐藻胶裂解酶活力明显提高的突变株(编号分别为30-19、80-6),其酶活力分别比原始菌株提高了32.6%和21.6%,且连续6次传代培养诱变菌株的产酶遗传性状稳定。
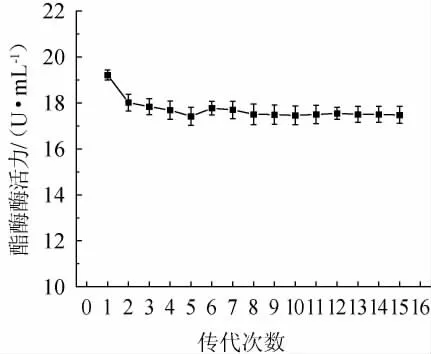
图5 突变株ARUV3-2遗传稳定性测试结果Fig.5 Determination results of genetic stability of mutant strain ARUV3-2
3 结论
从大曲样品中筛选得到一株高产酯酶细菌,鉴定为少见鞘氨醇单胞菌(Sphingomonas paucimobilis),初筛酶活为(13.73±0.04)U/mL,对其进行ARTP-UV复合诱变选育,筛选出一株产酯酶酶活力为(17.42±0.32)U/mL的突变株ARUV3-2,与初筛原始菌株产酯酶酶活力比较,酶活力提高了26.88%,产酯化酶性能优良且稳定。该研究丰富了优质菌种来源,为白酒质量和产量提升的研究提供参考。
