铜-氨-硫代硫酸盐体系金溶出影响因素的电化学研究
2024-01-18项朋志邓飞宇叶国华
项朋志,张 娅,邓飞宇,刘 琼,邓 超,叶国华
铜-氨-硫代硫酸盐体系金溶出影响因素的电化学研究
项朋志1, 2,张 娅3,邓飞宇4,刘 琼2,邓 超2,叶国华1 *
(1. 昆明理工大学 国土资源工程学院,昆明 650093 ;2. 云南开放大学 化学工程学院,昆明 650023;3. 云南省中医中药研究院,昆明 650021;4. 昆明市生态环境局五华分局,昆明 650030)
铜-氨-硫代硫酸盐浸金体系中,金的溶出本质上是电化学过程。采用交流阻抗和Tafel曲线分析硫代硫酸盐、铜离子、氨浓度对金的溶出影响。结果表明:在金的溶出过程中,硫代硫酸盐和铜离子可能会导致钝化,尤其使铜离子浓度增大会导致钝化加剧,这种钝化会交替出现;氨水不会导致钝化;对金溶出速率的影响,硫代硫酸盐最大,铜离子最为复杂,氨影响相对最小。
硫代硫酸盐;浸金;交流阻抗;电化学;溶出
硫代硫酸盐提金技术是非氰提金技术中最具产业化应用前景的提金技术[1]。在有氧条件下,硫代硫酸盐溶液就可以实现对金的浸出,只是反应速率慢,反应如式(1)所示;为了加快浸出速率,通常在浸金液中加入氨与铜形成配离子Cu(NH3)42+,该配离子直接作为氧化剂对金进行浸出,自身被还原为Cu(NH3)2+,在氧气作用下Cu(NH3)2+又被氧化成Cu(NH3)42+,反应如式(2)、(3)所示。
4Au+8S2O32-+O2+2H2O→Au(S2O3)23-+4OH-(1)
Au+5S2O32-+Cu(NH3)42+
→Au(S2O3)23-+4NH3+5Cu(S2O3)35-(2)
Au+2S2O32-+Cu(NH3)42+
→Au(S2O3)23-+2NH3+5Cu(NH3)2+(3)
在浸出过程中,其浓度的大小直接影响金的溶出。铜离子主要与氨形成稳定的配合物,在金的溶解过程中起催化氧化作用。过量的铜离子对硫代硫酸盐有很强的催化和分解作用,是硫代硫酸盐大量消耗的主要原因[2-3];为了使铜离子稳定存在,需加入一定量的氨水,形成Cu(NH3)42+。氨在浸金体系中,除了与铜离子形成络合物之外,它还参与了金的溶出过程[4-5]。
铜-氨-硫代硫酸盐浸出体系各物种繁多,反应较多,各物料之间相互作用和影响,可能存在抑制作用,也可能存在着协同效应,机理较为复杂[6]。因此研究各物料之间相互作用、相互影响以及对金的溶出影响很有必要,电化学方法可以用来研究金的溶出机理[7]。本文采用电化学方法考查了铜-氨-硫代硫酸盐溶金体系中硫代硫酸盐、铜离子、氨及极化电压对金的溶出影响,供金的实际浸出参考。
1 实验
1.1 试剂和仪器
实验所采用的硫代硫酸钠、硫酸铜、盐酸、氢氧化钠、氨水均为分析纯(国药集团化学试剂有限公司),实验用水为二次蒸馏水。
CHI650E电化学工作站(上海辰华);PHS-3C酸度计(上海仪电科学仪器股份有限公司)。
1.2 实验方法
浸金体系由0~0.005 mol/L铜离子、0~0.4 mol/L氨水体系、0~0.1 mol/L硫代硫酸盐组成。在实验中,改变铜离子、氨水、硫代硫酸盐浓度,用交流阻抗和Tafel曲线考查对金的溶出影响。
电化学测试使用三电极系统,其中金电极作为工作电极,铂箔丝作为对电极,饱和甘汞电极(SCE)作为参考电极。交流阻抗的测试采用5 mV的交流扰动信号,频率范围为100 KHz到0.1 Hz,阻抗数据用ZSIMPWin软件进行模拟分析。
所用的等效电路图如图1所示。等效电路图各符号含义为:s代表溶液电阻,p代表电极极化电阻,ct代表金电极被溶出电子转移阻抗,Ω·cm2;1代表电极/溶液双电层,2代表电极/溶质双电层,S·sn·cm-2;代表Warburg阻抗,S·s0.5·cm-2。
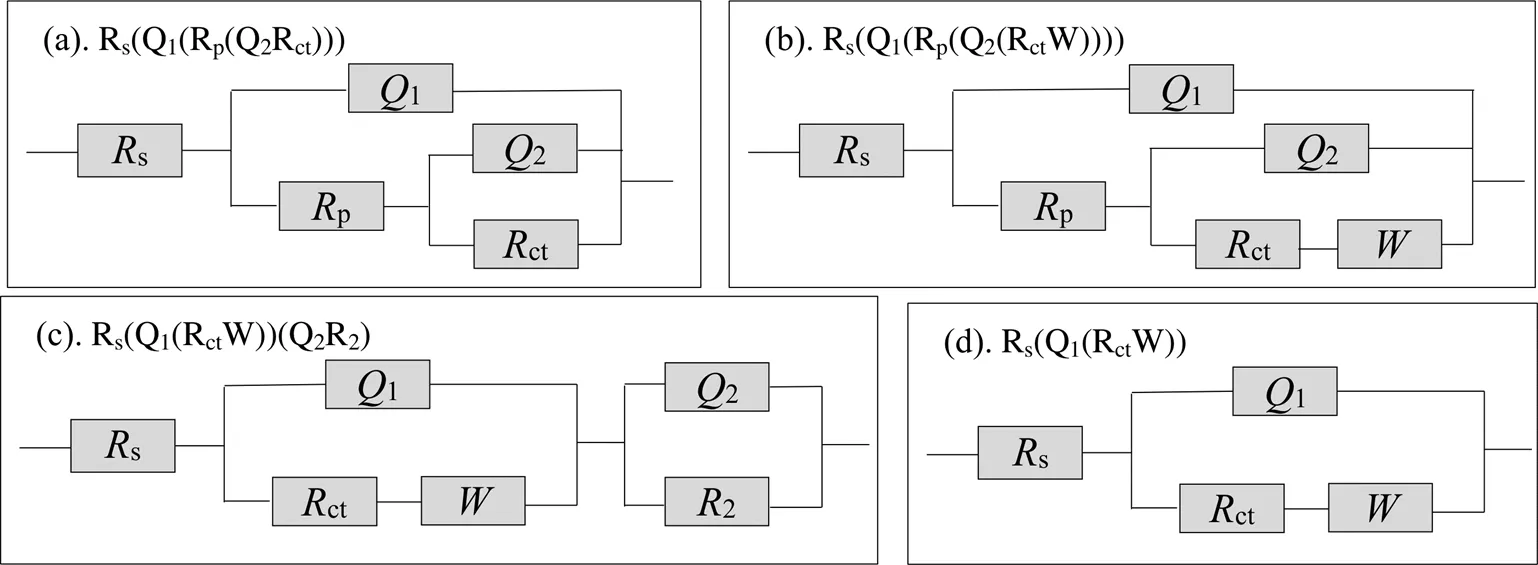
图1 等效电路图
2 结果与讨论
2.1 硫代硫酸盐影响
在含有0.004 mol/L铜离子、0.2 mol/L氨水体系中考查不同硫代硫酸盐浓度下的交流阻抗,结果如图2所示。图2(a)为用Nyquist谱图所表示出来的EIS曲线(交流阻抗也称电化学阻抗谱,简写为EIS)。在等效电路拟合过程中,同一等效电路不能满足所有的情况,原因是随着各物种浓度的改变,导致电极表面活度改变,进而提高了法拉第电流密度[8]。
在本体系中,若不加硫代硫酸盐,可以用图1(a)所示的等效电路图Rs(Q1(Rp(Q2Rct)))来描述该过程,拟合结果列于表1;硫代硫酸盐浓度为0.02~0.08 mol/L时,可以用等效电路图Rs(Q1(Rp(Q2(RctW)))) (图1(b))来描述该过程,拟合结果列于表2;当硫代硫酸盐浓度为0.1 mol/L,可以采用图1(c)所示的等效电路Rs(Q1(RctW))(Q2R2)表示,拟合结果列于表3。
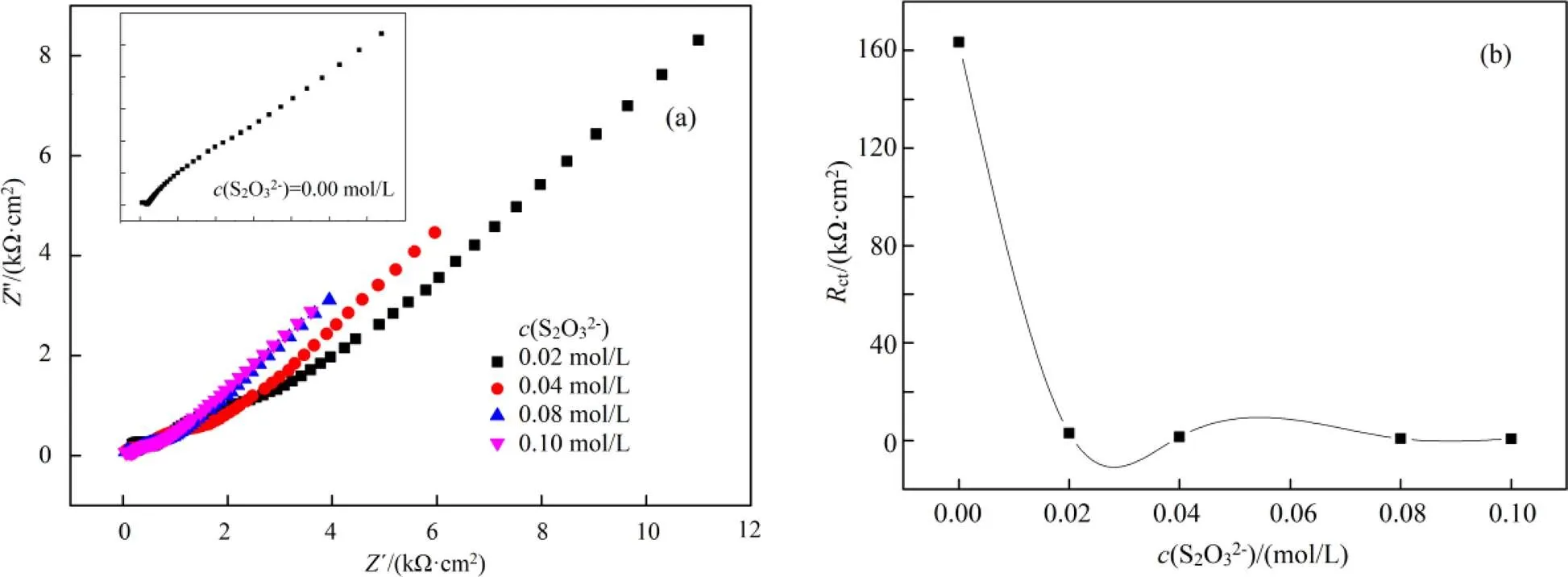
(a). Nyquist谱图(Nyquist plots); (b).Rct vs. c(S2O32-)
表1 0 mol/L硫代硫酸盐的[Rs(Q1(Rp(Q2Rct)))]等效电路拟合数据
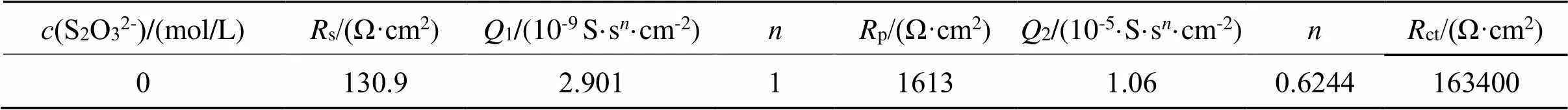
Tab.1 Fitted data by [(Q1(Rp(Q2Rct)))] for0 mol/L thiosulfate
表2 0.02~0.08 mo/L硫代硫酸盐Rs(Q1(Rp(Q2(RctW))))对不同浓度拟合数据
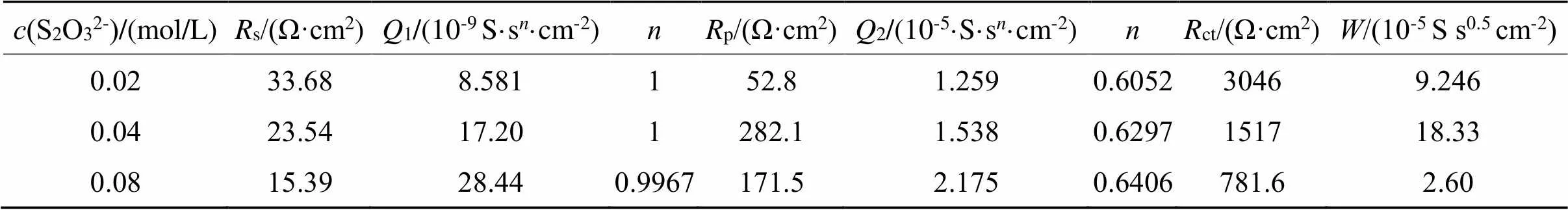
Tab.2 Fitted data by [Rs(Q1(Rp(Q2(RctW))))] for 0.02~0.08 mo/Lthiosulfate
表3 等效电路Rs(Q1(RctW))(Q2R2)对0.1 mo/L硫代硫酸盐浓度拟合数据
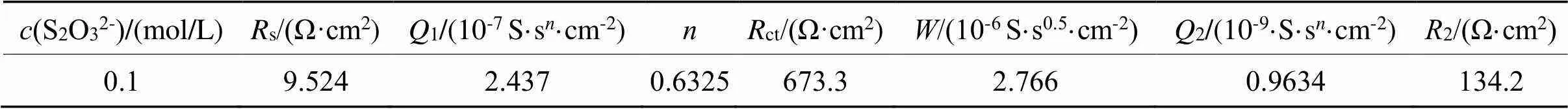
Tab.3 Fitted data by Rs(Q1(RctW))(Q2R2) for 0.1 mo/Lthiosulfate concentration
从表1可以看出,不加硫代硫酸盐,ct非常大,高达163400 Ω·cm2,p也很大,1和2很小。说明不加硫代硫酸盐,金被溶出很困难,其原因是金电极电势(Au+/Au)很大,将会导致金几乎不被溶出。
表2结合图2(b)可以看出,随着硫代硫酸盐的加入(0.02 ~ 0.08 mol/L),s减小,原因是硫代硫酸盐的加入增大了溶液的离子强度,增大了溶液的导电能力;随着硫代硫酸盐的加入,ct急剧减小,说明硫代硫酸盐的加入,促进了金的溶出,加快了金的溶出速率,其原因是硫代硫酸盐与金络合形成了Au(S2O3)23-,导致金的溶出电极电势下降。随着硫代硫酸盐浓度进一步增大,ct进一步减小,但变化不大。
硫酸盐浓度增大,1值也增大,说明储存电荷的能力越强[9-10],最终有利于金的腐蚀。硫代硫酸盐在该浓度范围内,存在着扩散阻抗。值先增大后减小,说明金电极表面存在扩散控制,金表面可能存在着钝化膜,且该膜厚度在不断变化,即金的钝化膜不断形成,之后不断被击穿。根据表3,当硫代硫酸盐浓度增大到0.1 mol/L,生成了较多的Cu(S2O3)35-。Cu(S2O3)35-继续在金电极表面生成了CuS和Cu2S,之后CuS和Cu2S进一步氧化成为SO42-。钝化膜主要含Cu,还有少量的S与O,其主要成分为CuO、CuS、Cu2S。文献报道认为S的含量比O的含量稍高,因此钝化膜主要成分为CuS、Cu2S[11]。以上钝化膜的形成及溶解反应机理可能如式(4)~(10)所示:
2Cu(NH3)42++8S2O32-→2Cu(S2O3)35-+S4O62-+8NH3(4)
2Cu2++8S2O32-→2Cu(S2O3)35-+S4O62-(5)
Cu(S2O3)35-+S2--e-→CuS↓+3S2O32-(6)
2Cu(S2O3)35-+S2-→Cu2S↓+6S2O32-(7)
2OH-+Cu(S2O3)35--e-→CuO+3S2O32-+H2O (8)
4H2O+Cu2S-10e-→2Cu2++SO42-+8H+(9)
4H2O+CuS-8e-→Cu2++SO42-+8H+(10)
2.2 氨浓度影响
在含有0.004 mol/L铜离子、0.1 mol/L硫代硫酸盐体系中考查不同氨浓度下交流阻抗,结果如图3所示,拟合结果列于表4。
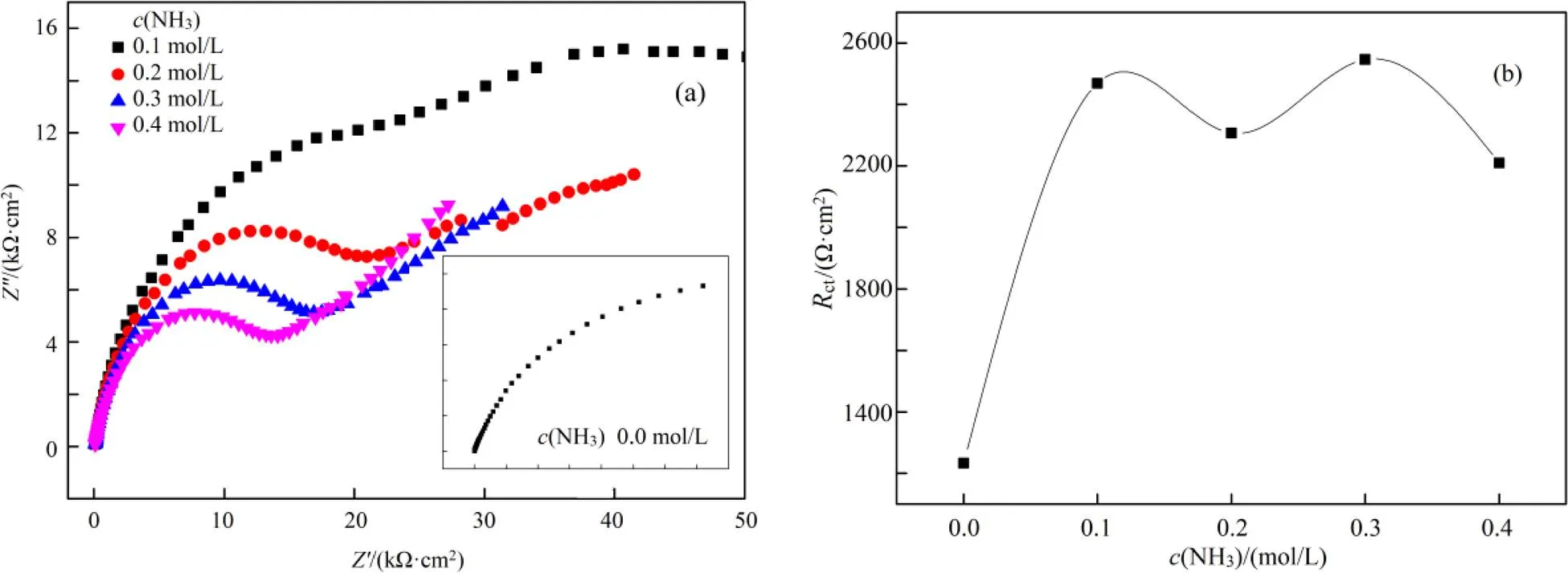
(a). Nyquist谱图(Nyquist plots); (b). Rct vs. c(NH3)
表4 不同浓度氨水的[Rs(Q1(Rp(Q2Rct)))]等效电路拟合数据
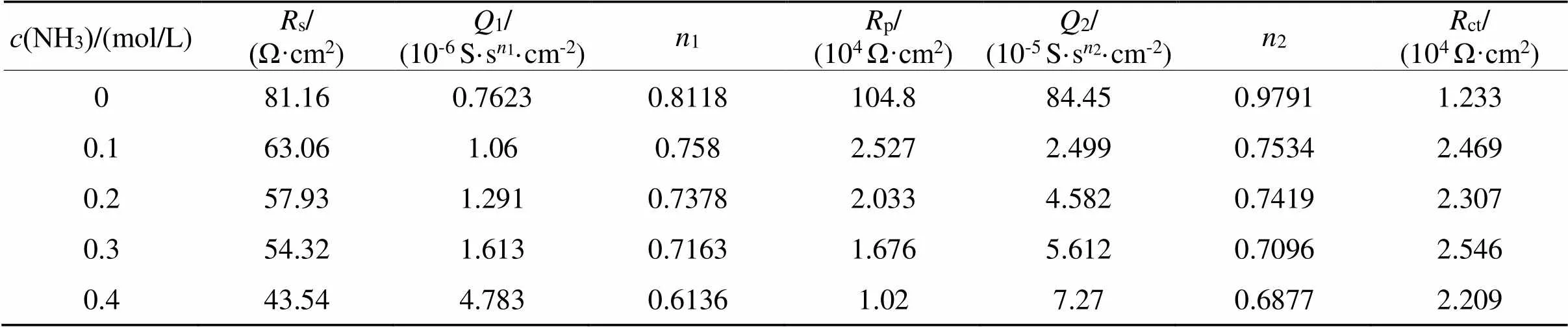
Tab.4 Fitted data by [Rs(Q1(Rp(Q2Rct)))] for different concentrationsof ammonia
图3(a)为用Nyquist谱图所表示出来的EIS曲线。不同浓度氨加入后体系均可以用等效电路图Rs(Q1(Rp(Q2Rct)))来描述。氨浓度增大,反应机理没有改变,文献也表明氨不改变金在硫代硫酸盐体系中的溶金机制,但会减弱硫代硫酸盐在金面的吸附氧化作用[12]。
从图3(b)可以看出,随着氨的加入,ct变大,原因是氨与铜离子构成了Cu(NH3)42+。Cu(NH3)42+/ Cu(S2O3)35-标准电极电势比Cu2+/Cu(S2O3)35-标准电极电势小,降低溶液的混合电位和金的溶出速度。随着氨的进一步加入,ct基本不变,说明氨浓度进一步增大,对金的溶出影响不大。若氨浓度过大,金的溶出按式(11)进行。而Cu(NH3)42+/Cu(NH3)2+标准电极电势比Cu(NH3)42+/Cu(S2O3)35-小,导致体系混合电位下降,对金的溶出不利。
Au+2S2O32−+Cu(NH3)42+
=Au(S2O3)23-+Cu(NH3)2++2NH3(11)
从等效电路拟合数据表4可以看出氨浓度增大,s减小,说明氨的加入明显增大了溶液的离子强度和导电能力。氨浓度增大,1也增大,说明储存电荷的能力越强,最终有利于金的腐蚀。2也随着氨浓度增大而减小,说明弥散效应增大,金电极表面变得粗糙,金的溶出程度加重,即氨的加入有利于金的溶出。注意到没有出现Warburg阻抗(),说明氨的加入及浓度增大有利于消除或减弱钝化现象[13]。原因可能是氨虽不与钝化膜中的CuS反应,但与CuO、Cu2S反应,其机理可能为式(12)~(14):
CuO+4NH3+H2O→Cu(NH3)42++2OH-(12)
2Cu2S+5O2+16NH3+2H2O
→4Cu(NH3)42++2SO42-+4OH-(13)
CuS+2O2+4NH3→Cu(NH3)42++SO42-(14)
由于氨与硫代硫酸盐相比,其在金表面的吸附要弱的多,所以氨不能完全消除钝化层。随着浸出时间延长,金表面仍然会产生钝化层。基于此,可以转化为寻找合适的添加剂,把金表面的钝化层尽可能消除[14]。对比图2(b)与图3(b),氨有利于金的溶出,但对金溶出更重要的因素是硫代硫酸盐。
2.3 铜离子浓度影响
2.3.1 铜离子影响Tafel曲线
在氨浓度为0.2 mol/L,硫代硫酸盐浓度为0.1 mol/L的条件下,考查铜离子对金腐蚀的影响,结果如图4所示。
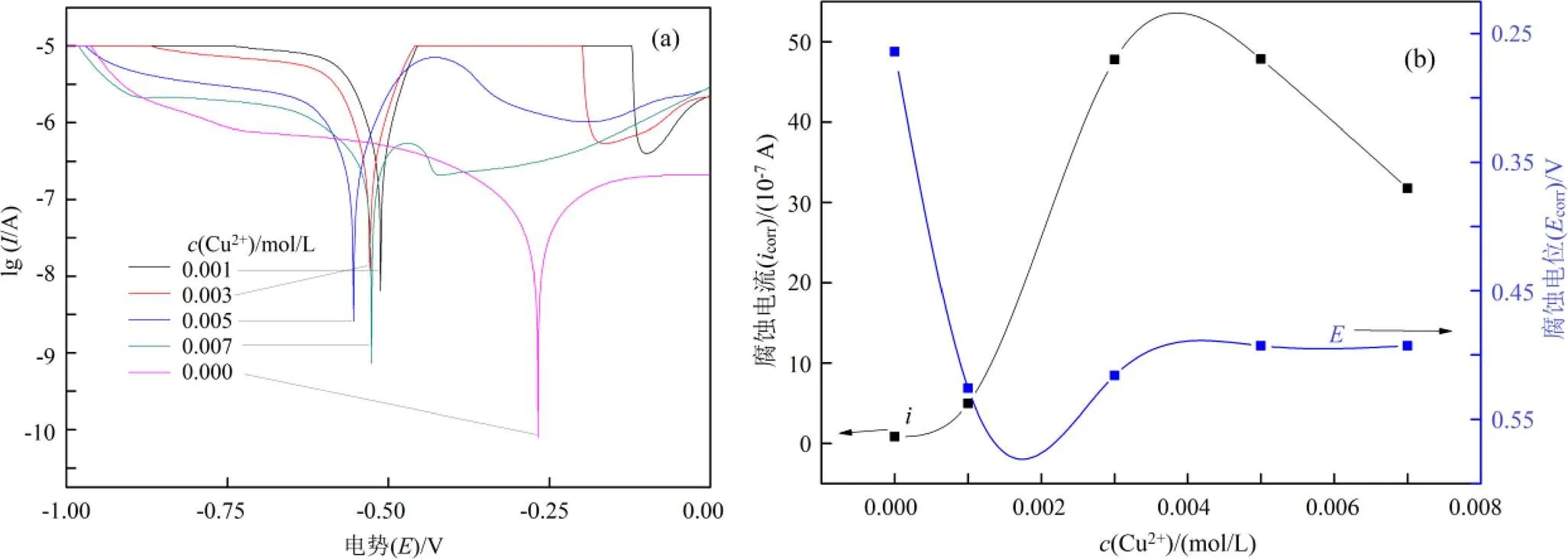
(a). Cu2+ Tafel curve; (b). 腐蚀电位、电流随Cu2+浓度变化(Ecorr & icorrvs. Cu2+)
加入铜离子后,金腐蚀电位大幅度下降,之后随着铜离子浓度进一步增大,金腐蚀电位变化不大,但腐蚀电流有较大的改变。从图4还可以看出,随着铜离子浓度增大,金腐蚀电流先增大后减小,在铜离子浓度为0.004 mol/L时,金腐蚀电位最大。当铜离子浓度超过0.004 mol/L后,金腐蚀电流减小,腐蚀电位基本不变。其原因可能是铜离子浓度增大,导致Cu(NH3)42+增大,有利于金的溶出,但同时加大了对硫代硫酸盐的氧化,因此金的溶出下降,以上反应如式(15)、(16)所示。这说明在其他条件不变时,当铜离子浓度为0.004 mol/L至0.005 mol/L这个范围时,对金浸出最为有利。
Au+5S2O32−+Cu(NH3)42+
=Au(S2O3)23-+Cu(S2O3)35-+4NH3(15)
2Cu(NH3)42++8S2O32−
=2Cu(S2O3)35-+S4O62−+8NH3(16)
2.3.2 铜离子影响交流阻抗
在含有0.1 mol/L硫代硫酸盐、0.2 mol/L氨水体系中考查不同浓度铜离子对金的溶出影响,如图5所示,等效电路拟合数据列于表5~表7。
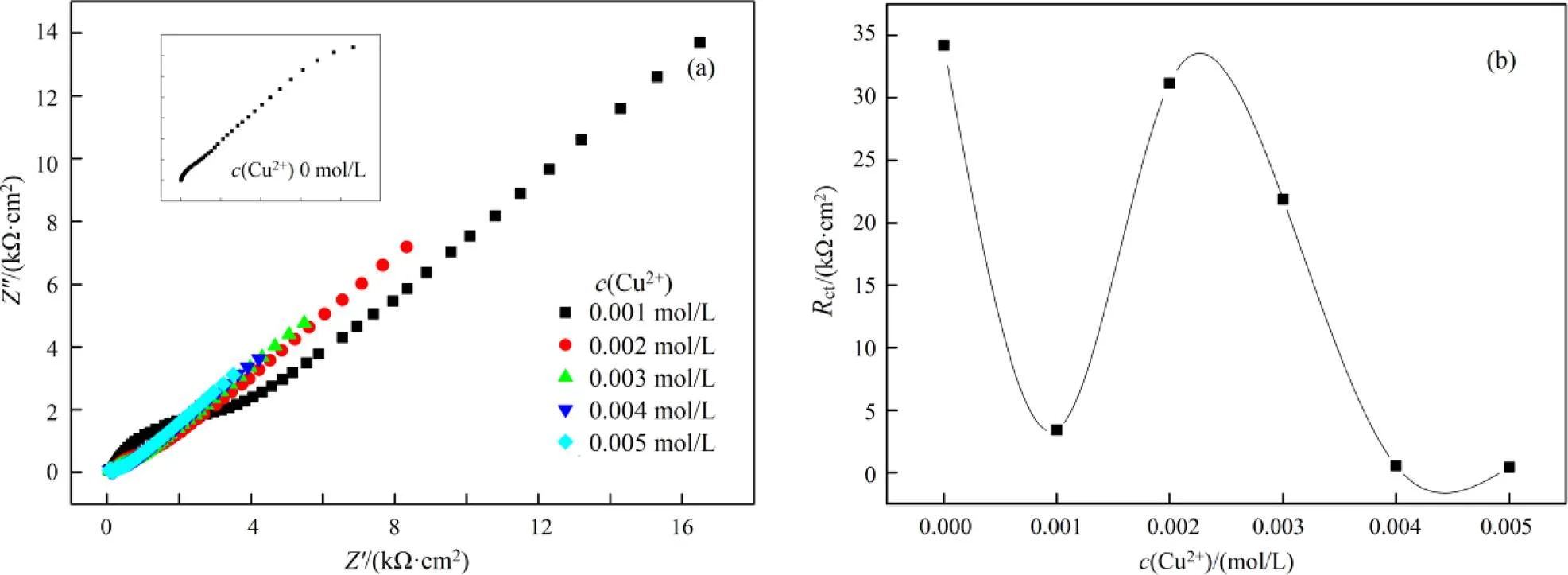
(a). Nyquist谱图(Nyquist plots); (b). Rct vs. c(Cu2+)
表5 等效电路Rs(Q(RctW))对0 mol/L铜离子浓度影响拟合数据

Tab.5 Fitted data by [Rs(Q(RctW))] on the influence of0 mol/L copper ions
表6 等效电路[Rs(Q1(Rp(Q2(RctW))))]对不同铜离子浓度影响拟合数据
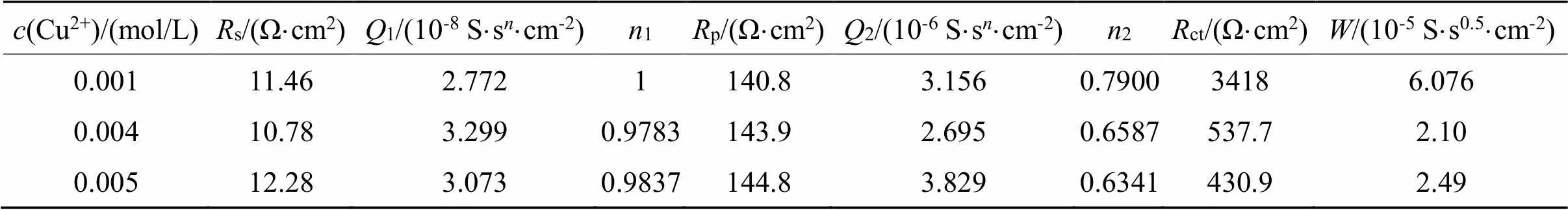
Tab.6 Fitted data by [Rs(Q1(Rp(Q2(RctW))))] on the influence of 0.001~0.005 mo/L copper ions
表7 等效电路Rs(Q1(Rp(Q2Rct)))对0.002-0.003 mol/L铜离子拟合数据
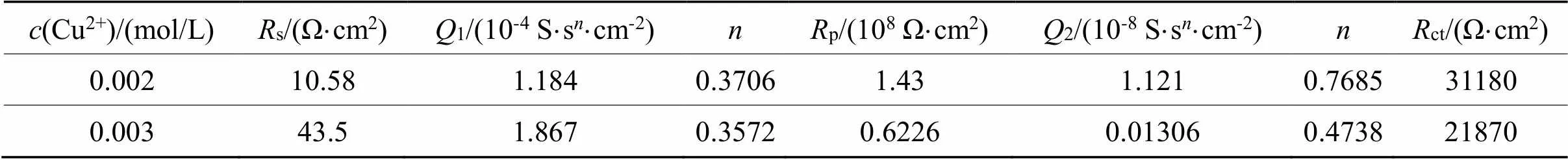
Tab.7 Fitted data by [Rs(Q1(Rp(Q2Rct)))] for 0.002~0.003 mol/L copper ions
图5(a)为用Nyquist谱图所表示出来的EIS曲线。在本体系中,若不加铜离子,可以用等效电路图Rs(Q(RctW))来描述;当铜离子浓度0.001、0.004、0.005 mol/L时,可以用等效电路图Rs(Q1(Rp(Q2(RctW))))来描述;当铜离子浓度为0.002 mol/L、0.003 mol/L时,可以用等效电路图Rs(Q1(Rp(Q2Rct)))来描述。不同铜离子浓度需要用不同的等效电路表示,这说明铜离子的浓度对金的溶出影响较为复杂。
从图5(b)可以看出,当铜离子浓度为0.001 mol/L时,ct急剧下降,铜离子的加入明显的促进了金的溶出,原因是铜与氨形成的Cu(NH3)42+有催化作用。当铜离子的浓度为0.002 mol/L时,ct较大,说明反应阻力较大,当铜离子浓度为0.004 mol/L时,ct较小,反应速率较快。当铜离子浓度从0.004 mol/L增大到0.005 mol/L时,ct稍稍变小,但Warburg阻抗()增大,p增大,说明传质阻力增大。从交流阻抗分析可以得出,在含有0.1 mol/L硫代硫酸盐,0.2 mol/L氨水体系中,当铜离子浓度在0.004 ~0.005 mol/L范围内,金溶出ct较小,该结果与图4所显示的Tafel曲线一致。
从表5可以得出当铜离子浓度变化时交替出现Warburg阻抗、电荷传递过程和扩散控制。再加上ct变化呈波浪形,说明铜离子浓度增大可能会导致金表面钝化,这种钝化现象也是交替出现[15]。原因可能是在金的溶出过程中,首先产生了钝化,之后钝化出现溶解。钝化的出现与溶液的混合电位和铜离子浓度有关。从以上分析来看,硫代硫酸盐浓度增大对金的溶出有利,氨的浓度改变对金的溶出影响不大。对金的溶出影响来看,铜离子、硫代硫酸盐是导致金表面钝化可能的原因,而氨水不会导致钝化或钝化程度较少。从对金的溶出速率影响来看,硫代硫酸盐、铜离子极大促进了金的溶出,而氨使金的溶出速率变小,但氨浓度增大后,对体系稳定有促进作用。
2.4 极化电压影响
实际浸出时,不同的电位将会影响金的溶出和硫代硫酸盐的氧化。溶液的混合电位是通过调节通氧、铜离子、配体浓度及比例而实现的。为了考查浸出体系受电位的影响,把金电极控制在不同的电位下来分析金的溶出影响。
在含硫代硫酸盐0.1 mol/L、铜离子浓度0.004 mol/L、氨浓度0.2 mol/L、pH为10的铜-氨-硫代硫酸盐体系体系中,考查不同极化电压对溶金的影响,结果如图6所示,等效电路拟合结果列于表8。
图6(a)为所测得的用Nyquist谱图表示的EIS曲线,该过程可以用等效电路Rs(Q(RctW))来描述。从图6(b)中ct变化可以看出,随着极化电位的升高,ct先增大后减小,除了极化电压为0.2 V时ct最高之外,其余极化电压下的ct变化并不是太明显。当极化电压为0.2 V时ct最大,说明当极化电压为0.2 V时,金的溶出变得困难,金电极表面钝化最严重;当极化电位大于0.2 V后,金电极表面发生了氧化反应,钝化层可能被局部击穿,“钝化层”被部分氧化,释放了金表面的部分反应活性面。金表面钝化层的形成可能是按照式(6~8)进行的,钝化层主要成分是铜的硫化物或氧化物,当极化电位足够高后,可能是按照式(9~10)进行的。
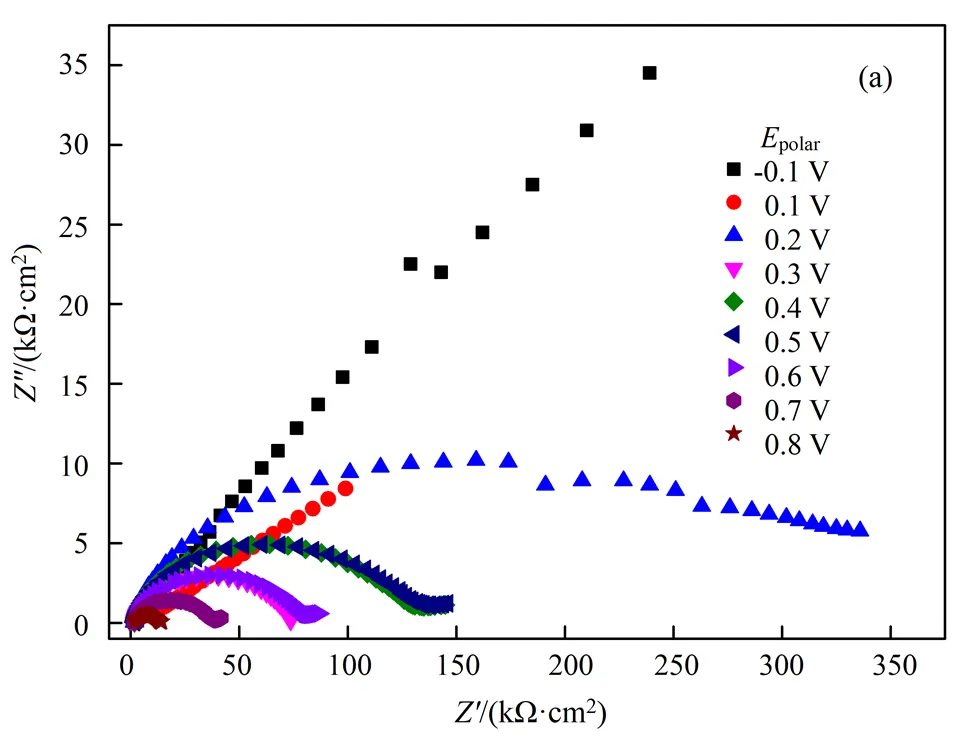
(a). Nyquist谱图(Nyquist plots); (b).ct随极化电压变化(ct.polar);(c). W随极化电压变化(.polar)
图6 铜-氨-硫代硫酸盐体系极化电压对金的溶出影响
Fig.6 Effect of polarization voltage on the gold dissolution in Cu2+-NH3-S2O32-system
表8 等效电路Rs(Q(RctW))对铜-氨-硫代硫酸盐体系随极化电压拟合数据
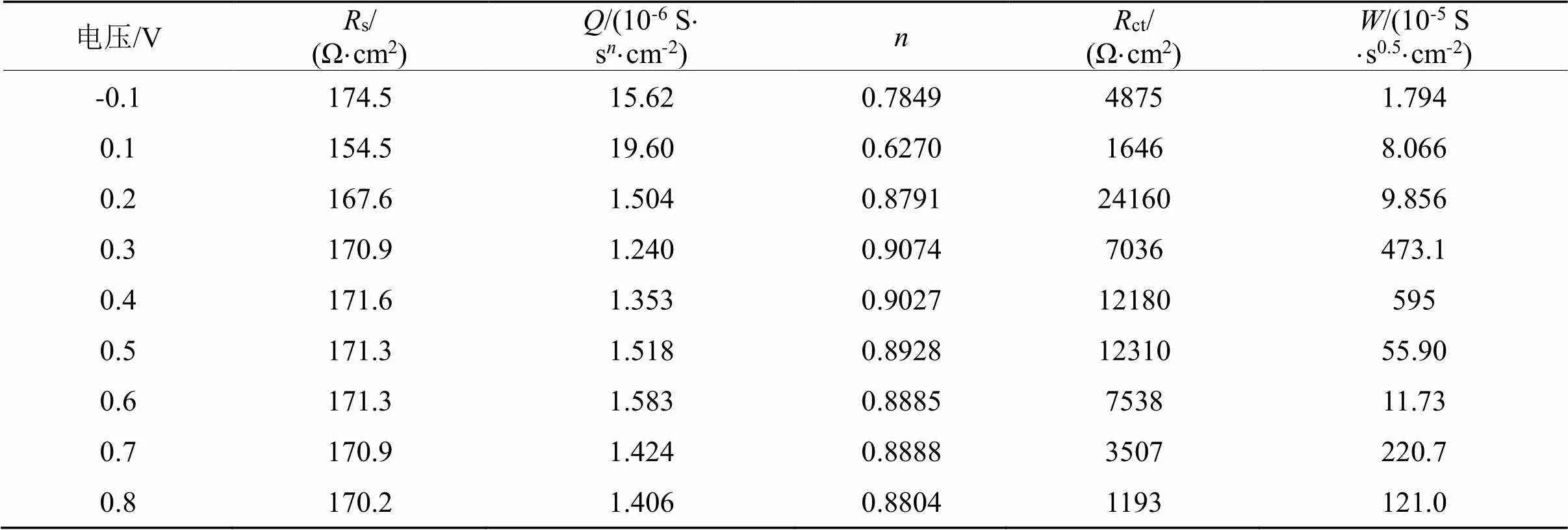
Tab.8 Fitted data by [Rs(Q(RctW))] with voltage in Cu2+-NH3- S2O32- system
从ct变化来看,当极化电压达到了0.4~0.5 V,ct基本保持不变,表明可能出现了新的钝化。该范围的钝化层相对于极化电位为0.1 V的钝化层,钝化层被局部溶解。此时钝化层主要成分可能是CuO,CuO不能随着极化电压升高而被彻底反应。当极化电压为0.6~0.7 V后,ct下降,此时钝化层被进一步溶解,反应速率加快。该研究结果与文献一致:Zhang通过电化学研究表明随着铜浓度增加,在0.3 V电位下,金溶解速率提高,而较低电位会导致钝化[4]。
从图6(c)还可以看出,当极化电压为0.3~0.4 V范围内,值较大,说明金电极存在着较大的扩散阻力,在铜-氨-硫代硫酸盐体系实际浸出时,在矿石表面也可能有钝化层出现,随着浸出的进行,钝化层将不断破环,之后随着反应不断进行,又可能形成了新的钝化层。在实际浸出过程中,决定体系混合电位主要是铜离子、配体、溶解氧的浓度。可以通过调节铜离子、配体浓度、搅拌速度来控制溶液混合电位,使之极化电位为0.1 V,既满足浸出要求,而钝化现象较小。
3 结论
1) 在铜-氨-硫代硫酸盐体系中,若不加硫代硫酸盐,金的溶出非常困难,硫代硫酸盐浓度增大有利于金的溶解,之后硫代硫酸盐浓度进一步增大对溶金影响不大。
2) 铜离子加入极大的促进了金的溶出速率;铜离子浓度进一步增大使反应复杂,金的溶出速率呈波浪形变化。
3) 氨不改变金在硫代硫酸盐体系中的溶金机制,氨浓度进一步增大对金的溶出影响相对较小。
4) 电化学分析表明,影响金溶出的大小为:硫代硫酸盐>铜离子>氨水。在该体系中,可以通过调节铜离子、配体浓度、搅拌速度来控制溶液混合电位,使极化电位为0.1 V,可以实现较好的溶金效果。
[1] CHU C K, BREUER P L, JEFFREY M I. The impact of thiosulfate oxidation products on the oxidation of gold in ammonia thiosulfate solutions[J]. Minerals Engineering, 2003, 16(3): 265-271.
[2] BYERLEY J J, FOUDA S A, REMPEL G L. Activation of copper(II) ammine complexes by molecular oxygen for the oxidation of thiosulphate ions[J]. Chemischer Information- sdienst, 1975, 6(40): 1329-1338.
[3] BYERLEY J J, FOUDA S A, REMPEL G L. Kinetics and mechanism of the oxidation of thiosulphate ions by copper(II) ions in aqueous ammonia solution[J]. Journal of the Chemical Society, Dalton Transactions, 1973(8): 889-893.
[4] ZHANG S C, NICOL M J. An electrochemical study of the dissolution of gold in thiosulfate solutions. Part II. Effect of copper[J]. Journal of Applied Electrochemist, 2005, 35(3): 339-345.
[5] BREUER P L, JEFFREY M I. An electrochemical study of gold leaching in thiosulfate solutions containing copper and ammonia[J]. Hydrometallurgy, 2002, 65(2/3): 145-157.
[6] 项朋志, 叶国华. 硫代硫酸盐-EDTA-铜离子浸金体系电化学研究[J]. 稀有金属, 2020, 44(2): 220-224.
XIANG P Z, YE G H. Electrochemical study on gold leaching system of thiosulfate-EDTA-copper[J]. Rare Metals, 2020, 44(2): 220-224.
[7] 陶媛媛, 项朋志, 周小华, 等. 硫脲浸金电化学行为研究[J]. 贵金属, 2021, 42(1): 22-27.
TAO Y Y, XIANG P Z, ZHOU X H, et al. Study on the electrochemical behavior of thiourea leaching gold[J]. Precious Metals, 2021, 42(1): 22-27.
[8] 曹楚南, 张鉴清. 电化学阻抗谱导论[M]. 北京: 科学出版社, 2002.
CAO C N, ZHANG J Q. Introduction to electrochemical impedance spectroscopy[M]. Beijing: Science Press, 2002.
[9] 崔晓莉, 江志裕. 交流阻抗谱的表示及应用[J]. 上海师范大学学报(自然科学版), 2001(4): 53-61.
CUI X L, JIANG Z Y. Expression and application of AC impedance spectrum[J]. Journal of Shanghai Normal University (Natural Science Edition), 2001(4): 53-61.
[10] 何斌. 氯化钠污染砂环境下砂粒粒径对体系及X70钢电化学腐蚀行为的影响[D]. 太原: 太原理工大学, 2016.
HE B. Effect of sand particle size on electrochemical corrosion behavior of system and X70 steel in sand environment polluted by sodium chloride[D]. Taiyuan: Taiyuan University of Technology, 2016.
[11] 刘志雄. 氨性溶液中含铜矿物浸出动力学及氧化铜/锌矿浸出工艺研究[D]. 长沙: 中南大学, 2012.
LIU Z X. Study on leaching kinetics of copper bearing minerals and leaching process of copper oxide/zinc ore in ammoniacal solution[D]. Changsha: Central South University, 2012.
[12] AYLMORE M G, MUIR D M. Thiosulfate leaching of gold-A review[J]. Minerals Enginerals, 2001, 14(2): 135-174.
[13] 聂彦合. 连多硫酸盐对硫代硫酸盐浸金过程的影响及调控研究[D]. 昆明: 昆明理工大学, 2017.
NIE Y H. Effect and regulation of polysulfates on gold leaching process of thiosulfate[D]. Kunming: Kunming University of Science and Technology, 2017.
[14] 项朋志, 刘龙江, 黄遥, 等. 硫代硫酸盐-EDTA-铜离子体系浸金工艺研究[J]. 稀有金属, 2020, 44(5): 555-560.
XIANG P Z, LIU L J, HUANG Y, et al. Study on gold leaching process of thiosulfate-EDTA-copper ion system[J]. Rare Metals, 2020, 44(5): 555-560.
[15] 叶超, 杜楠, 赵晴, 等. 不锈钢点蚀行为及研究方法的进展[J]. 腐蚀与防护, 2014, 35(3): 271-276.
YE C, DU N, ZHAO Q, et al. Advances in pitting behavior and research methods of stainless steel[J]. Corrosion and Protection, 2014, 35(3): 271-276.
Electrochemical study on the factors affecting the dissolution of gold in the copper-ammonia-thiosulfate system
XIANG Pengzhi1, 2, ZHANG Ya3, DENG Feiyu4, LIU Qiong2, DENG Chao2, YE Guohua1*
(1. Faculty of Land Resource Engineering, Kunming University of Science and Technology, Kunming 650093, China; 2. School of Chemical Engineering, Yunnan Open University, Kunming 650023, China; 3. Yunnan Academy of Traditional Chinese Medicine, Kunming 650021, China; 4. Wuhua Branch of Kunming Bureau of Ecology and Environment, Kunming 650030, China)
The dissolution of gold in copper-ammonia-thiosulfate leaching system is essentially an electrochemical process. In this paper, AC impedance and Tafel curves were used to analyze the influence of thiosulfate, copper ion and ammonia concentration on the dissolution of gold. The results show that thiosulfate and copper ions may cause passivation during the leaching process of gold. Especially when the concentration of copper ions increases, the passivation will occur alternately. However, ammonia does not lead to passivation. As for the dissolution rate of gold, the effect of thiosulfate is the largest but copper exerts the most complext inflenence.
thiosulfate; gold leaching; AC impedance; electrochemistry; dissolution effect
TK91
A
1004-0676(2023)04-0020-08
2022-11-02
云南省教育厅(2021J1374,2021J1378);云南开放大学科研基金(21YNOU03)
项朋志,男,博士,教授;研究方向:稀贵金属提取与分离;E-mail: xpzynkd@163.com
叶国华,男,博士,副教授;研究方向:稀贵金属选冶;E-mail: ghye581@163.com
