红花羊蹄甲花瓣花色苷的组分鉴定及其稳定性研究
2024-01-18龙勇益陈玉娇郭松周永升严其伟卢祥张鹏
龙勇益,陈玉娇,郭松,周永升,严其伟,卢祥,张鹏*
1(广西科技师范学院 食品与生化工程学院,广西 来宾,546199)2(广西科技师范学院 壮瑶药品质生物学 重点实验室,广西 来宾,546199)
红花羊蹄甲(BauhiniablakeanaDunn.)又称为洋紫荆、艳紫荆,是我国岭南一带的一种绿化观光树种,也是羊蹄甲属中较为常见的一个品种[1]。红花羊蹄甲的叶、根、树皮和花可做药用,其具有止血、健脾燥湿、润肺止咳、消炎的功效,可治疗咯血、消化不良、咳嗽、便秘、肝炎、肺炎等疾病[2]。红花羊蹄甲的花期长、花量大、花色艳、花味香,花瓣含有丰富的花色苷类物质,水溶性好、色值高,具有抗氧化及清除自由基、抗突变、抗癌、抗炎及抗病毒等多种生物活性[3]。在每年的冬季至次年的春季间红花羊蹄甲的花瓣自然飘落而废弃,宝贵的天然色素资源被浪费掉。研究红花羊蹄甲花色苷类物质的组成和种类及其稳定性,对提高红花羊蹄甲资源的综合利用率及深加工技术和应用产品的开发具有重要意义。
目前关于红花羊蹄甲花色苷的提取方法[4-5]、抗氧化活性[6]和水提取物毒理学研究[7]已有文献报道,但红花羊蹄甲花呈色的物质基础、花色苷类型和组成、分子的化学和空间结构等缺少研究。因此,本文从红花羊蹄甲花瓣中提取天然色素,利用HPLC分析鉴定红花羊蹄甲花色苷组分,并探讨pH值、温度、光照、金属离子等对红花羊蹄甲色素的影响,为红花羊蹄甲色素应用于功能性食品、生物医学和制药等行业提供理论基础,旨在扩大红花羊蹄甲的应用领域。
1 材料和方法
1.1 材料
红花羊蹄甲花瓣采自广西来宾,原料通过恒温鼓风干燥箱45 ℃烘干,粉碎之后过60目筛,放置于干燥阴凉处避光保存备用。
乙醇、盐酸、KCl、醋酸钠、柠檬酸、柠檬酸三钠、Na2HPO4、Na2CO3、NaHCO3、NaCl、CaCl2、MgCl2、FeCl2、乳糖、蔗糖、葡萄糖、麦芽糖、山梨醇,均为分析纯,北京化工;矢车菊素-3-葡萄糖苷标准品(纯度≥98%),南京源植生物科技有限公司;试验过程中使用的水均为去离子水。
1.2 仪器
FA-2004B电子天平,上海越平科学仪器有限公司;HH-S2数显恒温水浴锅,金坛市医疗仪器厂;FW-135超微粉碎机,天津市泰斯特仪器有限公司;R-1001VN旋转蒸发仪、SHB-IIIG循环水式多用真空泵,郑州长城科工贸有限公司;XH-MC-1微波合成仪,北京翔鹄科技发展有限公司;STA250热重分析仪,德国NETZSCH;UV-5100紫外分光光度计,上海元析仪器有限公司;FD5-3真空冷冻干燥机,美国SIM International Group;CR-5色彩色差仪,柯尼卡美能达控股公司;U3000液相色谱,赛默飞世尔科技(中国)有限公司;FOCUCY球磨仪,湖南弗卡斯实验仪器有限公司。
1.3 试验方法
1.3.1 色素的提取
参照焦淑清等[8]的方法并做适当修改。原料经粉碎,过60目筛,准确称取4.0 g的花瓣粉末置于250 mL的三角烧瓶中。按料液比1∶30(g∶mL)加入120 mL酸性乙醇,放置于微波合成仪中。600 W功率微波下处理90 s,抽滤,旋转蒸发减压浓缩至80 mL,用pH 3.0的柠檬酸-柠檬酸三钠缓冲溶液定容至250 mL,即得花瓣花色苷提取液,浓缩、冻干,于-18 ℃避光备用。
1.3.2 总花青素含量
采用pH示差法[9-10]测定总花青素的含量:准确称取红花羊蹄甲色素冻干粉0.25 g,先用60%(体积分数)乙醇溶解,后用蒸馏水定容至25 mL容量瓶中制成待测液。分别取0.3 mL的待测液于10 mL容量瓶中,用pH 1.0的缓冲液(125 mL 0.2 mol/L KCl与375 mL 0.2 mol/L 盐酸混匀)和pH 4.5的缓冲液(400 mL 1 mol/L醋酸钠、240 mL 1 mol/L 盐酸与360 mL双氧水混匀)定容至刻度,避光反应30 min,分别在525 nm和700 nm处测定吸光值。平行测定3次,根据公式(1)计算花青素含量。
(1)
式中:A=[(A525-A700)pH 1.0]-[(A525-A700)pH 4.5];MW,矢车菊-3-葡萄糖苷的相对分子质量(449.2 g/mol);DF,稀释因子;V,萃取物体积,mL;ε,矢车菊-3-葡萄糖苷的摩尔消光系数[26 900 L/(mol·cm)];L,比色皿径长度(1 cm);m,样品的质量,g。
1.3.3 色度的测定
取0.25 g色素冻干粉用柠檬酸-磷酸盐缓冲液(pH 3.0、5.0、7.0)溶解,另取0.25 g色素冻干粉用Na2CO3-NaHCO3缓冲液(pH 9.0、11.0)溶解,两者均定容至25 mL棕色容量瓶中,制得质量浓度10 mg/mL的色素溶液。色素缓冲液溶液于室温下放置30 min后,取10 mL的色素溶液于试管中用色彩色差仪测定其色度值。色度值采用CIEL*a*b*色度空间表示,其中L*代表明亮度,a*代表红绿度,b*代表黄蓝度。
1.3.4 高效液相色谱法鉴定色素组分
1.3.4.1 样品前处理
采用高效液相色谱串联质谱技术测定色素提取物中花青素和花色苷的含量。参照XU等[11]的方法并略加改动。取出超低温(-20 ℃)保存的色素冻干粉,球磨仪(30 Hz,1.0 min)研磨至粉末状;称取100 mg的粉末,溶解于10 mL提取液[V(无水乙醇)∶V(水)∶V(盐酸)=15∶4∶1],40 kHz 超声30 min,沸水浴水解60 min,用提取液补足体积至10 mL,离心(12 000 r/min、3 min),吸取上清液,用0.45 μm微孔滤膜过滤样品,置于进样瓶中,供液相色谱分析。
1.3.4.2 色谱条件
液相色谱条件:AQ C18(5 μm,4.6 mm×150 mm);流动相A:超纯水(含0.1%甲酸),流动相B:乙腈(含0.1%甲酸);洗脱梯度:0.00 min B相比例为8%,2.00 min增至12%,保持3 min,10.00 min 增至20%,12 min增至25%,18 min增至45%,20 min增至80%,30 min降至8%,并平衡2 min;流速1 mL/min;柱温35 ℃;进样量10 μL。
1.3.4.3 标准曲线的绘制及样本含量
配制15、30、60、150、300 μg/mL不同质量浓度的标准品溶液,获取各个浓度标准品的对应定量信号的液相色谱数据,以标准品浓度为横坐标,标准品峰面积为纵坐标,绘制不同物质的标准曲线,相关系数R>0.99。采用一标多定的方法测定对应的花色苷衍生物。样品中花青素含量按公式(2)计算:
(2)
式中:c,样本中色谱峰的峰面积代入标准曲线得到的质量浓度值,ng/mL;V,提取时所用溶液的体积,μL;m,称取的样本质量,g。
1.3.5 稳定性试验
1.3.5.1 热重分析试验
称取一定质量的色素冻干粉,置于氧化铝坩埚中,采用热重分析仪进行热分析测试。初始温度25 ℃,升温速率10 ℃/min,终止温度1 000 ℃。得到热重(thermogravimetric,TG)图谱,及微商热重(derivative thermogravimetry,DTG)曲线。
1.3.5.2 热稳定性试验
(3)
1.3.5.3 光照对色素稳定性的影响
参照于文娟等[12]的方法进行适当的修改。用0.1 mol/L的柠檬酸-磷酸盐缓冲液(pH 3、pH 7)配制不同的色素溶液(0.8 mg/mL)。取100 mL配制好的色素溶液于具塞刻度试管中,分别置于室内自然光和避光条件下保存,每1 d测定1次色度值,共测定5 d。色度值按照1.3.3节的方法测定,ΔE计算参照公式(3)。
1.3.5.4 金属离子对色素稳定性的影响
用0.1 mol/L的柠檬酸-磷酸盐缓冲液(pH 3、pH 7)配制0.1 mol/L KCl、NaCl、CaCl2、MgCl2、FeCl2溶液,取0.2 g色素冻干粉,用金属盐溶液溶解,定容至100 mL的容量瓶中,振摇均匀,放置于室温阴暗处保存,每1 d测定1次色度值,共测定5 d。色度值按照1.3.3节的方法测定,ΔE计算参照公式(3)。
1.3.5.5 甜味剂对色素稳定性的影响
参考杨雁等[13]的方法进行稍作修改。用0.1 mol/L的柠檬酸-磷酸盐缓冲液(pH 3、pH 7)配制5%(质量分数)的乳糖、蔗糖、葡萄糖、麦芽糖、山梨醇、木糖醇溶液,取0.2 g色素冻干粉,用糖溶液溶解,定容至100 mL的棕色容量瓶中,振摇均匀,室温下避光保存,每1 d测定1次色度值,共测定5 d。色度值按照1.3.3节的方法测定,ΔE计算参照公式(3)。
在物流作业这一环节中,针对作业时间以及货物遗失等来说,订单处理、分拣与验货等都是其关键控制点。要控制关键点,必须明确安全和不安全产品之间的界限,要保证产品安全性,必须严格管理关键控制点,使其处于特定临界范围。可以将临界范围分为三种类型,分别为化学范围、微生物范围以及物力范围。
1.3.6 数据分析
所有试验均重复测定3次,结果以平均值±标准差表示。采用SPSS 22.0软件进行统计分析。采用方差分析(ANOVA)和邓肯检验(Duncan’s test)确定显著性差异(P<0.05)。
2 结果与分析
2.1 色度的影响
从表1可见,随着pH的增加,红花羊蹄甲色素由红色变蓝黑色,色度值基本呈现下降的趋势。pH=3时,色素溶液的色度值最大,其L*、a*、b*值分别为29.74、59.55、21.06,色素呈鲜红色;pH=7时,色素溶液的L*、a*、b*值分别为18.28、23.22、0.42,色素呈暗紫色;当pH=9、pH=11时,L*、b*值最小分别为为1.26、1.72、2.18、2.96,颜色最暗,呈现出蓝黑色。红花羊蹄甲色素溶液的L*、a*、b*值随着pH值的增加而不断减小,其颜色逐步从红色、暗紫色向黑色转变。红花羊蹄甲色素在不同pH值下所呈现出的颜色变化趋势,可能在智能包装膜及在食品工业中有关键应用[14]。

表1 pH值对红花羊蹄甲色素色度影响Table 1 Effect of pH on the color indexes of pigment from B. blakeana flower
2.2 花青素定量定性分析
图1为花青素标准品色谱图。

图1 标准品色谱图Fig.1 Chromatogram of the standards
由表2可知,红花羊蹄甲中花色苷总的花青素含量为11.28 mg/g,主要含有4种花青素单体化合物。其中,飞燕草素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷是所有提取物中的主要化合物,含量最高,为6 801.12、2 069.49 μg/g,显著高于矮牵牛色素和矢车菊素-3-O-葡萄糖苷(84.65、667.9 μg/g)。
2.3 稳定性试验结果
2.3.1 热重分析
由图2和表3可以看出,红花羊蹄甲的热分解根据质量损失可以分为3个阶段,在54.6~111.3 ℃时,主要是红花羊蹄甲色素的自由水和结合水挥发导致质量下降,说明色素经过冷冻干燥后仍然含有3.59%的水分。经过一段时间的升温后,温度达到111.3~257.9 ℃时,色素开始有少量的损失,损失率为27.16%,这可能是由于色素中残余的小分子物质发生热解吸[15]。当温度由257.9 ℃升至600 ℃时,色素可能存在其他的热稳定相,质量损失达到最大值,为43.20%;随着温度的上升过程中,色素分解继续,剩余色素的质量为25.79%。伴随着温度的升高,色素的DTG曲线呈现出3个峰形,峰形的拐点分别为173.3、279.2、461.0 ℃。另外,色素的DTA曲线有一个放热峰,峰值为150.1 ℃,温度范围为79.3~183.6 ℃,峰面积为421.9 J/g。以上结果表明红花羊蹄甲的色素在54.6~111.3 ℃具有良好的热稳定性。

表2 红花羊蹄甲花色苷中总花青素含量和花青素单体组成Table 2 Salt sneakhoe nailor pigment pigmentation and cosmetic course content and humanin monochrome

图2 红花羊蹄甲色素TG曲线、DTG曲线和热差分析曲线Fig.2 TG, DTG and DTA curves of pigment from the B. blakeana flower

表3 红花羊蹄甲花色苷热重分析表Table 3 Thermogravimetric stabilities of pigment from the B. blakeana flower
2.3.2 温度的稳定性影响
从图3可知,50 ℃时,pH=3的色素溶液的ΔE随时间的延长增长幅度较小,最高值为2.06,颜色呈粉红色;pH=7的色素溶液的ΔE增长幅度较大,最高值达9.76,色素呈淡红色向淡黄色变化的趋势。75 ℃时,色素随着热处理时间的延长,pH=3和pH=7条件下色素溶液ΔE增长幅度变大,其最高值分别为8.54、17.46,色素在酸性溶液中呈粉红色,碱性溶液中呈淡粉红色向浅黄色过度的现象。当100 ℃时,pH=3的色素溶液的ΔE呈现快速上升的趋势,在10 h时达到峰值,为24.04,色素颜色逐渐从粉红色向淡黄色过渡。在pH=7的色素溶液中也呈现类似的趋势,其颜色从淡紫色向黄色转变。由此可见,色素在酸性溶液(pH=3)中的稳定性强于中性溶液(pH=7)。此外,温度对红花羊蹄甲色素有较大的影响。当温度超过75 ℃后温度对色素缓冲液影响较大,且色素的颜色随着加热时间的延长逐渐变浅。这可能是该色素缓冲液在加热过程中发生氧化反应,导致的共价键断裂以及在此基础上的进一步反应引起的[16]。因此在制备和储存红花羊蹄甲色素时应尽量在低温酸性条件下进行。

a-50 ℃;b-75 ℃;c-100 ℃图3 不同温度条件下红花羊蹄甲色素溶液的色差值(ΔE)Fig.3 The total color difference(ΔE) of the B. blakeana flower at different temperatures注:图中色卡表示色素溶液的颜色变化情况(下同)。
2.3.3 光照的稳定性影响
如图4-a所示,在室内光照射下,随着光照时间的延长,色素溶液ΔE在最初的1 d内迅速增大,随后缓慢上升。其中,在pH=3溶液中,ΔE变化幅度相对较小,为2.79;在pH=7溶液中,ΔE变化幅度相对较大,为6.83。避光条件下(图4-b),红花羊蹄甲色素溶液的ΔE变化幅度有类似的趋势,在酸性溶液中色素溶液ΔE最高为1.83,中性溶液中ΔE最高为6.66。
在pH=7的溶液中,无论是光照还是避光下,色素溶液的ΔE变化幅度较明显,都呈现褪色的趋势。这与姜红[17]对黑胡萝卜花青素的pH和光照稳定性研究结果相同。在pH 3溶液中,色素溶液受光照影响较小。光照会加速花色苷的降解,应避光保存。
2.3.4 金属离子的稳定性影响
由图5可知,当pH=3时,在红花羊蹄甲色素溶液中添加K+、Na+和Ca2+,随着时间的延长,ΔE在最初的1 d内迅速增大,随后缓慢上升,其ΔE最高分别为4.55、5.55、6.43,溶液呈较稳定的粉红色。而添加Mg2+和Fe2+时,ΔE值变化幅度较大,ΔE值最高分别为9.49、16.21。添加Mg2+时,溶液颜色仍为粉红色,添加Fe2+时,溶液颜色呈棕黄色。说明在酸性溶液下,Fe2+对红花羊蹄甲色素有较大影响,K+、Ca2+、Na+和Mg2+影响较小。

a-室内光;b-避光图4 光照条件下红花羊蹄甲色素溶液的色差值(ΔE)Fig.4 The total color difference (ΔE) of the B. blakeana flower at different light

a-K+;b-Na+;c-Ca2+;d-Mg2+;e-Fe2+图5 金属离子对红花羊蹄甲色素溶液的色差值(ΔE)Fig.5 The total color difference (ΔE) of the B. blakeana flower at different metal ions
当pH=7时,添加K+、Ca2+、Na+和Mg2+后,色素溶液ΔE值随时间的延长呈上升趋势,变化趋势较明显,其最大值分别为17.68、9.79、19.28和6.85,溶液颜色从但紫色向淡黄色转变。而添加Fe2+时,随时间的延长,色素溶液ΔE值变化极小,最高值为4.31,色素溶液变暗变黑。
在酸性条件和碱性条件下加入Fe2+的色素溶液颜色加深,表明加入Fe2+对不同色素溶液的稳定性影响都较大,其原因可能是Fe2+会与色素反应,使色素褪色或生成其他颜色的物质[18]。也可能是Fe2+与花青素物质的酚羟基反应生成有色配合物并沉淀。因此在制备和开发红花羊蹄甲色素时应尽量避免与Fe2+接触。
2.3.5 甜味剂的稳定性影响
由图6可知,在pH=3时,添加甜味剂,避光放置1 d后,5种色素溶液的色差值都有所增加。添加乳糖和蔗糖后,在第1天,色差值为2.53和2.78,随后呈缓慢下降趋势,达到第5 d后,色差值为1.97和1.68,溶液的颜色缓慢变化;添加葡萄糖后,在第3天达到最高值,色差值为4.82,随后呈下降趋势。加入麦芽糖、山梨醇后,在贮藏3 d后,色差值为3.94、2.25。随后2 d内,色差值增加到5.28、3.04,溶液的颜色为深红色。因此在酸性条件下甜味剂对色素溶液的影响依次为乳糖<蔗糖<山梨醇<葡萄糖<麦芽糖。
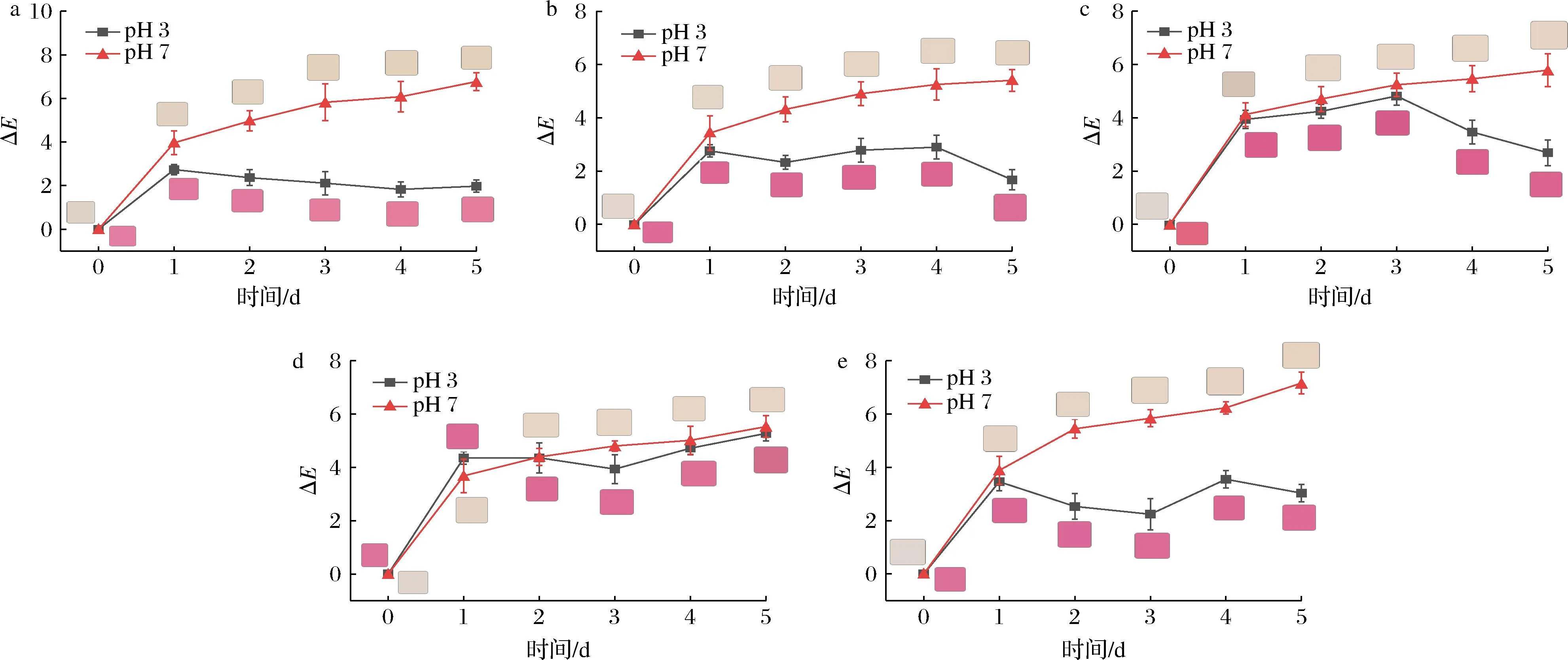
a-乳糖;b-蔗糖;c-葡萄糖;d-麦芽糖;e-山梨醇图6 甜味剂对红花羊蹄甲花色苷溶液的色差值(ΔE)Fig.6 The total color difference (ΔE) of the B. blakeana flower at different sweeteners
当pH 7时,添加乳糖、蔗糖、葡萄糖、麦芽糖和山梨醇后,在最初的1 d内,色度值都快速上升,其色差值为3.97、3.43、4.13、3.69、3.89,在贮藏5 d后,溶液的色差值为6.78、5.41、5.79、5.53、7.17。加入葡萄糖后,色差值在第1天时达到最高值,为4.13,随后缓慢下降,在第2天时,下降到最低点,为4.71。色素溶液颜色普遍趋于由深变浅,这可能是因为色素在pH 7溶液中结构被破坏,颜色变浅,而糖又起到保护作用,减缓了色素的降解。在中性溶液中,麦芽糖和蔗糖对色素的影响最小,而山梨醇对色素的影响最大,乳糖次之。
3 结论
本研究旨在探讨红花羊蹄甲花色苷的组成和其稳定性影响,以期扩大红花羊蹄甲的应用领域。 结果表明,红花羊蹄甲花瓣色素中主要含有矮牵牛色素(84.65 μg/g)和飞燕草素-3-O-葡萄糖苷(6 801.12 μg/g)、芍药素-3-O-葡萄糖苷(2 069.49 μg/g)、矢车菊素-3-O-葡萄糖苷(667.9 μg/g);红花羊蹄甲色素pH稳定性与简单花色苷一致,酸性条件下较稳定,随着pH的增加稳定性下降;红花羊蹄甲色素在54.6~111.3 ℃具有良好的热稳定性;色素溶液在高温光照条件下不稳定,在开发应用以及储藏时应避免高温光照。K+、Ca2+、Na+和Mg2+对红花羊蹄甲色素的影响较小,Fe2+影响较大,在使用制备红花羊蹄甲色素过程中应尽量避免与铁器皿接触;葡萄糖和麦芽糖对酸性条件下的色素溶液具有一定的稳定性。红花羊蹄甲色素含量高,是一种值得开发的新型花色苷色素资源。