两阶段pH控制和碳氮源协同补加促进谷氨酸棒杆菌高产L-谷氨酰胺
2024-01-18刘畅陆丹丹浦军平张春枝陈明
刘畅,陆丹丹,浦军平,张春枝,陈明*
1(大连工业大学 生物工程学院,辽宁 大连,116034)2(张家港市华昌药业有限公司,江苏 苏州,215635)
L-谷氨酰胺是L-谷氨酸的γ-羟基酰胺化产物,是人类及其他哺乳动物体液中含量最丰富的一种游离氨基酸[1],对细胞增殖、保护肠道、减轻炎症、增强免疫、调节相关疾病通路等具有重要生理功能[2-4]。L-谷氨酰胺广泛应用于医药、保健食品、饲料等领域[5-6],其市场需求量日益增加。因此,增加我国L-谷氨酰胺产量、提高其工业化生产水平具有重要意义。
微生物发酵法是L-谷氨酰胺工业化生产的主要方法,具有成本低廉、质量可控、适宜大规模生产等优势。谷氨酸棒杆菌(Corynebacteriumglutamicum)是其主要生产菌种[7],但目前仍存在发酵水平不够高、糖酸转化率低、发酵周期较长等制约工业化发酵生产的关键技术问题。白婧[8]利用枯草芽孢杆菌谷氨酰胺合成酶基因构建重组谷氨酸棒杆菌,摇瓶发酵L-谷氨酰胺产量达32.5 g/L;王书平等[9]通过谷氨酸棒杆菌诱变,筛选L-谷氨酰胺高产菌株,摇瓶产量达33.54 g/L;郭春前等[10]通过优化培养基组分,将L-谷氨酰胺摇瓶产量提高到41.0 g/L;江衍哲[11]对菌种进行基因改造,5 L发酵罐中L-谷氨酰胺产量达57.5 g/L。
谷氨酸棒杆菌生物合成L-谷氨酰胺代谢途径见图1:葡萄糖经过糖酵解途径(embden meyerhof pathway,EMP)生成丙酮酸,进入三羧酸(tricarboxylic acid,TCA)循环,中间产物α-酮戊二酸经谷氨酸脱氢酶(glutamate dehydrogenase,GDH)催化与NH4+反应生成L-谷氨酸,进一步经谷氨酰胺合成酶(glutamine synthetase, GS)催化与NH4+反应生成L-谷氨酰胺,生成的L-谷氨酰胺可在谷氨酸合成酶(glutamate synthase, GOGAT)催化下与α-酮戊二酸反应生成2分子L-谷氨酸。可见,较高的GS活性、较低的GOGAT活性、充足的碳源(葡萄糖)、氮源(NH4+)和ATP供应,是谷氨酸棒杆菌大量合成并积累L-谷氨酰胺的必要条件[12],研究表明,谷氨酸棒杆菌生长最适pH值为7.0左右,GS最适pH为5.6左右,而GOGAT在pH值为7.0~8.0活性较强[8,13]。因此,发酵过程中分阶段控制pH策略有利于前期菌体生长和后期L-谷氨酰胺积累。L-谷氨酰胺的碳骨架来源于葡萄糖,其胺基来源于NH4+,培养基中适宜的碳氮源比例有利于L-谷氨酰胺产量的提高[14];同时,在碳氮源充足的情况下,GS活性相较于氮源不足时更高,而GOGAT的活性则不受影响[15]。因此,在发酵过程中协同补加葡萄糖和(NH4)2SO4,不仅能保证发酵过程中碳氮源充足供应,而且还能提高GS活性。此外,充足的ATP则可通过改善O2供应来实现。基于上述分析,本文在响应面法优化发酵培养基组成的基础上,在50 L发酵罐中采用两阶段控制pH的碳氮源协同补加策略,促进菌体高效合成L-谷氨酰胺,以期为L-谷氨酰胺的工业化发酵生产提供参考。
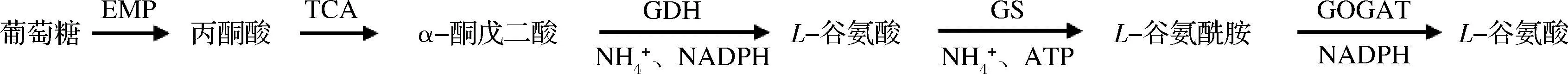
图1 谷氨酸棒杆菌中L-谷氨酰胺生物合成途径Fig.1 Schematic of L-glutamine biosynthetic pathway in C.glutamicum
1 材料与方法
1.1 材料
1.1.1 菌种
谷氨酸棒杆菌(Corynebacteriumglutamicum),大连工业大学生物工程学院微生物菌种室保藏。
1.1.2 仪器与设备
UV-2450紫外可见分光光度计,岛津企业管理(中国)有限公司;SPX-250C恒温恒湿箱,上海博讯实业有限公司医疗设备厂;HYL-B往复式全温摇瓶柜,太仓市强乐实验设备有限公司;TG16-WS台式高速离心机,湘仪集团;50 L自动控制发酵罐,上海百仑生物科技有限公司。
1.1.3 培养基
斜面完全培养基(g/L):牛肉膏15、蛋白胨10、酵母浸粉5、NaCl 5、琼脂粉25,pH 7.0。
种子培养基(g/L):葡萄糖50、玉米浆55、尿素6、KH2PO41、K2HPO41、MgSO4·7H2O 0.5,pH 7.0。
初始发酵培养基(g/L):葡萄糖140、(NH4)2SO450、玉米浆20、KH2PO43.5、MgSO4·7H2O 0.6、MnSO4·H2O 0.01、ZnSO4·7H2O 0.01、CuSO4·5H2O 0.01、CaCO330,pH 7.0。
1.2 实验方法
1.2.1 摇瓶发酵
取生长良好的谷氨酸棒状杆菌斜面菌种,挑取一环,接种到装有50 mL种子培养基的500 mL三角瓶中,于32 ℃、110 r/min振荡培养12 h。按8%接种量将种子液接入装有20 mL发酵培养基的500 mL三角瓶中,32 ℃、110 r/min振荡培养。
1.2.2 发酵培养配方优化
选择发酵培养基中的葡萄糖、(NH4)2SO4和玉米浆作为3个因素,以发酵72 h的L-谷氨酰胺产量为响应值,采用Box-Behnken设计3因素3水平的响应面试验,因素及水平如表1所示。

表1 Box-Behnken试验因素及水平Table 1 Factors and levels in Box-Behnken experiment
1.2.3 50 L发酵罐中L-谷氨酰胺发酵
1.2.3.1 控制pH 7.0的分批发酵
按总装液量35 L配制发酵培养基,灭菌冷却后,调pH 7.0,按照10%接种量接入种子液,100 r/min、32 ℃培养,流加氨水控制发酵液pH 7.0,培养80 h,通气量分阶段控制(0~10 h,0.5 vvm;10~65 h,0.7 vvm;65~80 h,0.5 vvm),当接种后溶氧从100%降至10%时,设置溶氧关联搅拌转速,控制发酵液的溶氧10%~15%范围。
1.2.3.2 两阶段控制pH的碳氮源协同补加发酵
按总装液量35 L配制发酵培养基,灭菌冷却后,调pH 7.0,按照10%接种量接入种子液,100 r/min、32 ℃培养,采用两阶段控制pH:0~12 h流加氨水控制pH 7.0,12 h后控制pH≥5.6,培养52 h,通气量分阶段控制(0~4 h,0.5 vvm;4~32 h,1.1 vvm;32~52 h,0.5 vvm),当接种后溶氧从100%降至10%时,设置溶氧关联搅拌转速,控制发酵液的溶氧10%~15%范围;在发酵过程的第24、36 h时分2次且每次补加2.5 L质量浓度为500 g/L的葡萄糖溶液和1 L质量浓度为300 g/L的(NH4)2SO4溶液。
1.2.4 菌体浓度测定
用0.25 mol/L的盐酸将发酵液稀释到适当倍数后于600 nm波长下测定吸光度。
1.2.5 残糖含量测定
采用斐林试剂滴定法。
1.2.6 (NH4)2SO4含量测定
采用靛酚蓝比色法[16]。
1.2.7L-谷氨酰胺含量的测定
利用纸层析-色斑洗脱比色法测定L-谷氨酰胺含量[17],展开剂为苯酚-水(4∶1,体积比)。配制质量浓度为5、10、15、20、25、30、35、40 g/L的L-谷氨酰胺标准溶液,分别取1 μL点样于滤纸进行层析展开。展开完成后烘干,喷上5 g/L茚三酮-丙酮溶液进行显色。显色后将L-谷氨酰胺显色斑点剪下,装入具塞试管,利用体积比V(0.1% CuSO4)∶V(75%乙醇)=2∶38的洗脱液进行洗脱,洗脱液体积为10 mL,洗脱液置于37 ℃水浴40 min,在波长520 nm的条件下测量吸光度,制作L-谷氨酰胺浓度标准曲线。
取1.5 mL发酵液于离心管中,4 000 r/min离心5 min,取1 μL上清液点样于滤纸进行展开,进行上述相同显色及洗脱操作,在波长520 nm的条件下测量吸光度,对照标准曲线计算相应L-谷氨酰胺浓度。
1.2.8 发酵液pH值的测定
采用pH计测定。
1.3 数据处理与分析
利用Design Expert V 8.0.6软件进行数据处理和分析,使用Origin 2018软件进行方程拟合及绘图。
2 结果与分析
2.1 摇瓶条件下发酵培养基的响应面优化
2.1.1 Box-Behnken试验结果
利用Box-Behnken设计响应面试验,L-谷氨酰胺发酵结果如表2所示。

表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken experiment
2.1.2 方差分析
通过Design Expert V 8.0.6软件分析得到L-谷氨酰胺产量的回归方程如公式(1)所示:
Y=38.49-2.61A+1.23B+0.65C-0.037AB-0.56AC-0.41BC-9.17A2-2.72B2-2.08C2
(1)
用Box-Behnken设计构建数学模型进行回归方程的方差分析,所得结果如表3所示;3种因素交互对响应值的影响所对应的响应面图如图2所示。由表3可知,本次设计所得模型F值为30.21,有较好的显著性(P<0.000 1),失拟项不显著(P=0.109 5>0.05),说明此方程回归显著。在该模型可信度分析中,方程的决定系数R2=0.974 9,说明所得到的L-谷氨酰胺含量的真实值与预测值之间有良好的拟合度,变异系数C·V%=4.25%,小于10%,表明该试验稳定性强,可用此模型来对3种物质对L-谷氨酰胺产量的影响进行分析和预测;调整后的决定系数AdjR2=0.942 6,该模型具有较高的可信度。响应值Y与A、A2、B2显著性差异极显著(P<0.01),与B、C2差异显著(P<0.05),提示各试验因素对L-谷氨酰胺产量的影响并非简单的线性关系,根据回归方程一次项系数的绝对值,可得出影响L-谷氨酰胺产量的主次因素为葡萄糖(A)>(NH4)2SO4(B)>玉米浆(C)。

表3 回归方程的方差分析Table 3 Analysis of variance for regression equation
2.1.3 最佳配方确定与检验
通过Design Expert V 8.0.6软件分析,最适葡萄糖、(NH4)2SO4和玉米浆的添加量分别为167.05、61.08、30.78 g/L,此条件下L-谷氨酰胺的产量达最高值38.89 g/L。数值取整后各因素最适添加量为:葡萄糖167 g/L,(NH4)2SO461 g/L,玉米浆31 g/L。在此条件下重复3次摇瓶发酵试验,L-谷氨酰胺平均产量为38.13 g/L,与理论预测值较为接近,模型模拟结果可信,L-谷氨酰胺摇瓶发酵水平较优化前提高了34.12%。王霞[18]通过响应面法将L-谷氨酰胺摇瓶发酵水平提高了18.0%,达到40.6 g/L;郭春前等[10]通过响应面法优化L-谷氨酰胺发酵培养基,产量提高了37.6%;结果表明响应面法优化培养基组成对于L-谷氨酰胺发酵水平的提高具有显著效果。
2.2 利用50 L发酵罐进行L-谷氨酰胺发酵
2.2.1 控制pH 7.0的分批发酵
在50 L发酵罐中分批发酵进程如图3-a所示。在发酵前期,菌体处于延迟期,葡萄糖消耗慢;从10 h开始,菌体进入对数生长期,生长迅速,葡萄糖消耗量增大,发酵液中的L-谷氨酰胺开始积累;到发酵后期(65 h以后),菌体处于稳定期,菌体量逐渐达到最大值,代谢产物大量积累,碳源被进一步被消耗;发酵至80 h时,L-谷氨酰胺的积累趋近最大值,此时L-谷氨酰胺产量达42.06 g/L,较摇瓶发酵提高了10.31%,按照实际发酵液体积37 L计算,糖酸转化率为25.85%,生产强度为0.53 g/(L·h)。

a-发酵进程;b-菌体生长拟合曲线;c-底物消耗拟合曲线;d-产物生成拟合曲线图3 50 L发酵罐中控制pH 7.0条件下谷氨酸棒杆菌分批发酵进程及动力学模型拟合曲线Fig.3 Batch fermentation process and fitted curve of kinetic models by C.glutamicum in 50 L fermenter with pH 7.0 control
选择Logistic方程[19]对菌体生长进行非线性拟合,结果如图3-b所示,其中R2为0.993 6,菌体生长动力学模型如公式(2)所示:
(2)
选择Luedeking-Piret-Like方程对发酵液中葡萄糖消耗进行非线性拟合,结果如图3-c所示,其中R2为0.994 4,底物消耗动力学模型如公式(3)所示:
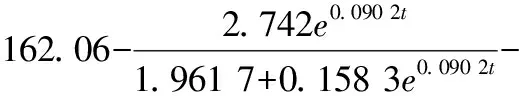
(3)
选用Boltzman模型对产物L-谷氨酰胺生成进行非线性拟合,结果如图3-d所示,其中R2为0.993 8,产物生成动力学模型如公式(4)所示:
(4)
基于对50 L发酵罐中控制pH值为7.0条件下L-谷氨酰胺发酵进程及菌体生长、底物消耗、产物生成动力学分析,可以看出,整个发酵过程中(0~80 h)谷氨酸棒杆菌处于较好生长态势,说明pH值为7.0适合菌体生长,但从葡萄糖消耗和L-谷氨酰胺生成情况来看,葡萄糖代谢生成L-谷氨酰胺的效率并不高,L-谷氨酰胺产量、生产强度和糖酸转化率较工业化生产技术水平还存在较大差距,这可能是由于控制pH值为7.0导致谷氨酸棒杆菌的GS活性较低所致;同时发现,发酵前期菌体生长需要较高的溶氧,所设定的通气量可能无法满足菌体生长所需,而通过溶氧关联搅拌则容易导致搅拌转速过高,产生较大剪切力,不利于发酵初期菌体生长,容易导致菌体絮凝[20]。因此,调整发酵过程通气量并采用分阶段控制pH策略,结合碳氮源协同补加,可能有利于前期菌体生长和后期L-谷氨酰胺积累。
2.2.2 两阶段pH控制下的补料分批发酵结果
在50 L发酵罐中采用两阶段控制pH的碳氮源协同补加策略,发酵结果如图4所示。相较于分批发酵,补料分批发酵过程中菌体生长的延迟期缩短,提前进入对数生长期,说明加大通气量,保持适宜的搅拌转速,有利于促进菌体的生长。培养12 h后控制发酵液pH≥5.6,此时菌体处于对数生长期,pH虽有所变化,但菌体仍保持较高生长速率;同时,葡萄糖和(NH4)2SO4的消耗速率增大,且L-谷氨酰胺产量快速上升,说明pH的改变有利于提高GS活性,促进了菌体利用碳源和氮源生成L-谷氨酰胺,并为碳氮源的补加创造了条件。在发酵的第24、36 h,分2次且每次补加2.5 L 500 g/L的葡萄糖溶液和1 L 300 g/L的(NH4)2SO4溶液,补料后发酵液中的葡萄糖与(NH4)2SO4质量浓度比约为3∶1。在第24 h进行第一次补料时,菌体处于对数生长中后期,菌体生长速度减缓,L-谷氨酰胺的积累量在补料后的第8 h(即培养第32 h)即达到39.30 g/L;在36 h进行第2次补料前,L-谷氨酰胺产量已高于50 g/L,第2次补料后,菌体浓度基本保持稳定,葡萄糖和(NH4)2SO4持续被消耗,产物继续积累,但由于补料后发酵液体积增大,L-谷氨酰胺浓度增长速率降低;至52 h时,发酵液中葡萄糖和(NH4)2SO4浓度已处于较低水平,分别为8.53和8.91 g/L,结合50 L发酵罐中发酵液体积已接近上限的考虑,不再进行补料,于52 h结束发酵。

图4 50 L发酵罐中两阶段pH控制的碳氮源协同补加 条件下谷氨酸棒杆菌分批补料发酵Fig.4 Fed-batch fermentation process of C.glutamicum in 50 L fermenter under two-stage pH control combined with synergistic addition of carbon and nitrogen sources
在50 L发酵罐中基于两阶段控制pH的碳氮源协同补加策略,将发酵周期缩短至52 h,L-谷氨酰胺产量达68.01 g/L,按照实际发酵液体积42.50 L计算,糖酸转化率达到33.93%,生产强度为1.31 g/(L·h),显著高于控制pH 7.0的分批发酵结果,这是因为适宜的通气量及搅拌转速促进了菌体生长,同时两阶段控制pH策略提高了菌体的GS活性以及对碳氮源的底物利用速率,而且葡萄糖和(NH4)2SO4的协同补加为L-谷氨酰胺的生成提供了充足的原料,从而促进了谷氨酸棒杆菌高效合成L-谷氨酰胺。李爽等[21]于16 L发酵罐中进行补料分批发酵44 h后,L-谷氨酰胺的产量为52.2 g/L;吕青兰[22]在改造谷氨酸棒杆菌并优化发酵策略后,于5 L发酵罐中补料分批发酵66 h,达到33.5%的糖酸转化率和1.35 g/(L·h)的生产强度。
3 结论
谷氨酸棒杆菌发酵法是目前工业化生产L-谷氨酰胺的主要方法,但存在发酵水平不够高、糖酸转化率低、发酵周期长等制约工业化生产的关键技术问题。本研究利用一株谷氨酸棒杆菌发酵产L-谷氨酰胺,采用响应面法优化了发酵培养基中葡萄糖、(NH4)2SO4和玉米浆含量,并利用50 L发酵罐探究了两阶段控制pH的碳氮源协同补加策略对发酵结果的影响。 结果表明,发酵前期(0~12 h)控制pH 7.0和增大通气量有利于谷氨酸棒杆菌的菌体生长,而发酵中后期(12~52 h)控制pH 5.6有利于提高L-谷氨酰胺合成关键酶GS的活性,从而促进了菌体利用碳源和氮源合成并积累L-谷氨酰胺,并为碳氮源的补加创造了条件。发酵结果显示,50 L发酵罐中采用两阶段pH控制的碳氮源协同补加策略,发酵周期缩短至52 h,L-谷氨酰胺产量达68.01 g/L,糖酸转化率达33.93%,生产强度为1.31 g/(L·h),主要技术指标达到较高水平,对L-谷氨酰胺的工业化发酵生产具有重要参考价值。