荧光定量PCR法检测皮纤维中黄牛、绵羊源性成分研究
2024-01-17周宇东姚艳玲孙世元王文宇刘骆强管佳丽张娜李慧玲
周宇东,姚艳玲,孙世元*,王文宇,刘骆强,管佳丽,张娜,李慧玲
(1.嘉兴市食品药品与产品质量检验检测院,浙江 嘉兴 314050)
0 引言
牛皮纤维是把蓝湿牛皮革通过溶胀、解纤、清洗分离、烘干、开松、梳理等一系列工艺技术处理得到的天然胶原蛋白纤维,具有独特的形态结构特征,优良的拉伸、吸湿和阻燃性能以及突出的抗菌、防霉功能。牛皮纤维作为一种新型的纺织原料,由于其优良特性以及纺织可加工性,可开发休闲服用产品如休闲牛仔布、休闲粗纺呢面料、西服时装面料、高档时装面料、风衣等,贴身服用产品如内衣、袜子等,还可开发天然牛皮纤维皮革制品、植绒布(仿真皮)、水刺无纺布等,应用领域广泛,年产值数十亿元,已经初具市场规模,具有极大的开发应用前景[1-2]。
纺织行业标准FZ/T 01155-2020《纺织品定量化学分析牛皮纤维与某些其他纤维的混合物》于2021 年12 月25 日发布[3]。该标准主要规定了采用常见化学助剂,对牛皮纤维与常规天然纤维、化学纤维的混合物进行鉴别的方法,但是对于牛皮纤维与其他天然皮纤维,如羊皮纤维、猪皮纤维等的混合物,无法进行鉴别。主要原因在于,牛皮纤维虽然与羊皮纤维、猪皮纤维等其他皮纤维的原始形态(在皮中形态)在细微结构上有所区别,但是受机械解纤方法所限,制备得到的皮纤维在外观形态上很相似,都是束形纤维并呈现一定劈裂状,鉴别存在很大困难[4]。并且因动物皮纤维主要成分为I 型胶原蛋白[5],采用常规化学方法无法对其混合物进行定量分析。
目前,市场上主要存在的是牛皮纤维。但纺织品中少量掺杂的其他动物皮纤维,不但会对牛皮纤维纺织品含量分析带来困难,也会让监管形同虚设,维权纸上谈兵,企业产品质量得不到保证,影响皮纤维行业持续健康发展,更对出口贸易带来一定的安全隐患。因此,对牛皮纤维与其他皮纤维的混合物进行准确鉴别的研究已经迫在眉睫。本研究为实现皮纤维产品中常见原料黄牛、绵羊源性成分的鉴别与定量分析,采用实时荧光PCR 技术比较了不同退火温度下,黄牛、绵羊源性成分的扩增效果,利用两种成分浓度比值的对数与两者对应的阈值循环数(Ct)之差存在线性关系,建立了黄牛、绵羊皮纤维的双重定量检测方法。本研究从纺织产业、检验检测行业发展的实际需求出发,结合现有相关国家标准、行业标准,根据牛皮纤维与羊皮纤维的生物分子基因特性对其进行鉴别,研制基于DNA 分子技术的牛皮纤维鉴别方法,为国家、行业标准的制定提供技术参考,具有较大的经济价值、社会效益和现实意义。
1 材料与方法
1.1 材料
1.1.1 主要试剂及样本来源
DNA 提取试剂盒:TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0(宝生物工程(大连)有限公司)。
琼脂糖(Agarose Regular)、50×TAE 缓冲液:生工生物工程(上海)股份有限公司;DNA Marker(100~500 bp)、PCR 预混试剂(TaKaRa TaqTM Version 2.0 plus dye)、实时荧光PCR 试剂:Premix Ex TaqTM(Probe qPCR)(宝生物工程(大连)有限公司)。
实验用的皮纤维样品由嘉兴九沐新材料科技有限公司提供。
1.1.2 引物探针
此研究采用的黄牛、绵羊的引物探针参考SB/T 38164-2019标准,根据仪器的荧光通道设计探针,具体序列见表1,合成公司为生工生物工程(上海)股份有限公司。

表1 目标源性成分及其引物序列
1.1.3 仪器设备
此研究用到仪器设备包括:Tavanced 96SG Biometra PCR 仪(德国耶拿分析仪器股份公司)、Compact S 水平电泳仪(德国耶拿分析仪器股份公司)、Uvsolo 2 touch 凝胶成像仪(德国耶拿分析仪器股份公司)、Legend Micro 21R 离心机(赛默飞世尔科技(中国)有限公司)、MK 10 干式恒温器(杭州奥盛仪器有限公司)、MM400 混合型研磨仪(德国莱驰Retsch 公司)、Roche LightCycler 480Ⅱ实时荧光定量PCR(罗氏诊断产品上海有限公司)。
1.2 实验方法
1.2.1 增菌液中DNA 模板提取
分别收集黄牛皮纤维、绵羊皮纤维,把上述样品剪碎,采用液氮对其进行瞬时冷冻,用混合型研磨仪研磨成粉末状;称取20 mg 样本于1.5 mL 离心管中,加180 μL 裂解液、20 μL 蛋白酶K 和10 μL 的RNase A,56 ℃温育过夜,当有材料无法裂解完全时,需要经12 000 r/min 离心2 min。取上清液于新的1.5 mL离心管中,加200 μL 缓冲液和200 μL 100%乙醇,充分混合均匀。由于皮纤维经过一定的加工,其DNA 含量较低,因此在称取样本时需要增大样本量,本实验重复称样3 次,共60 mg 左右,按上述方法进行裂解,搜集全部裂解液。将裂解液分次全部加入吸附小柱内,将吸附小柱装入配套收集管中,12 000 r/min 离心2 min,弃去滤液;加入500 μL 缓冲液A,12 000 r/min 离心1 min,弃去滤液;然后加入700 μL 缓冲液B,12 000 r/min 离心1 min钟,弃去滤液,重复一次;将小柱放置于收集管中,12 000 r/min 离心2 min,弃去滤液;将吸附小柱放置于新的1.5 mL 离心管中,在柱膜中央处加入50 μL 温浴至65 ℃的洗脱液,静置5 min 后,12 000 r/min 离心2 min,收集的液体即为提取的DNA 溶液。
1.2.2 普通PCR 定性检测
分别配制黄牛、绵羊的单反应体系:Premix Taq(TaKaRa TaqTMVersion 2.0 plus dye)25 μL、上游引物(20 μmol/L)1 μL、下游引物(20 μmol/L)1 μL、DNA 模版2 μL,用ddH2O 补齐至50 μL。PCR 反应条件:94 ℃30 s、58 ℃1 min、72 ℃1 min,40 个循环。采用电泳及凝胶成像分析检测结果,电泳电压设置为90 V,电流500 mA,电泳时间约为40 min。
1.2.3 双重荧光定量PCR 检测
(1)双重实时荧光PCR 检测方法
把黄牛、绵羊的上游引物(10 μM)、下游引物(10 μM)分别进行等体积混合,制成上游混合引物和下游混合引物,同时把黄牛、绵羊的探针(10 μM)也按等体积进行混合,制成混合探针。反应体系配制:Premix Ex Taq(Probe qPCR)(2×)10μL,上游混合引物0.4 μL,下游混合引物0.4 μL,混合探针0.8 μL,样本DNA 为2 μL,无菌去离子水6.4 μL,反应体系共20 μL。PCR反应条件:95 ℃预变性30 s;95 ℃变性5 s,退火温度58 ℃,延伸1 min,共40 个循环。
(2)灵敏度实验
取黄牛、绵羊的DNA 溶液,分别用无菌去离子水稀释至10 ng/μL,然后采用10 倍稀释的方法将DNA 溶液进行梯度稀释,分别制成一组1、10-1、10-2、10-3、10-4ng/μL 系列的DNA 溶液,进行灵敏度实验。
(3)特异性实验
选取黄牛、绵羊和猪的混合DNA 溶液,按照(1)配制反应体系、设置PCR 反应条件,对黄牛、绵羊的双重引物和探针进行特异性实验。
1.2.4 双重荧光定量标准曲线的建立
根据荧光定量PCR 的数学原理,当两个混合物反应同时进行、扩增效率非常接近时,可以近似地认为两者的混合DNA 溶液中,两种成分浓度比值的对数与两者对应的Ct 值之差存在线性关系[6]。通过该方法,可以利用Ct 值之差检测两者成分的比例,进而检测皮纤维的声称含量与实际是否一致。鉴于在日常生活中黄牛皮和绵羊皮使用较为广泛,因此本文选取黄牛、绵羊皮纤维为研究对象,采用(1)建立的双重检测方法,以黄牛检测Ct 值和绵羊检测Ct 值之差的平均值为横坐标,黄牛和绵羊的DNA含量比值的对数为纵坐标,建立标准曲线,进行定量分析。
2 结果与分析
2.1 普通PCR 定性检测
将黄牛皮纤维和绵羊皮纤维按1.2.1 方法提取DNA,然后根据1.2.2 条件进行扩增,结果见图1、图2。由图可知,黄牛皮纤维和绵羊皮纤维DNA 能有效扩增,且扩增片段大小为92 bp 和137 bp,符合目标物片段大小。

图1 黄牛皮纤维扩增产物(注:1 通道为Marker(500 bp),2、3通道为黄牛皮纤维扩增产物)。

图2 绵羊皮纤维扩增产物(注:1 通道为Marker(500 bp),2、3通道为绵羊皮纤维扩增产物)。
在黄牛、绵羊单体系中,加入黄牛、绵羊和猪的混合DNA 溶液,并把混合溶液稀释10 倍,同时进行扩增,凝胶成像结果见图3、图4。由图可知,黄牛和绵羊的引物特异性较好,反应体系中黄牛的扩增片段大小为92 bp,绵羊的扩增片段大小为137 bp,大小都符合目标物片段大小,且在不同的DNA 浓度下没有出现交叉反应的现象。综上所述,方法采用的黄牛、绵羊的引物特异性较好,能对目标物进行定性分析。
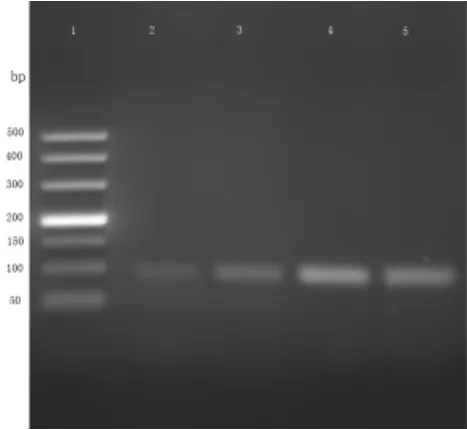
图3 混合DNA溶液中黄牛源性成分扩增结果(注:1 通道为Marker(500 bp),2、3 通道DNA浓度为0.1 ng/μL,4、5 通道DNA浓度为1 ng/μL)。
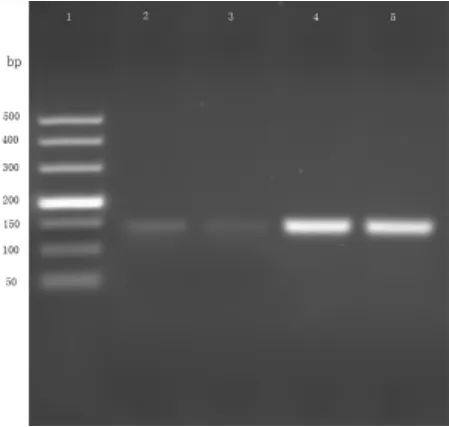
图4 混合DNA溶液中绵羊源性成分的扩增结果(注:1 通道为Marker(500 bp),2、3 通道DNA浓度为0.1 ng/μL,4、5 通道DNA浓度为1 ng/μL)。
2.2 双重荧光定量PCR 检测
2.2.1 双重荧光定量PCR 方法建立
在实际样品中可能同时混有黄牛和绵羊皮纤维,此时在有效定性的前提下需要能进行定量检测,以期对产品成分进行有效鉴定。为了能进行混合样本的双重检测,实验在设计探针时选取FAM 和CY5 两个通道,并进行了方法优化。实验比较了58、60 ℃两种退火温度下的扩增效果,退火温度在58、60 ℃时,黄牛源性成分都能有效扩增,但是在退火温度60 ℃时,绵羊源性成分不能有效扩增,而退火温度为58 ℃时绵羊能有效扩增,绵羊的扩增结果见图5、图6。
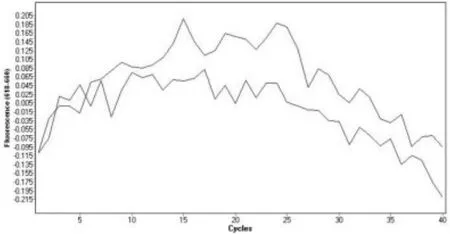
图5 60 ℃时绵羊源性成分的扩增图谱

图6 58 ℃时绵羊源性成分的扩增图谱
2.2.2 灵敏度实验
实验将黄牛和绵羊的DNA 溶液均稀释到10 ng/μL,并稀释2 种DNA 溶液至1 ng/μL,然后按照10 倍稀释梯度进行稀释,制成1、10-1、10-2、10-3、10-4ng/μL 的DNA 稀释液,在双重检测体系中进行梯度实验,每个浓度扩增时做平行实验,扩增结果见图7、图8。
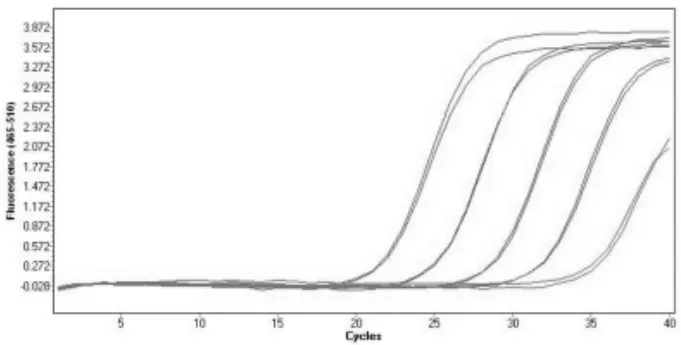
图7 梯度稀释黄牛DNA溶液的荧光PCR 扩增图谱

图8 梯度稀释绵羊DNA溶液的荧光PCR 扩增图谱
计算梯度实验Ct 值的平均值,结果见表2。由结果可知,黄牛和绵羊源性成分在双重检测体系中,均能有效扩增,且随着DNA浓度的降低,Ct值逐渐增大,在10-4ng/μL 时,两者的Ct 值均超过35。因此,黄牛和绵羊在双重检测体系中,最低检测浓度可以达到10-3ng/μL,即方法检出限均为10-3ng/μL。

表2 黄牛、绵羊灵敏度实验的Ct 值
2.2.3 特异性实验
在黄牛绵羊双重检测体系中,采用黄牛、绵羊和猪的DNA 混合溶液进行特异性实验,扩增条件同(1),结果见图9、图10。

图9 黄牛源性成分荧光PCR 扩增图谱

图10 绵羊源性成分荧光PCR 扩增图谱
由上图可知,在常见的动物皮纤维混合DNA溶液中,黄牛和绵羊源性成分能通过本文建立的双重检测体系被检出,而猪源性未被检出,说明双重检测体系采用的引物和探针特异性较好,未出现非特异性扩增,能满足检测要求。
2.2.4 定量标准曲线的建立及含量检测
将黄牛皮纤维和绵羊皮纤维按表3 的比例进行混合,制成标准混合物各10 g,剪碎后,将它们用液氮瞬时冷冻,采用混合型研磨仪将其研磨粉碎,制成混合纤维粉,按照1.2.1 方法提取DNA,每个样本做6 个平行实验。

表3 黄牛、绵羊皮纤维混合物制备比例
以黄牛Ct 检测值和绵羊Ct 检测值6 个平行样差值的平均值为横坐标,黄牛和绵羊的比值的对数为纵坐标,对9 个点进行曲线拟合,所得线性回归方程为y=-0.3037x-0.2996,相关系数R2 为0.995 4,见图11。

图11 黄牛绵羊皮纤维定量检测标准曲线
实验模拟实际样本,制作含黄牛皮纤维50%、绵羊皮纤维50%的样本(黄牛与绵羊的含量比值为1),按照本文建立的定量检测方法进行检测,测得的Ct 值差值的平均值为-0.91,通过上述标准曲线进行计算,所得两者含量比值的对数值为-0.023 23。因此,结果显示样本中黄牛与绵羊的含量比值为0.95,与理论值相差0.05,偏差为5%,基本能反映样本中两种皮纤维的含量比。
3 结语
(1)以市场上常见的黄牛皮纤维、绵羊皮纤维为研究对象,采用多次称样的方法对DNA 进行富集提取,该方法能有效提高皮纤维的DNA 浓度。(2)在双重检测体系下,比较了不同退火温度的扩增效果,当退火温度设置为58 ℃时,黄牛和绵羊源性成分均能有效扩增,且没有非特异性扩增现象,该方法的引物、探针特异性较好,且方法的检出限为10-3ng/μL。实验建立的双重荧光PCR 检测方法能有效地对混合样本中的黄牛、绵羊源性成分进行检测。(3)利用黄牛、绵羊两种源性成分Ct值的差与两者含量比值的对数值存在线性关系,建立了黄牛、绵羊皮纤维双重荧光定量PCR 的检测方法。方法建立的定量检测标准曲线的线性相关性能达到0.99 以上。通过定量标准曲线的研究,建立了混合样本中黄牛与绵羊成分比例的检测方法,为皮纤维样本中成分的定量分析提供方法参考。
