老年高血压发病机制研究进展
2024-01-16陈珂于俊民李大鹤陈洪叶张小波赵园园
陈珂,于俊民,李大鹤,陈洪叶,张小波,赵园园
作者单位:150001黑龙江省哈尔滨市,哈尔滨医科大学附属第四医院老年病科
随着人口老龄化进程加速,高血压的发病率逐年升高。流行病学资料显示,60岁及以上老年群体中高血压患病人数超过一半,高血压作为老年人常见的心血管系统疾病,可严重影响老年人的生活质量,加重社会负担[1]。老年高血压发病机制复杂,除受遗传因素、交感神经及肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)活性、胰岛素抵抗等因素影响外,其与机体衰老导致的一系列病理生理改变也密切相关[2]。年龄增长使机体自我调节能力下降,导致脉管系统发生血管内皮功能障碍、管壁增厚、顺应性降低和大动脉僵硬等结构和功能改变及β受体反应性降低、外周血管阻力增高、内分泌紊乱和自主神经功能失调,进而导致老年高血压中单纯收缩期高血压和脉压增大多见[2-3]。老年高血压患者因血管僵硬度增加、动脉壁压力感受器迟钝、血压调节功能减退,血压波动增大且易发生体位性血压变化[2]。衰老促进机体分泌多种炎症细胞因子,进而导致免疫系统慢性炎症及肠道微生态系统发生变化,而脑-肠轴组分改变及非编码基因调控异常等均影响高血压的发生发展[4-6]。因此,探讨老年高血压发病机制对于改善患者预后及制定高血压防治策略有重要意义。本文综述了老年高血压相关免疫机制、非编码基因调控机制、脑-肠轴调控机制。
1 老年高血压相关免疫机制
年龄增长导致机体免疫系统发生变化(胸腺萎缩,造血功能衰退,B淋巴细胞、树突细胞功能下降,幼稚T淋巴细胞减少,晚期高分化记忆T淋巴细胞增多,血管老化、炎症与损伤),进而导致动脉粥样硬化形成[2-3]。血压增高时血管壁内、中膜免疫细胞浸润、活化,促使细胞因子、补体释放增加,机体免疫调节功能失衡,进一步引发机体脏器持续性炎症反应,加重血管内皮功能损伤,导致血管重塑、血管舒缩功能异常,促进高血压的发生[7]。上述因素相互作用形成级联效应,维持高血压并促进靶器官损伤。
1.1 补体介导血管内皮功能障碍
高血压的主要病理生理改变为血管内皮功能障碍。补体由体细胞和免疫细胞产生的多种可溶性细胞因子组成,其与内皮细胞和血管平滑肌细胞(vascular smooth muscle cell,VSMC)中特异性受体结合后可直接调节血管功能,且补体可通过其介导的免疫细胞浸润、活化和血管炎症而诱导血管内皮功能障碍[8]。有学者观察到,大鼠应用补体调节蛋白C1抑制剂后细胞间黏附因子1表达降低,进而阻止了内皮细胞损伤[8]。SUMIDA等[9]研究证实,血压升高使小鼠主动脉外膜巨噬细胞分泌补体C1q,诱导VSMC增殖,导致动脉血管重塑。RUAN等[10]在脱氧皮质酮醋酸酯盐诱导的高血压小鼠模型中发现,补体C5a可促进血管周围脂肪组织巨噬细胞浸润,诱导其向促炎M1表型极化,促进炎症因子表达,从而诱发血管损伤。而RUAN等[8]在血管紧张素Ⅱ诱导的高血压小鼠模型中发现,使用C5a受体拮抗剂可以抑制免疫细胞浸润及白介素(interleukin,IL)-1β、单核细胞趋化蛋白1和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的生成,从而减轻血管内皮功能障碍。
1.2 细胞因子参与血管重塑
已有研究证实,血小板衍生生长因子(platelet-derived growth factors,PDGF)、转化生长因子β(transforming growth factor beta,TGF-β)、胰岛素样生长因子1(insulin-like growth factor 1,IGF-1)等多个细胞因子在VSMC增殖和迁移过程中起着至关重要的作用,并与高血压相关血管生成和重塑有关[11]。而VSMC增殖和迁移导致的血管重塑是高血压相关血管病变的根本原因。高血压相关血管重塑涉及细胞外基质(extracellular matrix,ECM)的合成和降解、血管内皮功能障碍及VSMC增殖和迁移等过程,受细胞因子、血管活性物质和细胞间血流动力学调控[12]。ECM是由胶原蛋白、纤维连接蛋白等组成的大分子,是维持血管壁结构和功能的关键物质,其合成和降解与基质金属蛋白酶(matrix metalloproteinases,MMPs)密切相关[13]。研究发现,IL-1β通过激活MMP-2及其介导的炎症信号传导而促进VSMC的迁移和细胞外间质重塑,驱动血管炎症反应,导致血管内皮损伤,参与高血压的发展[14]。目前越来越多的证据支持,MMPs可加重衰老引起的血管重塑,从而导致动脉粥样硬化和高血压[15]。血管内皮功能障碍主要表现为血管内皮炎症反应、氧化应激及屏障功能受损等,多伴有血管收缩和舒张功能紊乱[16]。有研究证实,TNF-α、IL-1β等细胞因子通过增加血管内皮活性氧生成、下调一氧化氮合成酶并上调环氧化酶2的表达,使血管内皮氧化应激加重、一氧化氮合成与释放减少、收缩型血管活性物质增加,导致血管收缩加强,从而进一步促进高血压的发生[17]。
1.3 免疫炎症反应与高血压
高血压是一种慢性低度炎症性疾病,随着年龄增长,血管内膜增厚、血管钙化和机体促炎状态发生改变,一系列衰老相关促炎因子升高,从而引发炎症持续存在[15]。年龄增长及免疫炎症反应在高血压发病中的作用见图1。高血压初期,机体组织中炎症细胞(如巨噬细胞、淋巴细胞)浸润,IL-1β、干扰素γ等炎症因子分泌增多,使机体处于慢性低度炎症状态,从而激活RAAS,增加中枢神经信号传导,引起血压升高,导致组织损伤和损伤相关模式分子(damageassociated molecular patterns,DAMPs)释放。DAMPs进一步激活树突细胞及巨噬细胞中Toll样受体(Toll-like receptor,TLR)和NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体,从而引发炎症反应[18]。研究表明,TLR能促进机体炎症反应,诱导血管损伤和高血压形成[19]。TLR4通过抑制抗氧化酶活性、激活烟酰胺腺嘌呤二核苷酸磷酸氧化酶,上调促炎细胞因子,使机体处于高炎症状态,促进血管内炎症的发生、血管内皮功能障碍、VSMC增殖,造成血管损伤,加重高血压[19]。研究显示,TLR4拮抗剂可降低小鼠血浆中去甲肾上腺素水平和血压,减弱氧化应激和炎症反应[20]。
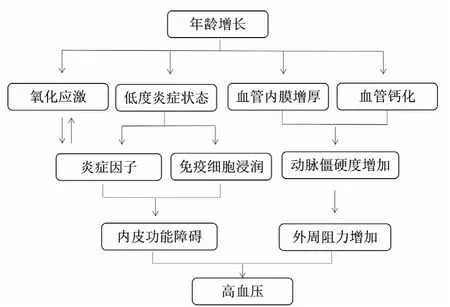
图1 年龄增长及免疫炎症反应在高血压发病中的作用Figure 1 Role of aging and immune inflammatory response in the onset of hypertension
2 老年高血压相关非编码基因调控机制
机体RAAS激活、氧化应激和血管重塑是高血压形成过程中的主要病理生理改变,一系列细胞分子及信号通路参与这一过程,同时高血压的发生还受到基因的调控。而衰老促进由DNA甲基化、组蛋白修饰和非编码基因表达介导的表观遗传变化[21]。非编码基因是一类不编码蛋白质的RNA,近年来研究表明,非编码基因通过诱导特定mRNA的降解或干扰蛋白质翻译过程来参与特定基因的表达,其中微小RNA(micro RNA,miRNA)和长链非编码RNA(long non-coding RNA,lncRNA)与高血压形成与发展密切相关[22]。
2.1 miRNA
miRNA是一类不编码蛋白质的单链RNA,长度通常为22个核苷酸[22]。目前miRNA与衰老相关的生理过程和疾病的研究最为广泛。研究发现,miR-34a与年龄相关,其表达上调会诱导内皮细胞和VSMC的衰老及衰老相关分泌表型的产生,是血管衰老及动脉和全身炎症反应的关键启动因子,最终促进年龄相关血管疾病的发展[23]。NOREN HOOTEN等[24]研究发现,老年人循环中miR-151A-5P、miR-181A-5P和miR-1248等表达明显减少并与年龄相关疾病密切相关。有研究报道,miR-483-3p、miR-143/145、miR-181a、miR-21、miR-126、miR-212和miR-451等表达上调可能导致RAAS失衡,进而使血压升高[25],其中miR-143/145可调节VSMC中血管紧张素转换酶表达,且缺乏血管紧张素转换酶会导致血管反应性受损和低血压[26];miR-181a可以抑制肾交感神经活动并减少肾素分泌,进而降低血压[27]。某些miRNA可通过影响介导氧化还原信号酶的表达而调节机体超氧阴离子、H2O2、一氧化氮等活性氧的生成,从而增强机体的氧化应激[28],而活性氧生成与抗氧化机制失衡是高血压发病的关键。近年研究发现,miRNA在VSMC表型转换和高血压血管重塑中具有重要作用,其通过影响细胞增殖、迁移和凋亡等过程而调节血管重塑[29]。已有研究证实,miR-15b/16、miR-132等可抑制VSMC表型的调节作用,而miR-221、miR-26a等miRNA过表达可刺激VSMC增殖和去分化,导致血管壁增厚、血管重塑[30]。
2.2 lncRNA
年龄增长相关的心血管系统变化与多种机制有关,已有研究证实多个lncRNA可参与高血压的病理生理过程[31]。衰老使lncRNA-Meg3、lncRNA-p21表达改变,并通过调控p53促进血管老化[32]。随着年龄增长lncRNA-H19表达下降,并诱导内皮细胞发生炎症反应,加剧血管内皮衰老,削弱内皮细胞功能[33]。GAS5、AK098656与VSMC和血管内皮功能及高血压形成密切相关。GAS5主要在内皮细胞和VSMC中表达,WANG等[34]研究发现,GAS5通过β-catenin信号调节内皮细胞、VSMC表型转换和动脉重塑,而敲除GAS5会导致收缩压、舒张压和平均动脉压升高。VSMC是动脉壁的主要组成部分,可维持血管稳态和功能。作为人类血管平滑肌的特异性lncRNA,AK098656过表达可促进VSMC迁移和增殖、升高ECM蛋白水平,AK098656直接与MYH11/FN1蛋白结合并促进其降解,增加VSMC合成表型,最终诱导阻力动脉重塑,导致高血压[35]。lncRNA在老年高血压发病机制中的作用见图2。
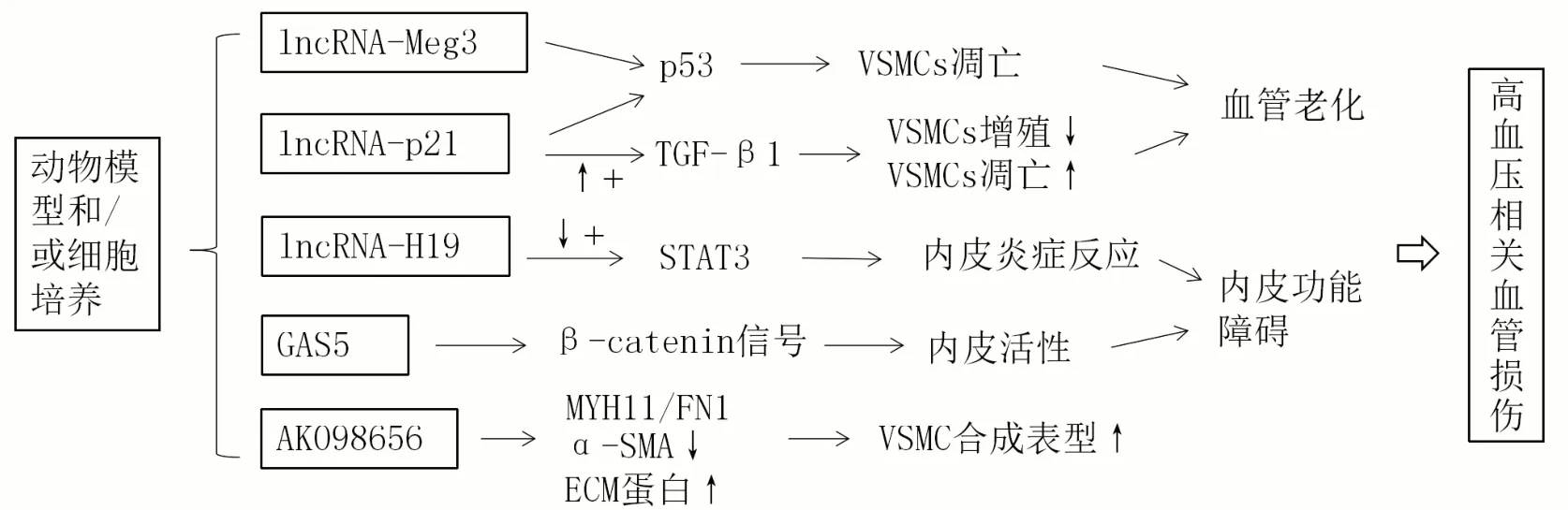
图2 lncRNA在老年高血压发病机制中的作用Figure 2 Role of lncRNAs in the pathogenesis of hypertension in elderly patients
3 老年高血压相关脑-肠轴调控机制
脑-肠轴广义上包括神经内分泌途径、神经免疫途径及肠道微生物群,是中枢神经系统与肠道之间的双向交流网络。高血压前期交感神经活性增强导致肠道通透性降低,诱导肠道菌群失调,促使致病性细菌代谢产物释放,导致机体循环系统抗炎和促炎递质失衡,直接或间接激活小胶质细胞并诱发神经炎症反应[36]。与神经炎症反应相关的细胞因子和活性氧使自主神经系统活性增强,从而使血压持续升高。衰老伴随着肠神经系统的退化,使肠动力、黏膜屏障发生改变,同时肠道防御能力降低、肠道微生物群发生变化[37]。高血压相关的脑-肠轴变化通常与年龄增长相关的肠道生态失调和免疫衰老相叠加,造成机体损伤和持续炎症状态的恶性循环[6]。老年高血压的脑-肠轴变化见图3。
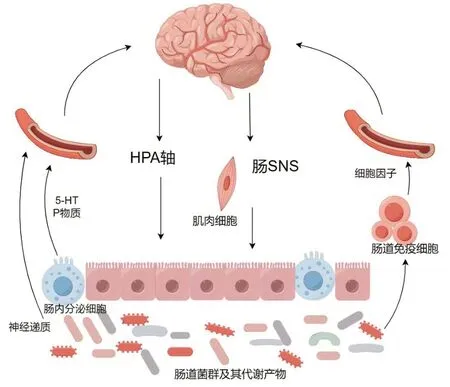
图3 老年高血压的脑-肠轴变化Figure 3 Brain-gut axis change in elderly hypertension
3.1 神经内分泌途径调节血压
下丘脑-垂体-肾上腺轴是神经内分泌系统的主要途径之一。高血压前期,交感神经兴奋,肾上腺素、去甲肾上腺素及多巴胺等儿茶酚胺物质含量及活性增加,对血压起到调节作用[38]。血压增高可持续刺激下丘脑-垂体-肾上腺轴,导致皮质醇、糖皮质激素释放增多,进一步抑制血管舒张。此外,肠道交感神经系统活性增强可引发肠道上皮功能障碍,导致肠道微生态失调,同时激活肠内分泌细胞上的肾上腺素能受体,5-羟色胺等胃肠激素释放增加。局部5-羟色胺与肠道迷走传入神经的5-羟色胺3受体结合后可调节迷走神经-肠-脑轴,而释放到血液循环中的5-羟色胺可调节脉管系统,引起血管收缩[39]。
3.2 神经免疫途径调节血压
去甲肾上腺素可刺激免疫细胞并调节其增殖、分化、成熟,肾上腺素能神经可诱导白细胞向组织募集。随着年龄增长,机体免疫系统幼稚T淋巴细胞减少,IL-1β、IL-6、TNF-α等炎症因子增加,同时大脑神经胶质细胞被持续激活,并参与维持慢性神经炎症状态[40]。免疫浸润和神经炎症是免疫系统和交感神经系统之间相互作用的结果。高血压状态下,交感神经过度兴奋可使骨髓产生髓样祖细胞,而髓样祖细胞可迁移至脑,最终分化成小胶质细胞并诱导和维持神经炎症,进而促使血压升高,形成恶性循环[41]。近年研究已证明,小胶质细胞在神经炎症和血压调节中起重要作用,药理学抑制小胶质细胞或活化的小胶质细胞耗竭均可减轻神经炎症并延缓高血压进展[42]。TGF-β被发现可通过抑制小胶质细胞的活化而调节血压,中枢TGF-β的耗竭可诱导神经炎症和高血压,补充TGF-β可抑制小胶质细胞活化并预防AngⅡ诱导的高血压[42]。神经炎症是驱动交感神经作用和加剧血压升高的关键因素,由炎症反应产生的细胞因子、补体和活性氧可进一步激发中枢及外周器官的交感神经过度兴奋,使血压维持在高水平。
3.3 肠道菌群及其代谢产物调节血压
3.3.1 肠道菌群
肠道菌群是机体肠道中微生物群的总称,由大约1014个细菌组成[43]。肠道菌群的平衡可维持肠道消化和吸收功能,限制病原体和有毒代谢产物入侵机体,进而减少疾病发生。老年人细菌多样性减少,表现为部分变形杆菌增加、双歧杆菌减少,导致肠道屏障功能受损,毒素积累[37]。有研究者在一组原发性高血压病患者中观察到,其肠道细菌丰富度和多样性较低[4];还有研究者在自发性高血压大鼠(spontaneous hypertension rat,SHR)和AngⅡ诱导的高血压大鼠模型中观察到,其微生物丰富度降低,乙酸、丁酸产生菌减少,厚壁菌/拟杆菌比值增加,且肠道菌群变化与SHR血压密切相关。此外,肠道菌群还可能通过参与肠道上皮屏障功能障碍、免疫状态改变及抑制维生素D产生而导致血压升高[44]。
3.3.2 肠道菌群代谢产物
近年来研究表明,肠道菌群代谢产物可能影响血压的调节[45]。KANG等[46]通过观察高血压大鼠模型发现,微生物花色苷代谢产物没食子酸可明显降低血压。有文献报道,短链脂肪酸(short-chain fatty acids,SCFA)由膳食纤维经肠道菌群发酵后产生,其通过与嗅觉受体78(olfactory receptor 78,Olfr78)和Gprotein偶联受体41(G protein couple receptor 41,Gpr41)结合而影响血压[47]。Olfr78在肾动脉分支和入球小动脉平滑肌细胞中表达,可介导肾素分泌,调节血管阻力,从而导致血压升高[48];Gpr41位于血管内皮,在SCFA刺激下可降低血压[47]。此外,SCFA通过激活G蛋白偶联受体而抑制核因子κB信号通路,发挥抗炎作用,调节免疫细胞功能[49]。最近一项Meta分析结果表明,循环中氧化三甲胺(trimetlylamine oxide,TMAO)水平与高血压患病率呈正相关[50]。TMAO是食物中的胆碱和左旋肉碱等物质经肠道菌群代谢后生成三甲胺,进而在肝脏氧化生成。TMAO水平升高可诱导氧化应激并激活NLRP3炎症小体、丝裂原活化蛋白激酶/核因子κB信号通路,促使炎症细胞因子、黏附分子及趋化因子过表达,引发血管内炎症反应;同时降低一氧化氮合酶和一氧化氮水平,损伤血管内皮功能,这些病理生理过程最终导致血管内皮功能障碍和高血压进展[51]。
4 小结与展望
随着人口老龄化社会的到来,高血压已成为目前全球危害人类健康的主要慢性非传染性疾病之一,其发病率在老年人群中逐年上升,并随年龄增长而增加,使高血压防治工作变得更加艰巨,而探索老年高血压发病机制有助于降低心脑血管事件的发生率,改善患者预后,减轻患者负担。有证据表明,免疫应答、炎症参与高血压的发病并与靶器官损伤密切相关[7],而肠道微生物群似乎是免疫应答和炎症反应的调节剂之一。肠道微生态失调、肠道屏障功能受损可影响脑-肠轴,进而通过炎症递质、肠道菌群代谢产物等促进外周循环与神经炎症及自主神经活动失衡,从而参与高血压的发生。老年高血压发病机制涉及基因调控、免疫应答、炎症与氧化应激、神经体液调节等多个环节,并受到衰老相关的血管老化、非编码基因表达的影响,最终促使血压升高及靶器官损伤。近年来针对脑-肠轴的研究逐步证实,肠道菌群及其代谢产物可通过中枢神经、免疫系统等途径参与血压调节,故调整肠道微生态可能为老年高血压的防治提供新思路。
作者贡献:陈珂进行文章的构思与设计,文献/资料收集、整理,论文撰写;于俊民进行论文修订并对文章整体负责、监督管理;陈洪叶、赵园园负责进行文章的可行性分析;李大鹤、张小波负责文章的质量控制及审校。
本文无利益冲突。
