阿霉素对心肌细胞ACADSB表达和自噬的影响
2024-01-16常早上苏凯鹏韩维娜罗斌杨雨佳王乐
常早上,苏凯鹏,韩维娜,罗斌,杨雨佳,王乐
(邵阳学院 普爱医学院,湖南 邵阳,422000)
阿霉素(doxorubicin,DOX)诱导急性或慢性心肌病,心脏主要病变为心肌间质纤维化、肌细胞空泡变性、心肌细胞凋亡、心室射血分数和收缩功能降低,但是DOX心肌病的发病分子机制尚不明确[1]。自噬是通过溶酶体降解和再利用受损细胞器和大分子的过程,细胞通过自噬清除受损或错误折叠的蛋白质、细胞器。已有研究表明小鼠增强细胞自噬缓解阿霉素诱导的心肌病[2]。短支链酰基辅酶A脱氢酶(acyl-CoA dehydrogenase short/branched chain,ACADSB),又称为酯酰-COA脱氢酶,属于酰基辅酶A脱氢酶家族的一员,参与催化脂肪酸或支链氨基酸代谢中酰基辅酶A衍生物的脱氢过程[3]。
研究人员使用转录组测序从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中筛选出ACADSB是透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)中氧化应激相关的线粒体基因[4]。研究证明,ACADSB可作为新生儿短链酰基辅酶A脱氢酶缺乏症(Short/branched chain acyl-CoA dehydrogenase deficiency, SBCADD)的临床检测指标[5]。此外,使用CRISPR/Cas9敲除ACADSB基因改变了参与脂质代谢的功能基因的表达水平,该研究结果表明ACADSB是牛乳腺上皮细胞脂质代谢的关键调节因子[6]。相关研究发现,ACADSB基因多态性可能与日本人群的原发性高血压有关[7]。DOX在体外和体内均显著诱发氧化应激[8],但是ACADSB在调控DOX心肌病的分子机制未见报道,因此本实验构建DOX诱导 H9c2细胞氧化损伤模型[8],探索DOX心肌病对ACADSB表达和自噬的影响,对发现新的有效干预心肌病的靶点具有重要的科学意义和临床应用价值。
1 材料与方法
1.1 材料
H9c2心肌细胞株购自湖北百奥斯生物科技有限公司,Prime Script RT reagent试剂盒和RT-PCR reagent试剂盒购于日本Takara公司,DOX购于美国MCE公司,cell counting kit-8(CCK8)试剂盒(C0038),BCA蛋白浓度测定试剂盒(P0012)购于上海碧云天生物技术有限公司,ACADSB抗体(13122-1-AP)购于武汉三鹰生物技术有限公司,LC3抗体(4108)购于美国CST公司,GAPDH抗体(AB0037)购于中国Abways公司。
1.2 细胞培养与诱导
从液氮中取出大鼠心肌细胞株H9c2冻存管,移至37 ℃水浴锅中,快速摇晃使其融化。H9c2细胞复苏后,调整细胞密度,均匀接种至培养皿,在37 ℃、5% CO2培养箱内培养,细胞经传代1到3次后,用于后续实验,并且冻存保种。实验分为对照组和诱导组。诱导组补充0.5 μmol/L的DOX,对照组添加等量的PBS,37 ℃、5% CO2培养箱内孵育24 h,收集细胞,用于后续实验。
1.3 CCK8检测细胞活性
根据CCK8试剂盒说明书,操作如下:96孔板中接种细胞悬液,实验组加不同浓度的DOX(0、0.5、1、2 μmol/L),对照组添加等量的PBS,空白组添加等量的PBS。37 ℃、5% CO2培养箱孵育24 h,每孔加入10 μL CCK8溶液, 孵育2 h,观察颜色变化,用酶标仪测定450 nm处的吸光度并进行统计分析。
1.4 RT-PCR分析相关基因mRNA的表达
使用TRIzol法提取细胞总RNA,反转录合成cDNA,采用RT-PCR分析ACADSB、SOD2、Catalase、Atg5、Atg7、Beclin 1和ULK1基因在H9c2细胞中的表达,见表1~4。

表1 去除基因组DNATable 1 Removing genomic DNA
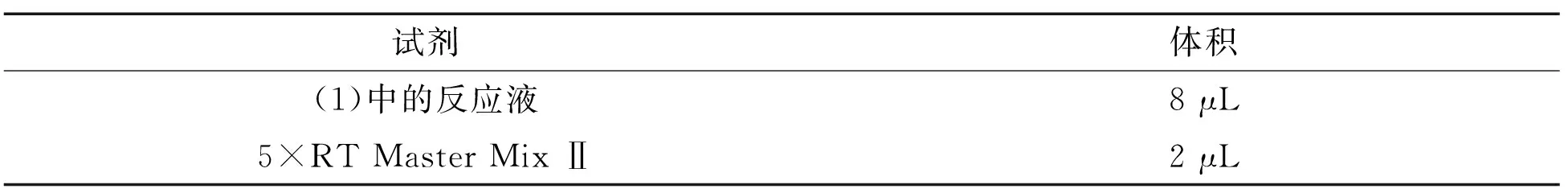
表2 反转录反应Table 2 Reverse transcription reaction

表3 RT-PCR反应体系Table 3 RT-PCR reaction system

表4 RT-PCR反应引物序列Table 4 RT-PCR reaction primer sequence
(1)去除基因组DNA
(2)逆转录反应
(3)RT-PCR反应体系
(4)RT-PCR PCR引物序列
1.5 蛋白质印迹法检测ACADSB、LC3 Ⅱ/LC3 Ⅰ蛋白的表达
使用传统方法提取细胞总蛋白质,BCA方法测定蛋白质浓度,后续蛋白质免疫印迹检测目的蛋白质。配制SDS聚丙烯酰胺浓缩胶和分离胶,蛋白质样品30 μg上样,60 V电压电泳,待溴酚蓝下移至玻璃板底部。将在甲醇中活化的PVDF膜放入转膜缓冲液中浸泡,然后按照滤纸、凝胶、PVDF膜、滤纸的顺序进行转膜,转膜后,5 %脱脂奶粉室温封闭1 h,一抗(ACADSB,LC3和内参GAPDH)稀释液,4 ℃摇床过夜,二抗室温摇床孵育1 h,TBST洗涤3次,每次5 min,化学发光仪曝光拍照。Image-Pro Plus软件进行灰度分析,目的蛋白质灰度值除以内参蛋白质灰度值,比值即为所测蛋白质的相对含量。
1.6 免疫荧光检测ACADSB蛋白的表达
DOX诱导H9c2细胞24 h后,吸弃细胞培养基,PBS洗涤3次,每次5 min,4%多聚甲醛室温固定30 min,5%山羊血清室温封闭1 h,0.5% Triton X-100溶液室温通透10 min,实验组加入1∶1 000的ACADSB抗体稀释液,阴性对照组加5%山羊血清4 ℃过夜,第2天,PBS洗涤3次,每次5 min,加入带有荧光标签1∶2 000的Cy3抗体稀释液,室温避光封闭1 h,加入1 μg/mL DAPI溶液,室温避光孵育10 min,抗荧光淬灭剂封片,荧光显微镜下拍照并保存照片,Image-Pro Plus软件进行荧光强度分析。
1.7 统计学处理

2 结果
2.1 DOX诱导H9c2心肌细胞损伤
不同浓度的DOX(0、0.5、1和2 μmol/L),诱导H9c2细胞24 h,显微镜下拍照观察。实验结果表明,对照组H9c2细胞呈梭杆形,排列整齐,大小均匀,细胞间隙紧密,胞核、胞质边缘边界清楚。但是诱导组H9c2细胞表现出圆形或椭圆形肿块,体积缩小,连接消失,核碎裂。结果表明不同浓度的DOX诱导H9c2细胞损伤,并且呈剂量依赖性(图1)。

图1 Doxorubicin(DOX)诱导H9c2细胞的形态学变化Fig.1 Morphological changes of H9c2 cells induced by DOX
2.2 DOX氧化应激抑制H9c2心肌细胞的生存率
不同浓度的DOX(0、0.5、1和2 μmol/L),诱导H9c2细胞24 h,加入CCK8溶液,2 h后检测细胞活性。CCK8实验结果表明,当DOX浓度0.5 μmol/L时,细胞生存率为80.41%,与对照组相比差异具有统计学意义,显著的抑制了H9c2细胞的生存率,并且呈明显的剂量依赖性(P<0.01,图2A)。因此,本实验选择DOX药物最适浓度为0.5 μmol/L,检测H9c2细胞中重要的氧化应激指标丙二醛MDA的含量,与对照组相比,DOX显著增加H9c2细胞中MDA的含量。以上结果表明,DOX诱导氧化应激并且抑制H9c2细胞的增殖(P<0.01,图2B)。
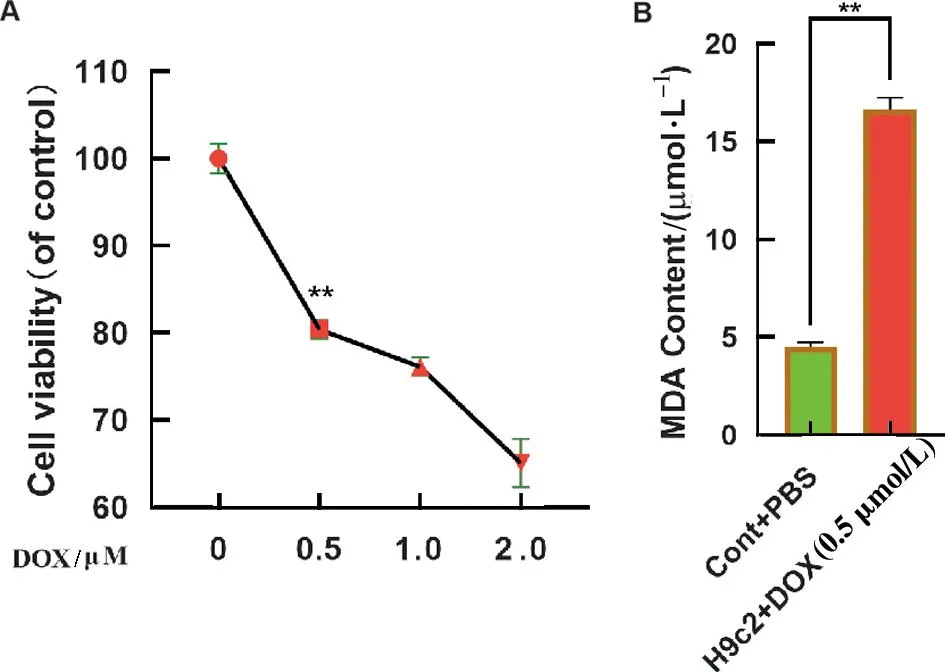
A为CCK8检测H9c2细胞的增殖;B为H9c2细胞中MDA含量的检测图2 Doxorubicin(DOX)氧化应激抑制H9c2细胞增殖*P<0.05;**P<0.01Fig.2 Inhibition of H9c2 cell proliferation by DOX oxidative stress *P<0.05;**P<0.01
2.3 DOX促进抗氧化物酶的表达
氧化应激是评估阿霉素诱导心肌损伤的重要指标,通过检测H9c2细胞中超氧化物歧化酶(SOD2)和过氧化氢酶(Catalase)mRNA的表达,评估H9c2细胞的氧化应激程度。RT-PCR实验结果表明,DOX诱导H9c2细胞氧化应激,增加SOD2和Catalase的mRNA的表达,差异具有统计学意义(P<0.05,图3)。
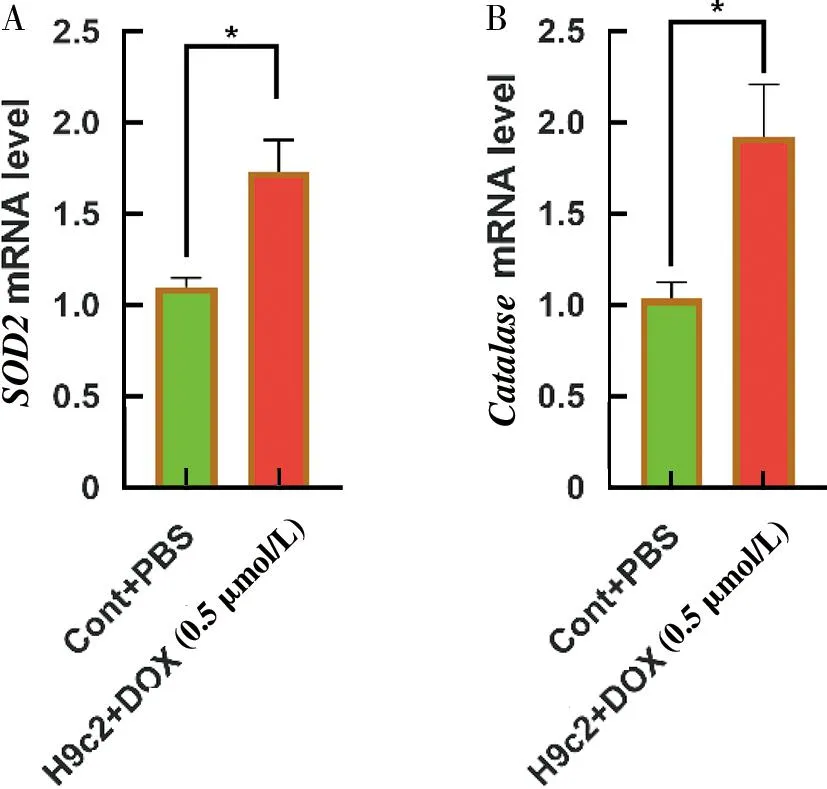
A为SOD2 mRNA的检测;B为Catalase的mRNA的检测图3 Doxorubicin(DOX)促进H9c2细胞抗氧化物酶的表达*P<0.05;**P<0.01Fig.3 The expression of antioxidant enzymes promoted by DOX in H9c2 cells *P<0.05;**P<0.01
2.4 DOX抑制ACADSB蛋白的表达
蛋白质印迹结果显示:与对照组相比,DOX诱导H9c2细胞显著抑制ACADSB蛋白的表达(P<0.01,图4A和4B)。免疫荧光检测结果显示:ACADSB蛋白主要表达在细胞质中,与蛋白质印迹结果一致,DOX显著抑制了ACADSB细胞荧光强度(P<0.01,图4C和4D)。
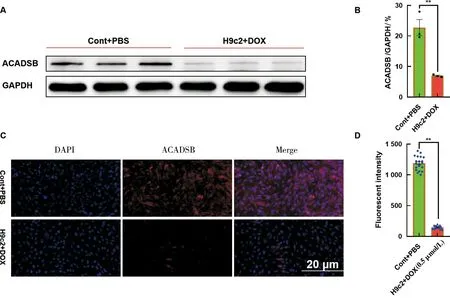
A为ACADSB蛋白的检测;B为ACADSB蛋白的定量;C为免疫荧光检测ACADSB的表达;D为ACADSB蛋白荧光强度的定量图4 Doxorubicin(DOX)抑制ACADSB蛋白的表达*P<0.05;**P<0.01Fig.4 Inhibition of the expression of ACADSB protein by DOX *P<0.05;**P<0.01
2.5 DOX抑制ACADSB mRNA的转录
本研究检测ACADSB的mRNA表达水平,结果显示:与对照组相比,DOX诱导后H9c2细胞的ACADSB mRNA显著降低(P<0.01,图5)。
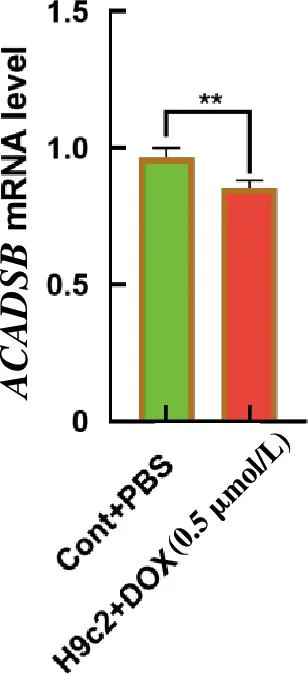
图5 Doxorubicin(DOX)抑制ACADSB的转录活性*P<0.05;**P<0.01Fig.5 Inhibition of the transcriptional activity of ACADSB by DOX *P<0.05;**P<0.01
2.6 DOX对H9c2心肌细胞自噬的影响
为了进一步研究DOX诱导H9c2细胞氧化损伤的分子机制,本研究检测自噬相关基因Atg5、Atg7、Beclin1和ULK1的mRNA的表达变化,结果显示:相对于对照组,药物组Beclin1mRNA表达显著增加(P<0.01,图6A),而Atg7mRNA表达显著降低(P<0.01,图6A),ULK1和Atg5的mRNA的表达没有差异(P>0.05,图6A)。同时,蛋白质印迹法检测自噬相关基因LC3 Ⅱ/LC3 Ⅰ蛋白的表达,结果显示:与对照组相比,DOX诱导组LC3 Ⅱ/LC3 Ⅰ蛋白表达比值升高,差异有统计学意义(P<0.05,图6B和图6C)。

A为Atg5、Atg7、Beclin1和ULK1的mRNA检测; B为LC3 I和LC3 II蛋白的检测;C为LC3II/I蛋白的定量图6 Doxorubicin(DOX)促进自噬相关基因和蛋白的表达*P<0.05;**P<0.01Fig.6 The expression of autophagy-related gene and protein promoted by DOX *P<0.05;**P<0.01
3 讨论
DOX是目前临床上使用的一种广谱抗肿瘤药物,然而,DOX的心肌毒性能诱发心肌病,甚至心力衰竭,其中的机制包括:过量的活性氧、心肌纤维化、心肌细胞凋亡、细胞自噬,以及线粒体功能紊乱[9]。研究表明,DOX心肌细胞毒性显著抑制ACADSB的转录活性和蛋白表达,同时促进自噬相关指标LC3 Ⅱ/Ⅰ和Beclin 1表达,提示ACADSB和细胞自噬介导DOX心肌病发生发展,靶向ACADSB可能为预防DOX心肌毒性提供一种新的治疗策略。
活性氧(reactive oxygen species,ROS)主要产生于线粒体电子传递链从状态III到状态IV的转变过程中,ROS 的生理作用主要是基于其调节多种信号通路的能力,包括 NF-κB、JNK和p32等[10],但过量的ROS会损伤细胞蛋白质、脂质和DNA,进一步加剧如衰老、癌症、神经退行性疾病、心血管疾病、眼科疾病等多种病理过程发展[11]。低剂量DOX氧化应激诱导H9c2细胞核扩大和扁平[12]。研究中0.5 μmol/L DOX刺激H9c2细胞24 h,细胞形态发生明显变化,表现为体积缩小,连接消失,以及少量的细胞凋亡。同时,DOX诱导后显著促进氧化应激重要指标MDA的含量,此外,DOX促进SOD2和CatalasemRNA的表达,提示DOX诱导H9c2细胞产生氧化应激损伤,H9c2细胞通过增加SOD2和Catalase的表达抵御氧自由基氧化损伤。最新研究表明,FGF1突变体通过上调抗氧化物酶SOD2和Catalase改善DOX引起的小鼠心脏氧化应激[13],这与本研究结果一致。线粒体质量控制过程,包括线粒体蛋白稳态、线粒体自噬以及线粒体动力学和生物发生,可维持心血管系统的稳态,靶向线粒体质量控制机制以保护线粒体功能的特定干预措施已成为减轻DOX心脏毒性的潜在治疗策略[14]。ACADSB属于氧化应激相关的线粒体基因并且参与到脂肪酸代谢,是催化线粒体脂肪酸β氧化的关键酶,ACADSB与高血压和患者血压变化相关[15]。此外,Meta分析表明ACADSB基因与糖尿病的发病有显著的基因表达相关性[16]。本研究发现,DOX诱导H9c2细胞氧化损伤,显著降低ACADSB的转录活性和蛋白表达水平。
自噬是维持细胞稳态所必需的,自噬参与抗衰老、神经退行性疾病、糖尿病、免疫、肿瘤,骨质疏松症和其他疾病的生理病理过程[17]。Beclin1是参与自噬体形成的Ⅲ类PI3K复合体的组成成分,介导其他自噬蛋白定位到自噬体前膜,Beclin1高表达可以促进自噬小体形成,进而激活自噬[18]。增强自噬蛋白Beclin1表达可以缓解DOX诱导小鼠心脏氧化应激以及改善小鼠心功能[19],该结论与本研究相符合。本研究发现DOX显著促进H9c2细胞Beclin1的转录活性,表明DOX诱导H9c2细胞自噬过程。LC3或MAP1LC3是通过胞浆LC3 I转化为结合自噬体的LC3 II而成为自噬体形成的重要指标[20]。既往研究证明,舒尼替尼激活心肌细胞(cardiomyocytes,CMs)自噬,显著促进小鼠心脏组织自噬相关蛋白LC3 Ⅱ/Ⅰ的表达[21]。结果显示DOX诱导后H9c2细胞LC3 Ⅱ/Ⅰ蛋白的表达比显著增加。Atg7编码参与自噬启动的限速蛋白,作为激活2种泛素样蛋白Atg8和Atg12的E1蛋白的ATP结合和催化位点[22]。心肌病可通过下调Atg7缓解,也可通过刺激自噬而加剧。敲低Atg7可减轻心肌细胞的死亡,心肌细胞中自噬体的积累显著减少[23]。本研究发现,Atg7mRNA在DOX诱导组显著减少,表明减弱Atg7自噬水平进而增强对H9c2细胞凋亡的抑制作用。自噬和凋亡都会诱导细胞死亡,自噬也会影响细胞存活。研究表明,糖尿病心肌病中的自噬水平与细胞凋亡密切相关,通过调节自噬水平可以降低心肌细胞的凋亡水平[24]。
综上所述,DOX氧化损伤抑制ACADSB的表达,增强心肌细胞自噬。进一步研究关于ACADSB如何调控细胞自噬,是否存在ACADSB蛋白和LC3蛋白直接的相互作用,以及对AMPK、mTOR、Smad和PI3K等信号通路的影响,对阐明ACADSB治疗DOX氧化损伤心肌病的分子机制有重要意义。
