磷酸化修饰介导的病原微生物致病机制研究
2024-01-15林念念甄向凯欧阳松应
林念念,甄向凯,欧阳松应,2
(1.福建师范大学生命科学学院,福建 福州 350117;2.福建师范大学南方生物医学研究中心,福建 福州 350117)
病原微生物是一类能够侵染人和动植物并引发疾病甚至死亡的微生物,又称病原体。病原微生物的侵染严重威胁到了人和动植物的健康,并对社会造成巨大经济损失。在病原菌感染过程中,宿主虽然会识别入侵的病原菌,通过促炎信号通路等先天免疫系统保护自身[1],然而,病原微生物会通过特殊的注射器样的分泌系统向宿主释放一系列效应蛋白,广泛干扰宿主免疫通路,如 NF-κB信号通路、细胞程序性死亡信号通路等,以此来躲避宿主免疫系统的识别,这一过程即免疫逃逸(Immune evasion)[2]。
近期发现许多新颖的效应蛋白介导的翻译后修饰,如谷氨酰胺 ADP-核糖基化[3]、腺苷酸化修饰和去腺苷酸化修饰[4]、ADP-核糖脱氨环化(ADPR-deacylization[5-6])、谷氨酸化修饰[7]等。最近研究发现,许多效应蛋白具有保守的丝/苏氨酸激酶(Serine/Threonine Kinase,STK)结构域,具有激酶活性,通过磷酸化宿主关键蛋白,调节宿主的先天免疫反应,进而促进增殖[8]。
磷酸化修饰(Phosphorylation)是一种常见的翻译后修饰,指在激酶的介导下,将ATPγ位的磷酸基团转移到特定氨基酸的羟基上[9],其中丝氨酸、苏氨酸、酪氨酸最常见[8]。丝/苏氨酸激酶的结构具有显著的保守性,结构域中较小的N端主要参与磷酸供体ATP分子的结合与定向,将γ磷酸基团从ATP转移到底物蛋白磷酸化受体(图1),而较大的C端负责与底物蛋白结合并启动磷酸基团的转移[10-11]。
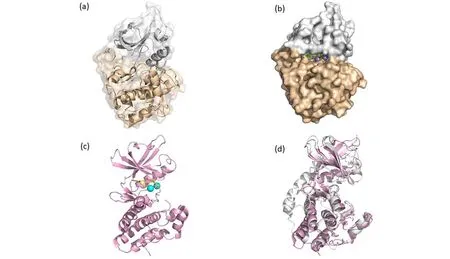
(a)小鼠蛋白激酶的晶体结构(蛋白质数据库PDB登录号为1ATP),小鼠蛋白激酶A的N端结构为白色,C端为小麦色;(b)小鼠蛋白激酶A丝氨酸/苏氨酸激酶催化结构域的N端和C端叶之间形成的催化裂隙,其中,ATP用绿色棍状表示,两个锰离子用紫色球状表示;(c)结核分枝杆菌效应蛋白PknB和抑制剂肽复合物的晶体结构(PDB登录号为1MRU),其中,ATP用黄色棍状表示,两个锰离子用青色球状表示;(d)蛋白激酶A和结核分枝杆菌PknB的三级结构的叠加,蛋白激酶A为白色,PknB为粉色。图1 丝氨酸/苏氨酸激酶催化结构域的结构[8]Fig.1 Structure of the Ser/Thr kinase catalytic domain
蛋白激酶是药物研究的重要靶标之一,设计针对蛋白激酶的抑制剂一直是人类疾病相关药物研究和药物开发方面最活跃的领域之一。激酶在真核细胞中广泛存在,在人类基因组中已经鉴定出数百种激酶和数千种激酶底物。1995年,日本批准了RHO激酶抑制物——法舒地尔用于治疗脑血管痉挛。1999年,美国FDA批准西罗莫司用于预防器官排斥反应[12],成为第一个进入美国市场的激酶抑制剂,它是雷帕霉素(mTOR)的特异性抑制剂。2001年伊马替尼获得FDA批准,被认为是激酶抑制剂开发过程中的一个关键里程碑[13]。2019年fedratinib被批准用于治疗JAK相关自身免疫疾病,JAK是辅助性T细胞(TH1、TH2和TH17)免疫反应的关键成分,因为它们是许多细胞因子的二级信使,包括干扰素和白细胞介素[14]。
最近研究发现原核生物中普遍存在丝/苏氨酸活性的蛋白激酶[15]。细菌中发现的第一个具有丝氨酸/苏氨酸激酶活性的蛋白是黄色粘球菌蛋白Pkn1,研究者发现,当Pkn1在大肠杆菌中过表达时,其丝氨酸/苏氨酸残基会进行自我磷酸化修饰[16]。随着原核生物基因组测序数据的日益庞大,在越来越多致病菌属鉴定出了具有丝/苏氨酸激酶活性的效应激酶,如肺炎克雷伯菌(Klebsiellapneumoniae)[17]、假单胞菌(Pseudomonasspp.)[18]、大肠杆菌链霉菌(Streptomycescoelicolor)[19-20]、肺炎链球菌(Streptococcuspneumoniae)[21]、肺炎支原体(Mycoplasmapneumoniae)[22]、单核增生李斯特菌(Listeriamonocytogenes)[23]、嗜热菌(Thermusthermophiles)[24]、金黄色葡萄球菌(Staphylococcusaureus)[25]和结核分枝杆菌(Mycobacteriumtuberculosis)[26]等。
介绍病原菌中有丝/苏氨酸激酶活性的效应蛋白,讨论其逃避宿主免疫系统的作用机制,这些效应蛋白可以作为病原微生物感染潜在靶标,更好地帮助推进病原菌的防治研究。
1 耶尔森氏菌YpkA通过磷酸化宿主Gɑq影响细胞骨架调控
耶尔森氏菌(Yersinia)是引起人类肠道疾病、远东星红热等疾病的致病菌,可引发严重鼠疫,包括11种菌种,其中对人体具有致病性的包括鼠疫杆菌(Yersiniapestis)、假结核杆菌(Yersiniapseudotuberculosis)和小肠结肠炎菌(Yersiniaenterocolitica),它们均通过T3SS分泌系统转运效应蛋白侵染宿主细胞[27]。YpkA是耶尔森氏菌Ⅲ型蛋白系统分泌的效应蛋白,在假结核杆菌中也称为YopO,在耶尔森氏菌发挥毒力的作用过程中不可或缺[28]。YpkA的N端与真核生物丝氨酸/苏氨酸激酶RhoA具有序列同源性和结构相似性,促进YpkA的转运和分泌,C端包含一个Rho GTP结合结构域,与宿主细胞中的GTP酶RhoA和Rac相互作用,破坏宿主的细胞骨架组织[29]。YpkA是一个特殊的具有激酶活性的效应蛋白,然而,单独YpkA并没有激酶活性,只有当YpkA的C端结合上肌动蛋白actin后,YpkA激酶活性才被活化[30]。研究表明,YpkA的激酶活性对于假结核耶尔森菌侵染小鼠并发挥毒性起到至关重要的作用[31]。具体来说,YpkA作用于宿主细胞RhoA的上游,YpkA磷酸化Gɑq上的丝氨酸残基,以阻止Gɑq-GTP的相互作用,从而抑制Gɑq的激活[32];由于G异三聚体蛋白Gɑ12/13和Gɑq是G蛋白偶联受体(GPCR)介导的肌动蛋白重排中RhoA活性的调节因子,从而对RhoA产生抑制作用,改变宿主细胞中的肌动蛋白丝结构[32]。这些研究结果表明,YpkA通过影响肌动蛋白细胞骨架重排,阻碍宿主对病原菌的吞噬作用[33]。
2 致病性大肠杆菌NIeH磷酸化核糖体S3干扰NF-κB通路并阻止细胞凋亡
NF-κB(nuclear factor-κB)信号通路在对抵抗入侵病原微生物感染过程中发挥重要功能。NF-κB信号通路的激活促使中性粒细胞向胃黏膜的募集和浸润增强,并引发显著的炎症反应;NF-κB是一类通过结合B细胞免疫球蛋白κ亲链基因的增强子序列来行使调控转录功能的细胞核转录因子,NF-κB特异结合不同功能靶基因来影响细胞信号转导[34]。目前发现很多病原微生物效应蛋白可以通过影响NF-κB信号通路而促进其感染。
致病性大肠杆菌(enterohemorrhagicEscherichiacoli(EHEC)O157:H7)的NIeH家族效应蛋白激酶NIeH1和NIeH2具有丝氨酸/苏氨酸激酶活性,NIeH1通过结合核糖体蛋白S3干扰NF-κB通路并阻止细胞凋亡。核糖体蛋白S3(ribosomal protein S3,RPS3)具有核酸内切酶活性,是NF-κB的共激活因子[35];它不仅在核糖体组装和行使功能中起着关键作用,在细胞周期、凋亡、炎症反应和病原体感染等过程中也发挥着重要作用。研究显示NIeH1与RPS3结合抑制Ikk-β依赖的Ser209磷酸化和RPS3转位到细胞核,使转录激活被抑制。NleH2刺激RPS3的磷酸化并激活NF-κB通路[36],也有研究报道,当Ikk-β过表达时,NleH1和NleH2都能抑制NF-κB通路。致病性大肠杆菌通过激活或抑制NF-κB这一重要通路[37],干扰宿主先天免疫通路,帮助实现成功侵染宿主细胞的目的。
3 沙门氏菌SteC磷酸化宿主MEK1促进SCV形成
沙门氏菌是一类常见的食源性致病菌,可侵染人体并引发一系列病症,严重时甚至导致死亡。沙门氏菌入侵宿主后形成一个含沙门氏菌的液泡(salmonella-containing vacuole,SCV),在膜包裹的小泡内复制,它的复制也与SCV周围的F-肌动蛋白网相关[38]。SCV的形成需要沙门氏菌T3SS分泌的效应蛋白,沙门氏菌中有两套编码三型分泌系统(T3SS)效应蛋白的基因,分别为沙门氏菌致病岛Ⅰ(Salmonellapathogenicity island Ⅰ,SPI-1)和沙门氏菌致病岛Ⅱ(Salmonellapathogenicity island Ⅱ,SPI-2)[39]。SteC是沙门氏菌T3SS SPI-2分泌的一个效应蛋白,与人类激酶Raf-1比较发现其序列具有保守的激酶活性结构域,包括在ATP结合中起着关键作用的核苷酸定位基序Gly-X-Gly-X-X-Gly等[39]。研究发现,SteC的激酶活性在干扰宿主的免疫防御反应过程中起到重要作用,SteC的表达可以诱导F-肌动蛋白重排[40-41],使SCV表面富集肌动蛋白[42]。研究报道,SteC能够磷酸化MEK的第200位丝氨酸,导致第218位和第222位丝氨酸的自磷酸化,从而促进MEK1的激活[41]。这表明,沙门氏菌SteC磷酸化宿主MEK1激活MEK/ERK/MLCK通路,调节肌球蛋白ⅡB介导的F-肌动蛋白重排[43],促进SCV形成,进而促进沙门氏菌的侵染与增殖。
4 黄单胞菌XopC2磷酸化宿主OSK1抑制植物气孔关闭
在植物中,病原体主要通过植物气孔入侵植物组织,而植物通过关闭气孔以抵御病原体的入侵[44]。黄丹胞菌属(Xanthomonasoryzaepv.oryzicola)T3SS效应蛋白XopC2属于丝/苏氨酸激酶,在水稻中表达XopC2使得水稻对稻瘟病黄单胞菌更敏感,表明具有激酶活性的XopC2在黄单胞菌稻瘟病的发生过程起重要作用[45]。在病原体侵染后表达XopC2的水稻植株中观察到气孔无法正常闭合,表明XopC2可以靶向气孔闭合的调控。研究证实XopC2的底物为SCF(SKP,cullin,and F-box E3 ubiquitin-protein ligase complex),而SCF复合体可以通过介导茉莉酸信号(jasmonic acid signaling,JA signaling)JAZ的降解,参与调节气孔关闭[46],SCF复合物的接头蛋白OSK1与茉莉酸酮酯受体OsCOI1b结合后,会促进低水平的JAZ泛素化和降解,激活JAZ[46]。而JAZ信号的激活会抑制气孔关闭,促进细菌的侵入和感染。XopC2增强了JAZ9的泛素化降解途径[44],并可以直接磷酸化OSK1 53位丝氨酸,增强OSK1与茉莉酸酮酯受体OsCOI1b的亲和力,特异性增强JAZ的泛素化和蛋白酶体降解,激活JAZ信号,抑制气孔关闭引起侵染植物致病[44]。同时,pull down实验显示XopC2也与OSK1相互作用,表明黄丹胞菌属效应蛋白XopC2利用稳定的相互作用来磷酸化宿主底物[44]。
5 志贺氏菌OspG结合宿主E2泛素结合酶干扰宿主免疫反应
志贺氏菌(Shigella)是一种革兰氏阴性病原菌,可破坏肠道黏膜,引起痢疾。它利用一种特殊的称为Ⅲ型分泌系统的装置,向宿主分泌20多种效应蛋白,影响宿主的胞内信号传递过程从而促进病原菌的存活与增殖[47]。OspG在志贺氏菌感染的后期发挥作用,它具有一个N端信号肽和激酶结构域。通过酵母双杂交,发现OspG可与自由的泛素或者多个E2泛素结合酶,如UbcH5b、UbcH5c、UbcH7、UbcH9 和RIG-B等相互作用[48],研究表明与泛素的结合可以增强OspG的激酶活性[43];OspG通过结合E2泛素结合酶,影响宿主胞内的泛素化修饰,使其免疫相关信号通路受阻,从而逃逸宿主的免疫系统的监视。
其中,OspG与UbcH7~Ub的亲和力最高,OspG通过C端与UbcH7~Ub复合物中Ub的第44位异亮氨酸的疏水区域结合,阻止UbcH7结合E3泛素连接酶,从而干扰UbcH7招募E3连接酶,抑制泛素化途径[49]。OspG也与Ubc5c~Ub存在相互作用,Ubc5c~Ub结合OspG触发其激酶活性,与UbcH7~Ub的结合位点不同,Ubc5c通过保守的F62与OspG的L99、P102、F154、Y80形成较强的的疏水相互作用[50]。UbcH5c-Ub复合物中的UbcH5c也与OspG的N端(残基D47,A78,F79,Y80,G81,E83)和铰链段(残基L99,R100,P102)残基相互作用[51]。通过上述相互作用结合宿主内E2泛素结合酶,抑制宿主泛素化过程,使宿主细胞信号转导网络受到干扰无法正常进行。
6 嗜肺军团菌丝/苏氨酸激酶干扰宿主翻译后修饰引发疾病
嗜肺军团菌(Legionellapneumophila,LP)是一种兼性寄生的病原细菌,可入侵变形虫或人类的巨噬细胞[52],最早发现于1976年美国费城退伍军人的会议,常存在于冷却塔、空调冷凝水等。该菌借助变形虫或巨噬细胞的胞吞过程进入细胞,之后存在于LCV(含有LP的囊泡)的吞噬体中,该囊泡不与溶酶体结合。相反,其吞噬体膜很快被改造,并被转化为在蛋白和脂质组成与内质网膜高度相似的结构,使得其不被细胞介导的免疫体系识别和清除。在这层膜的保护下,细菌大量繁殖,引发“军团菌病”非典型肺炎[53]。研究发现,军团菌的致病性取决于一套名为Dot/Icm(细胞器运行缺失/细胞内繁殖)的IV型分泌系统[54],借助于这一特殊的Dot/Icm分泌系统,军团菌向宿主细胞注入大量效应蛋白,这些效应蛋白通过干扰寄主的多个细胞过程,瘫痪其对细菌的杀灭能力,从而允许细菌在囊泡内大量增殖,导致组织损伤和炎症反应,引起疾病的发生。
军团菌是目前为止发现具有效应蛋白最多的病原菌(约330多个效应蛋白),这些效应蛋白广泛参与宿主的免疫反应,特别是翻译后修饰被证明在其致病过程中发挥重要作用。目前在军团菌中鉴定了多种效应蛋白介导的翻译后修饰,例如独立于E1-E2的泛素化修饰[55],谷氨酸化修饰[7]、Lot家族去泛素酶介导的去泛素化修饰[56-58]、腺苷酸化修饰[4]、ADP-核糖基化修饰[59]等。研究发现磷酸化修饰在军团菌感染过程中同样发挥重要作用(见图2),据报道,军团菌基因组至少编码13个激酶[60],其中有6个保守的效应蛋白序列和真核生物丝/苏氨酸家族激酶具有相似性,如LegK1-4[34,61-64]、LegK7[62,65]、Lpg2370[66]等,并且通过影响宿主不同的生命过程发挥作用。军团菌中还有一些非典型的激酶,例如Lpg2603,虽然Lpg2603一级序列与激酶没有相似性,然而其三级结构和激酶类似,并且Lpg2603的激酶活性需要磷脂六磷酸(inositol hexakisphosphate,IP6)的激活,IP6的结合导致Lpg2603活性位点的重排,允许ATP的结合及发挥催化功能[67];效应蛋白SidJ也具有一个激酶折叠[7,68-69],在碱性pH时,可以与SidE形成稳定复合物[70],将SidE mART催化中心的E860谷氨酸化修饰[71]。
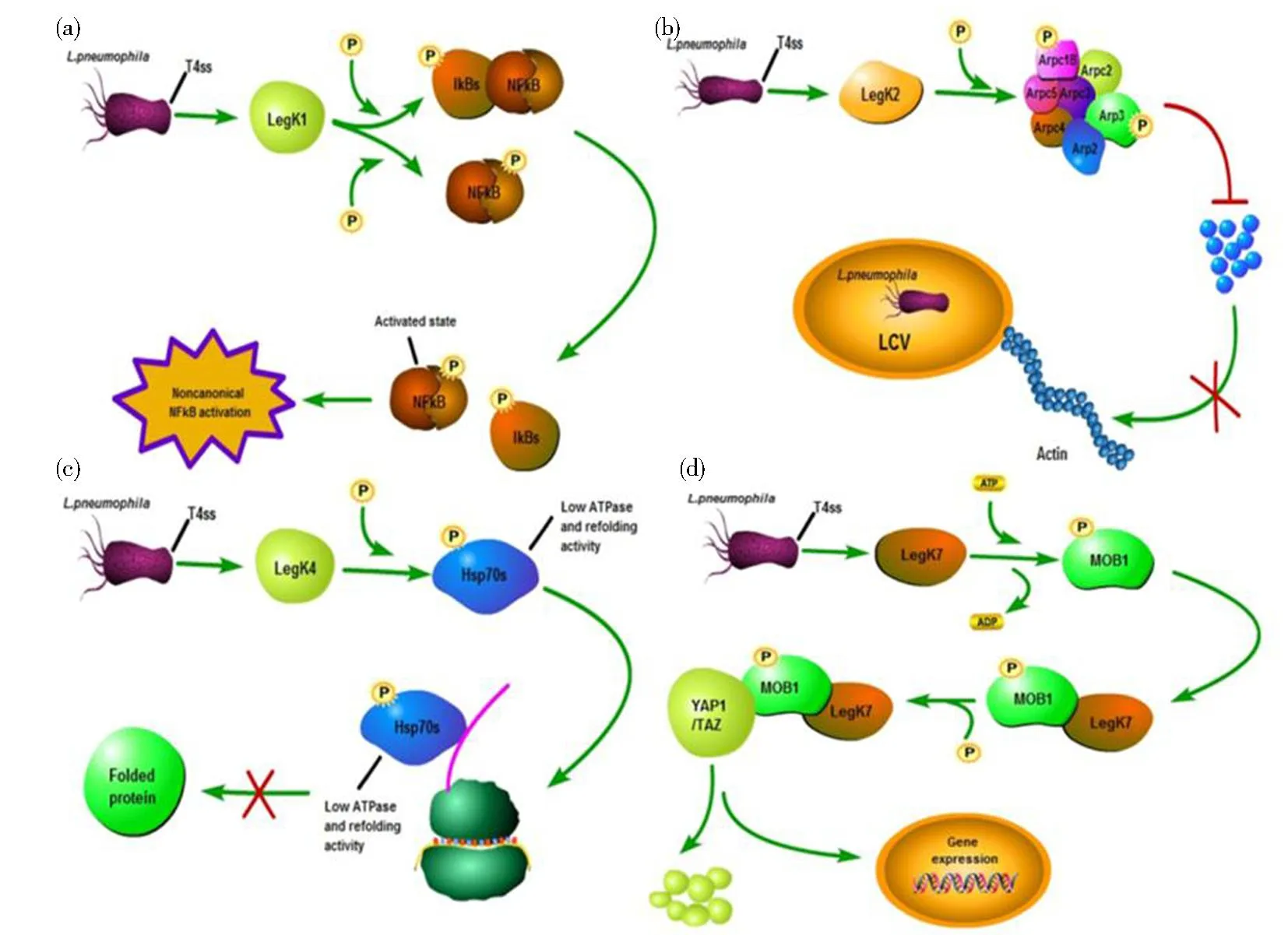
(a)军团菌效应蛋白LegK1影响NF-kB信号通路;(b)军团菌效应蛋白LegK2影响肌动蛋白骨架构建;(c)军团菌效应蛋白LegK4抑制蛋白质折叠能力;(d)军团菌效应蛋白LegK7影响巨噬细胞基因的表达。图2 军团菌中磷酸化蛋白影响信号通路Fig.2 Phosphorylated proteins in Legionella affect the signaling pathway
效应蛋白LegK1能够磷酸化IkB S32和S36激活其NF-kB信号通路,LegK2 能够靶向肌动蛋白Actin ARP2/3,引起吞噬体肌动蛋白骨架的重塑,使细菌可躲避晚期吞噬途径[63]。LegK4具有3个结构域,N端的cap 结构域,中间的激酶结构域和C端4个螺旋束组成的FHB结构域,结合ATP后导致二聚体的形成[61]。LegK4可以直接磷酸化宿主分子伴侣HSP70底物结合结构域保守的T495,LegK4对胞内HSP70的磷酸化降低其ATP酶活性进而抑制蛋白质折叠能力[72]。最近研究发现LegK7能够模拟宿主Hippo通路中的激酶MST1,将Hippo信号通路中保守的磷酸化支架蛋白MOB1的T12和T35位点磷酸化,首次将病原菌的感染与Hippo信号通路联系起来。研究发现,LegK7的磷酸化导致MOB1的激活并降解转录因子YAP1/TAZ,转录组分析发现,LegK7介导的YAP1/TAZ的降解导致巨噬细胞基因表达改变,从而促进细菌的增殖[72]。LegK7的N端具有一个激酶结构域,能够劫持宿主的Hippo信号通路促进感染[65]。LegK7的底物Mob1A结合在LegK7的激酶结构域,激活LegK7激酶活性[62,64]。效应蛋白Lpg2370[73]曾被认为是一个RING型E3泛素连接酶[74],最近研究证实Lpg2370同样属于典型的丝/苏氨酸家族激酶,有趣的是它与上游处于相同操纵子的两个基因lpg2369、lpg2368组成一个毒素-抗毒素系统(toxin antitoxin,TA),其中具有激酶活性的效应蛋白Lpg2370作为毒素,Lpg2370的表达会抑制军团菌的生长,抗毒素Lpg2369的结合阻止ATP接近Lpg2370 ATP结合口袋,从而阻止其对底物的磷酸化,然而目前尚不清楚Lpg2370在宿主内的底物[66]。
7 展望
本文总结了近几年报道的由病原体编码的具有丝氨酸/苏氨酸激酶活性的几种特殊的效应蛋白,它们在病原微生物感染过程中通过磷酸化宿主关键信号通路中的底物促进感染,这为治疗这些病原微生物感染提供了潜在的靶标。目前以抗生素进行病原微生物治疗导致的微生物耐药性问题是人类健康面临的巨大威胁,而效应蛋白在致病过程中的特异靶标则为治疗其感染提供了个性化治疗的可能,特别是真核细胞中激酶作为药物设计积累的重要经验,为以病原微生物中具有激酶活性的效应蛋白为靶标开发药物设计提供了重要参考。总之,鉴定细菌激酶新的底物以及研究激酶调控触发的生物学功能将为病原菌感染宿主的适应机制方面的研究提供更多的思路,最终这些基础研究将为新型药物的研发提供理论基础。
