荧光共价有机框架的合成及其传感、成像应用研究进展
2024-01-15刘俊杰罗志敏
刘俊杰,张 颖,罗志敏
(南京邮电大学化学与生命科学学院,江苏 南京 210023)
共价有机框架材料(covalent organic frameworks,COFs)是分子结构单元通过可逆缩合反应形成共价键连接的结晶性多孔有机聚合物[1],是由C、H、O、N、B等轻元素以共价键连接形成的有序多孔材料。COFs材料合成方法是基于动态共价化学(dynamic covalent chemistry,DCC),即通过热力学控制“成键-断键-再成键”的方式形成可逆共价键,同时进行“自我诊断和修复”的过程[2-5]。通过选择不同的分子结构单体,根据拓扑学进行结构设计,获得不同形状、尺寸和连接基团的COFs材料。COFs材料具有规整的一维通道,孔隙尺寸在纳米级。通常,刚性和π共轭的结构单元是合成COFs的首选,因其可预先确定结合方向,从而设计具有理想拓扑结构、功能性和孔径的COFs[6-7]。如图1所示,COFs的结构具有显著的多样性[8]。

图1 COF的结构多样性[8]Fig.1 Structural diversity of COF[8]
1 荧光COFs的结构
荧光COFs是将各种荧光有机分子单体通过可逆缩合反应高度有序地形成周期性排列的有机共价框架结构[9]。荧光COFs通常具有大π共轭结构,然而许多富含π电子的高光致发光分子构建COFs时却因堆叠导致易于聚集而发生荧光自猝灭[10]。二维荧光COFs中大的层间距能减少聚集诱导的荧光猝灭效应(aggregation-caused quenching,ACQ),但却给发色团的分子旋转提供了更大的空间从而增加了热衰减[11]。因此,调整二维荧光COFs的层间距、层之间的堆叠模式及发色团的分子旋转是构建强荧光性能COFs的关键[12-13]。荧光COFs的合成应尽可能减少π-π堆叠作用、限制分子内旋转、引入聚集诱导荧光发射以及其他功能设计策略以避免其荧光自猝灭。构成荧光COFs的结构单元包含富氮结构单元、硼化结构单元和全碳结构单元等。
1.1 富氮结构单元
荧光COFs的富氮结构单元通常包括三嗪[14]、咔咯[15]和联吡啶[16-17]等。基于三嗪的COFs以光催化剂而闻名,具有很好的电荷转移能力、优异的导电性和电化学耐腐蚀性,平面芳香结构的三嗪可导致其特殊的发光行为[18]。如图2所示,Li等[19]利用柔性的含π-电子缺陷的三嗪构建了荧光二维COF(DTZ-COF),通过聚集引起ACQ效应,从而导致荧光猝灭。咔咯具有18个 π电子的芳香大环,具有四吡咯的C2y对称结构的咔咯在内部核心中显示出1个空腔和3个质子,其具有丰富的配位位点,可用于结合金属离子。Zhao等[20]首次报道合成了基于咔咯单体的COF(TPAPC-COF),TPAPC-COF表现出椭圆孔和不同寻常的不对称拓扑结构,并呈现出从可见到近红外区域的光捕获能力。Cu2+与TPAPC-COF发生光诱导电荷转移从而导致荧光猝灭,而TPAPC-COF追踪其他Al3+、Ga3+和Fe3+等金属离子时则显示出荧光增强[21]。Wei 等[22]通过2,2′-联吡啶-5,5′-二胺和苯-1,3,5-三甲醛合成了荧光COFs(BPD-COFs),BPD-COFs显示了突出的荧光发射及对Ni2+的特异性结合特性,可作为高灵敏、高选择性、快速检测Ni2+的荧光传感平台。
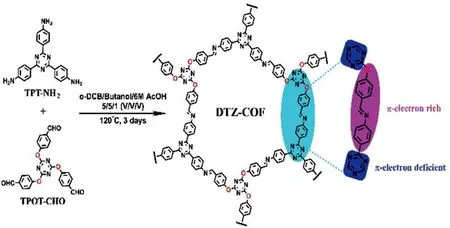
图2 DTZ-COF溶剂热合成原理图[19]Fig.2 Schematic diagram of solvothermal synthesis of DTZ-COF[19]
1.2 硼化结构单元

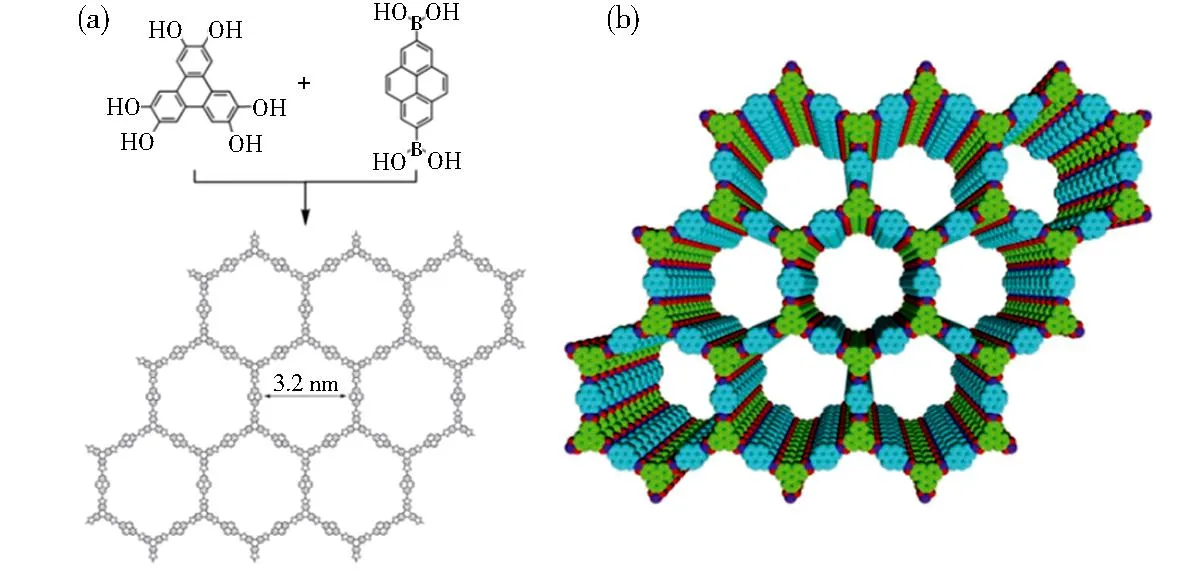
B(紫)、O(红)、三苯基(绿)、芘(蓝)。图3 TP-COF的合成(a)及结构示意图(b)[24]Fig.3 Synthesis of TP-COF (a) and schematic representation of TP-COF structure(b) [24]
1.3 全碳结构单元
四苯基芘是最常见的构成荧光COFs的全碳结构单元,作为给电子单元与各种醛或胺单体交联成几何框架,周围的4个苯基提供更大的空间位阻以减弱ACQ效应。如图4所示,Ascherl等[26]设计合成了含芘的二维COF(Py-TT-COF),Py-TT-COF的荧光发射来自光激发时的电子跃迁,Py-TT-COF和孔洞中介质之间的偶极相互作用增加导致正溶剂化变色。基于螺旋桨型π柱四苯基乙烯(TPE)合成的荧光COFs(COF-ETA-DAB和DL-COF)由于相邻苯基的空间旋转促进了辐射跃迁,被作为检测HCl蒸汽和芳香硝基炸药的化学传感器[27-28]。TPE在类石墨烯二维COFs中的柱形组装提供了独特的荧光发射和传感平台。在COF-ETA-DAB中,通过N…H相互作用,亚胺键给客体分子结合提供了对接位点,提高了电子传递,从而产生明显的荧光发射。
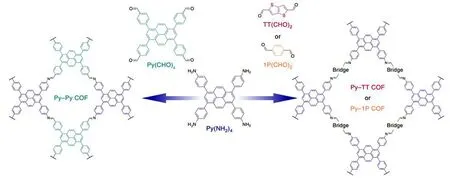
(左)四苯基芘四胺Py(NH2)4与四齿芘醛Py(CHO)4以物质的量比1∶1生成微孔Py-Py COF;(右)Py(NH2)4分别与两种线性二醛以物质的量比1∶2生成介孔Py-TT和Py-1P COFs。图4 亚胺连接的COFs的合成[26]Fig.4 Synthesis of imine-linked COFs[26]
2 荧光COFs的光学性质
溶解在溶剂中的有机分子的光学行为受其含有的官能团影响[10],而当分子单体聚合成为固态材料时,材料的宏观光学性能取决于结构中的官能团及其特定的几何排列。聚合物材料的发展已经证实,可以通过限制分子内旋转将分子单体连接成更大的尺寸从而有效地调节其光学性能。荧光COFs具有周期性排列的π共轭,π共轭是sp2杂化碳原子的未杂化p轨道与相邻sp2杂化的碳原子的非杂化p轨道侧边重叠时形成的,能够与相邻的π共轭链相互作用,将电子密度扩散到多个化学键上,从而形成离域π键。离域π键对荧光COF的HOMO-LUMO能级(带隙)的影响很大,π共轭链长度的增加导致荧光COFs的带隙减小,因此促使载流子沿堆叠方向传输,使其具有良好的光电性能。荧光COFs的微观结构(如分子单体的连接、取向和排列等)对其光学性能有重要影响,而设计合成荧光COFs,调控其分子单体的连接、取向和排列,使其具备优异的光学性能(图5所示)。荧光COFs含有有序共价键合的供体-受体(D-A)排列,具有可调谐的带隙,在光照下供体和受体之间容易发生光诱导电荷转移现象,其具有的刚性且长程有序的结构促进了光生载流子快速传递,从而提供更多的电荷转移通道以实现电荷载体的有效分离和快速运输。相较于传统聚合物而言,荧光COFs可以通过引入大量官能团调整框架结构和孔隙环境,从而增强光吸收和发射的能力。荧光COFs还可以和其他光活性物质复合形成理想的异质结平台,也能够将客体分子包含到荧光COFs分子主链包围的孔中,诱导其与主链相互作用。荧光COFs优异的光学特性使其在生物成像、光学治疗、生物传感等领域成为研究的热点。
3 荧光COFs的合成方法
荧光COFs的制备类似“搭建乐高积木”,将各个构建块集成到周期排列的扩展网络中。选择合适的荧光有机分子单体,调整合成的荧光COF中发色团的分子旋转及堆叠模式是构建强荧光性能COFs的关键[12-13]。目前为止,荧光COFs的合成方法包含溶剂热法、界面合成法、微波辅助合成法和机械化学合成法等。
3.1 溶剂热法
溶剂热法是制备荧光COFs最常用的方法。先将荧光COFs的前体和所需溶剂的混合物以及催化剂放在密闭的反应容器中(例如特氟龙衬里的钢制高压釜),经过超声短时间处理后,通过冷冻-泵-解冻循环脱气,在合适的温度下加热引发反应获得目标产物[30]。荧光分子单体的反应性和溶解度、晶体生长速率以及成核类型对溶剂热合成荧光COFs都极为关键[29]。如图6所示,Li 等[21]通过溶剂热法将5,10,15-三-(对氨基苯基)咔咯(H3TPAPC)和2,5-二甲氧基对苯二甲醛(DM-CHO)缩合制备了荧光COF(CorMeO-COF),CorMeO-COF能够基于荧光淬灭和荧光增强响应分别进行重金属离子Cu2+和Cr3+的检测。

图6 简单溶剂热法合成CorMeO-COF[21]Fig.6 Synthesis of CorMeO-COF with a simple solvothermal method[21]
3.2 界面合成法
溶剂热法虽然适用范围很广,但是也有不少缺点,例如:反应温度较高、反应时间较长以及难以精准调控等。在室温条件下精准调控合成荧光COFs对不稳定的荧光分子单体至关重要。如图7所示,Zhang等[31]首次提出了一种新的缓冲反应带方法合成荧光COF量子点(QDCOF)。通过使用N,N-二甲基甲酰胺、乙酸和二氯甲烷3种不同溶剂从上至下构建了三相体系,产生2个相互扩散的界面,顶层和底层同时扩散到中间层,在室温条件下制备出大量蓝绿色荧光QDCOF。

图7 QDCOF的化学结构和合成(a)及生长过程(b)[31]Fig.7 Chemical structure and synthesis of QDCOF(a) and growth process of QDCOF(b)[31]
3.3 微波辅助合成法
微波辅助合成法是通过微波加热合成荧光COFs,克服了溶剂热法反应时间较长的缺点。2009年,Campbell等[32]在微波辅助下,仅用20 min合成了COF-5,通过微波反应提取纯化得到COF的BET表面积(2 019 m2·g-1)远高于溶剂热合成的COF(1 590 m2·g-1)。自此,通过微波辅助合成荧光COFs逐渐引起了人们的兴趣。Wei等[33]发现微波辐射反应60 min比溶剂热反应60 min获得表面积更高且结晶度更好的β-酮胺COF(TpPa-1)。Zhang等[34]通过微波辐射在二甲亚砜中缩聚三聚氰胺和对苯二甲醛,通过席夫碱反应合成荧光COF(SNW-1)(如图8所示),SNW-1无论是分散在溶剂中还是固态都显示出明亮的荧光。
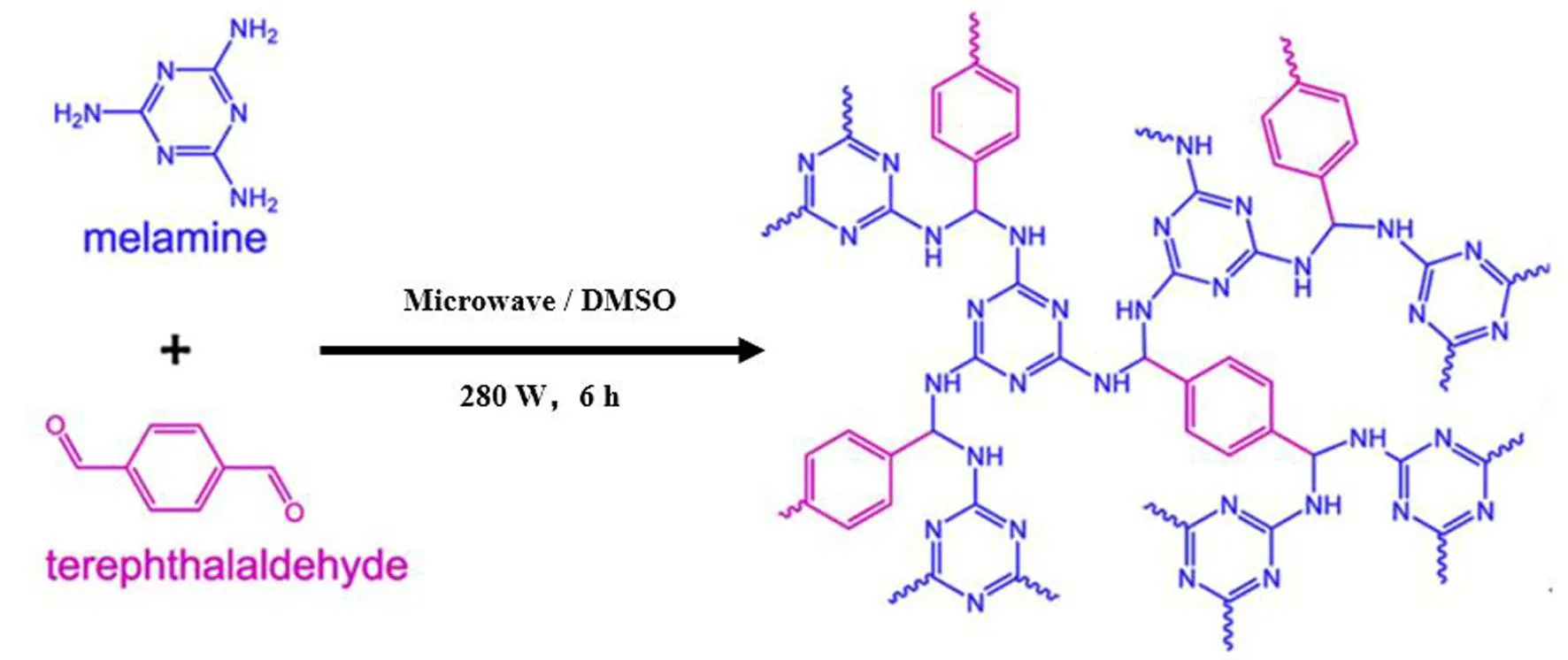
图8 对苯二甲醛和三聚氰胺通过微波辅助缩聚形成荧光COFs(SNW-1)的示意图[34]Fig.8 Polycondensation reaction of terephthalaldehyde and melamine to prepare fluorescent COFs (SNW-1) by a microwave-assisted method[34]
3.4 机械化学合成法
机械化学合成法是指分子单体在机械研磨等物理作用下发生反应直接生成COFs的合成过程。对于一些β-酮胺COFs,通过机械研磨获得与溶剂热反应相同的COFs产物。虽然结晶度和BET表面积略低,但是化学稳定性与溶剂热合成的COFs并无差异[35]。通过液体辅助研磨的方法,对结晶度和BET表面积有巨大的改善,而且催化剂液体的加入使其反应速率提高[36]。将对苯二胺与对甲苯磺酸和水一起研磨后加入三丙二醇,加热至170 ℃并持续1 min,获得高质量的酮胺COFs[37]。该方法同样适用于对甲苯磺酸、水与各种线性芳族二胺的溶液反应[38-39]。如图9所示,Liu等[40]在室温下通过手动研磨三甲酰基氯代苯二酚和马来酸酐,通过两者之间的席夫碱反应合成了荧光COF(COF-TpMA)。随着研磨的进行,产物的颜色发生乳白色、深黄色、褐色的变化,粉末的荧光也随之发生黄绿色、黄色、橙色的变化,证明产生了COF-TpMA。

图9 COF-TpMA 12次研磨时在阳光(顶部)和紫外线(底部)下的产品照片[40]Fig.9 Photos of products under sunlight (top) and UV light (bottom) of COF-TpMA at 12 grinding[40]
4 荧光COFs的传感、成像和治疗应用
4.1 荧光COFs的传感应用
荧光COFs具有可用于分子识别且可调整的框架结构、能去除和富集目标物的多孔结构和响应性发光的特性,在生物传感中展现出巨大的应用潜力[41-42]。荧光COFs最常用的检测机制是通过主客体相互作用,使目标物和荧光COFs之间发生能量或电荷转移,从而改变COFs的荧光特性。Fe3+、Cu2+和Hg2+等重金属离子可参与人体稳态平衡,失衡会导致疾病甚至人体损伤,而且某些重金属离子(Au3+等)会渗透到环境中最终积聚在人体内,进而影响人体健康[43]。因此,基于荧光COFs开发出适用于不同应用场景的金属离子荧光传感器尤为重要。
Fe3+作为最丰富的过渡金属可参与细胞水平的生物过程,人体或环境中的Fe3+测定一直是人类健康监测的重要组成部分。Fe3+的过载或缺乏都会引发细胞稳态失衡导致人体疾病,例如糖尿病、肝损伤和癌症[44-45]。Fe3+作为良好的电子(能量)受体,某些荧光COFs发射因为Fe3+最外层轨道不饱和直接猝灭。Wang等[44]制备了两种荧光COFs(PI-COF 201和PI-COF 202),并基于荧光COFs向Fe3+的能量转移构建了Fe3+的荧光传感器,结果表明,PI-COF 201和PI-COF 202实现了对Fe3+的高灵敏度检测,其检测限分别达到0.13、0.22 μmol·L-1。Li等[45]通过简单溶剂热法合成的COF-TT在添加Fe3+之后显示出明显的荧光猝灭。如图10所示,Chen等[46]制备的Bth-Dma COF由于孔洞中预先设计的O,N,O-螯合位点与Fe3+发生强配位作用,通过能量转移导致荧光猝灭,因此可作为水溶液中的Fe3+“关闭”传感器。
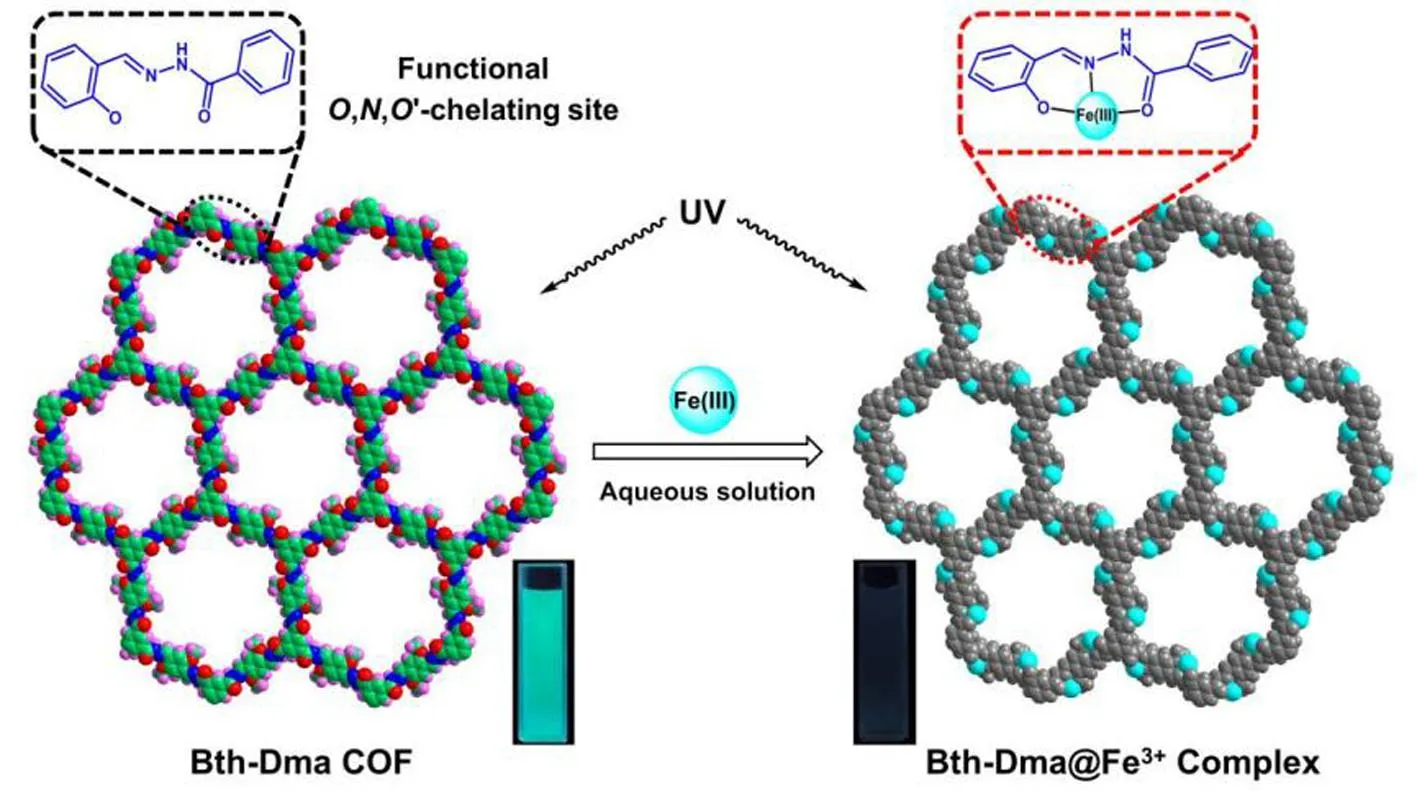
图10 Bth-Dma COF与Fe3+作用机制[46]Fig.10 Mechanism of interaction between Bth-Dma COF and Fe3+[46]
Hg2+是毒性最强的重金属之一,直接关系到人体中枢神经和免疫系统。Hg2+是一种特殊的离子荧光受体,而硫基由于特定的亲和力和供体性质一直被用作荧光COFs的传感器设计[47-49],如基于硫醚合成的COF-LZU8通过电子转移对Hg2+显示出荧光猝灭[50]。Ding 等[51]为了提高传感器的可回收性,设计合成了荧光COF(TFPPy-CHYD),实现了对Hg2+的同时吸附和检测。Bpy COF荧光随着Al3+浓度的增加而增强,Bpy COF和Al3+间的配位能消除PET导致的荧光猝灭[52-54]。
Cu2+和Fe3+一样作为最丰富的过渡金属离子之一,直接参与调节人体多种生物活动。Cai等[55]基于多聚甲醛(paraformaldehyde,PA)与三聚氰胺(melamine,MA)的胺醛反应、PA与苯酚的缩聚反应,一锅法制备了QG(Q-石墨烯)支架的荧光COF(QG-scaffolded COF)(如图11所示)。结果表明,QG-scaffolded COF荧光强度比纯COF提高1.5倍,通过QG-scaffolded COF上的胺基对Cu2+的螯合可检测血液和废水中的Cu2+。对于Au3+,TTB-COF由于硫醚官能化,硫基对Au3+具有强烈的选择亲和力。用NaS2水溶液处理时,负载Au的TTB-COF从浅黄色(Au)逐渐变为棕色(TTB-COF)[56]。
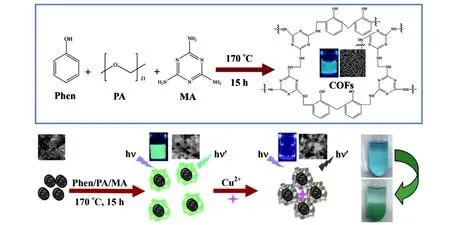
图11 QG支架COF和Cu2+相互作用机制[55]Fig.11 Interaction mechanism of QG-scaffolded COF and Cu2+[55]
除了在荧光检测金属离子方面的应用外,荧光COFs在诸如药物使用分析、内源性信号分子的检测和生物大分子检测[57-58]等方面也有着广泛应用。Wang等[59]引入Eu3+修饰合成杂化的荧光COF(Eu@TpPa-1),Eu@TpPa-1在没有左氧氟沙星时,主要显示COF的荧光发射,引入左氧氟沙星后Eu3+作为受体与左氧氟沙星的β-二酮配位,在左氧氟沙星的低浓度范围内显示出强烈的粉白色荧光,高浓度范围内则显示出强烈的黄色荧光。H2S是继NO和CO之后第三种在生命体内发挥生理作用的内源性气体信号分子,具有舒张血管、保护心脏和抗氧化等作用,在机体中发挥着重要的生物学效应。将亚胺化COF(TpASH)通过溶剂辅助超声剥离制备出TpASH NPHS的超薄纳米片,用于H2S响应性检测[60-62],实现对肝硬化小鼠模型中内源性H2S水平的监测。Mal等[63]合成了基于溴化乙锭(EB)的COF(EB-TFP),其可在水中进行剥离产生二维COF纳米片(EB-TFP-iCONs),在水性介质中,EB-TFP-iCONs在dsDNA存在下重新组装,形成在600 nm处具有增强荧光的混合EB-TFP-iCONs-DNA晶体纳米片。与ssDNA相比,重组现象对dsDNA具有高度选择性,使得EB-TFP-iCONs能够对dsDNA链进行无标记检测[63]。
4.2 荧光COFs的成像应用
生物体内复杂的环境一直是生物荧光成像探针选择性的巨大障碍,荧光COFs优异的稳定性和生物相容性、可定制化的结构等使其能够通过合理设计屏蔽无关成分的干扰,从而在生物成像方面展现出巨大的应用潜力。Das等[64]通过在微波照射下对2,6-二甲酰基吡啶(DFP)和4,4′,4″-(1,3,5-三嗪-2,4,6-三基)三苯胺(TTA)缩合生成的TTA-DFP-COF进行剥离30 min,得到超薄纳米片TTA-DFP CONs。TTA-DFP CONs通过网格蛋白介导的内吞作用进入细胞,在375 nm激发下显示出最大发射峰(435 nm),通过荧光成像对细胞核进行选择性定位。TTA-DFP CONs相比于传统有机核染料具有更好的生物相容性和光敏性。Valenzuela等[65]通过苯并噻二唑设计了基于双光子诱导细胞成像的荧光增强剂TPI-COF,可用于癌细胞和正常细胞成像。TPI-COF具有优异的双光子荧光和光稳定性,能对小鼠的4T1肿瘤模型进行高达150 μm成像深度的荧光成像且几乎没有背景噪声的干扰,可作为体内双光子共聚焦荧光成像的理想候选材料(如图12所示)。双光子荧光COFs由于能减少活体内的荧光背景,且对组织具有较深的穿透深度,相比单光子荧光COFs在活体成像方面更有优势[66-67]。与基于荧光COFs设计的生物传感类似,荧光COFs同样可通过对某些小分子特异性检测进行细胞成像。例如,荧光COF-TpMA探针具有优异的膜渗透性和生物相容性,能实现对活体中外源性羟基自由基的成功检测[34]。

(a) TPI-COF的体内肿瘤成像示意图;(b) TPI-COF的4T1肿瘤荧光成像(B1:磷酸盐缓冲液组;B2:TPI-COF组);(c) TPI-COF在不同肿瘤组织深度的双光子荧光强度;(d) TPI-COF在不同肿瘤组织深度的双光子荧光成像。图12 TPI-COF的体内肿瘤荧光成像[65]Fig.12 In vivo tumor fluorescence imaging of TPI-COF[65]
荧光COFs通过与其他功能材料的杂化和集成,用于癌症的协同治疗。Liu等[68]利用间-四(4-氨基苯基)卟啉锌(Zn-TAPP)和乙二醛以MnO2为模板制备了ZnCOF,并以牛血清白蛋白作为稳定剂原位生长Au 纳米颗粒,搭建了一种pH响应纳米平台,用于癌症诊疗。牛血清白蛋白吸附的ZnCOF由于ACQ效应,在血液循环(pH=7.4)时处于“关”状态,没有荧光信号,进入肿瘤酸性环境后,ZnCOF分散并表现出“开”状态,显示荧光信号。与此同时,ZnCOF的荧光信号在Au 纳米颗粒表面产生的局部表面等离子共振效应下得到放大,不仅实现对肿瘤的荧光成像,而且由于ZnCOF在肿瘤部位积聚,在近红外光照射下能够产生光热效应用于癌症的光热治疗。Zipfel等[69]采用预偶联单体三(4-甲酰基苯基)胺(TPA-CHO)和联苯胺通过溶剂热法合成了荧光COF(TPA-TA COF),TPA-TA COF通过氢键和π-π相互作用实现DOX的高负载,形成荧光共振能量转移系统,由于其荧光随着DOX负载量的增多由浅蓝色变为橙黄色,因此可以实现肉眼监测下直观有效的药物负载。当到达肿瘤部位后,酸性环境会破坏氢键的形成,使DOX氨基质子化,基于荧光COFs的pH响应性进行荧光成像并实现对癌症的实时诊疗。如图13所示,Yang等[70]制备了具有优异双光子吸收特性和光稳定性的COF(COF-606),对深层肿瘤组织进行荧光成像,同时在双光子激发下引发强烈的抗肿瘤免疫反应,实现对原发性和转移性肿瘤的诊疗一体化。
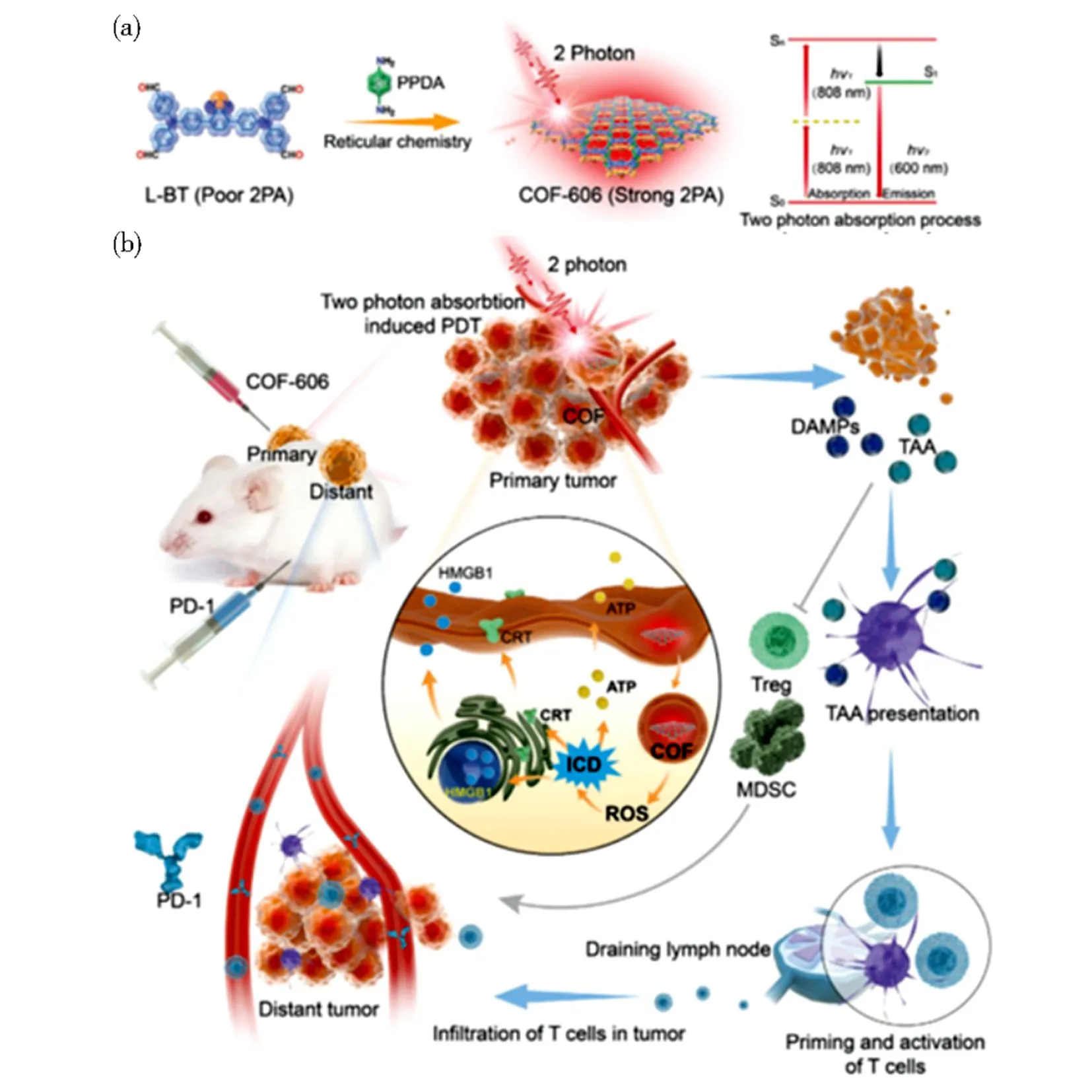
(a)具有较强双光子吸收的COF-606的构建;(b)COF-606的双光子吸收诱导光动力学治疗的生物学过程和潜在机制。 图13 COF-606的双光子吸收诱导光动力学治疗增强免疫检查点阻断治疗的示意图[70]Fig.13 Schematic illustration of two-photon absorption induces photodynamic therapy (PDT) of COF-606 to enhance immune checkpoint blockade therapy [70]
5 总结与展望
本文对荧光COFs的结构、光学特性、合成方法及其传感、成像应用研究进行了概述。荧光COFs是一种新型的共价有机框架,其将各种高度共轭且具有刚性的有机荧光团有序地集成到周期性排列的框架结构中,在一定波长激发光的照射下能够稳定地发射荧光,展现了优异的荧光特性。在分子层面进行预先设计荧光COFs,对分子单体结构和框架内的孔隙在大小、形状和功能方面进行调整,使其能够进行定制以满足特定的生物医学应用需求[71]。由于独特的光电特性,荧光COFs有望提供一个理想的诊疗平台,但其合成及应用研究仍存在许多局限性,例如合成过程中拓扑结构调控的复杂性、大规模制备的难操作性、较差的水分散性以及生理稳定性等。因此,对于新型COFs的拓扑结构的高效设计与合成,针对生物医学应用的COFs新型材料的订制合成及应用研究仍然值得期待。
