基于干燥动力学结合LF-NMR 分析的不同干燥过程中天麻切片水分变化*
2024-01-14吴钊龙巫腾钰邱展鸿黄纪民覃海波李秉正黄志民
吴钊龙,巫腾钰,邱展鸿,黄纪民,,覃海波,李秉正,4,5,黄志民
(1.广西科学院大健康研究所,广西南宁 530007;2.南宁学院食品科学与质量工程学院,广西南宁 530200;3.广西华泰药业有限公司,广西贺州 546800;4.广西科学院,广西微波先进制造技术重点实验室,广西南宁 530007;5.广西科学院来宾分院,广西来宾 546100)
天麻(GastrodiaelataBlume)为兰科(Orchidaceae)天麻属(Gastrodia)多年生草本植物,其干燥块茎是我国传统珍贵中药材,收载于中国药典,富含天麻素、多糖等活性成分,有较高的营养价值和保健功能[1,2]。现代药理学研究发现天麻具有镇静[3]、镇痛[4]、抗炎[5]、抗惊厥[6]、抗氧化[7]、抗抑郁[8]、改善记忆力[9],以及增强免疫[10]和抗凝血[11]等作用。然而,鲜天麻初始湿基含水量为70%-80%,在储存过程中易出现腐败变质等问题,进而影响天麻的药效和商品价值,因此,为了延长天麻的货架期,采挖后应尽快将其切片后进行干燥处理[6]。天麻干燥前需要进行杀青预处理,《中华人民共和国药典(一部)》(2020年版)[2]规定采用蒸制杀青,因为蒸制更利于有效成分的保留,以保持天麻品质。干燥前加热蒸制杀青至透心为宜,杀青不充分会使干燥过程中天麻切片变黑以致品质下降[8]。在现有研究和生产中,热风干燥(Hot Air Drying,HAD)是天麻切片最常用的干燥技术。此外,微波干燥(Microwave Drying,MWD)因干燥效率高、干制品品质好而逐渐受到青睐。
低场核磁共振(Low-Field Nuclear Magnetic Resonance,LF-NMR) 技术操作简单,稳定性好,且能在无损、无侵入情况下通过横向弛豫时间T2的变化实时、快速、直观地监测观察样品内部水分分布状态以帮助从微观角度分析样品水分迁移变化规律[12]。LF-NMR 技术不受样品形态、颜色、大小等影响,精确度高,适用范围更广[13],目前国内外学者已将LF-NMR 技术广泛应用于监测食品干燥、贮藏以及复水等过程水分的状态及其分布[14]。样品水分状态及含量是其干燥程度的重要信息,也是进行干燥参数调整以调控干燥过程的基础,利用LF-NMR 技术可获取不同干燥过程中任意时刻的样品内部水分变化规律,并通过建立动力学模型来实现含水量的快速检测。然而,对于天麻切片这类需经预先蒸制杀青的物料而言,迄今鲜见有关将LF-NMR 技术应用于其干燥过程中水分迁移变化规律研究的报道。
本文采用LF-NMR 技术研究不同热风温度和不同微波功率密度条件下天麻切片干燥过程中内部水分变化规律,结合干燥特性曲线建立基于LF-NMR参数的天麻切片含水率预测模型,为多种干燥技术下建立基于LF-NMR 的天麻含水率预测模型提供参考。
1 材料与方法
1.1 原料及处理
新鲜天麻,精选二级品(100-120 g/个),其初始湿基含水量75.36%,取自云南省昭通市小草坝天麻种植基地,使用前用清水清洗干净,再沥干其表面的水分,然后将其存放在4℃冰箱中。样品经广西农业技术大学莫勇生高级工程师鉴定为乌天麻(GastrodiaelataBl.f.glaucaS.Chow)。
1.2 仪器
热风干燥箱(PH-070A 型,上海一恒科学仪器有限公司),微波炉(G70F20CN1L-DG 型,佛山市顺德区格兰仕微波炉电器有限公司),核磁共振成像分析仪(NMI20型,苏州纽迈分析仪器股份有限公司)。
1.3 方法
1.3.1 原料预处理
将经过处理存放在4℃冰箱内的天麻放置在蒸笼上,加热蒸20 min至透心为宜,然后将其切成约4.0 mm 的厚片,最后分别采用热风干燥和微波干燥两种方式对其进行干燥处理。
1.3.2 干燥方法
根据预试验,确定热风干燥的温度为60、70 和80℃,干燥过程中每20 min取样进行称重以及LFNMR 测定,直至天麻切片干基含水量降到0.004 g/g以下停止干燥。
微波干燥的功率密度为2、3和4 W/g,干燥过程每2 min取样进行称重以及LF-NMR 测定,直至天麻切片干基含水量降到0.004 g/g以下停止干燥。
1.3.3 干基含水量
天麻干基含水量按式(1)计算[15]:
式中,M为天麻切片的干基含水量,g/g;mt为干燥至t时刻的天麻切片质量,g;m为天麻切片干物质的质量,g。
1.3.4 干燥速率
天麻干燥速率按式(2)计算[16]。
式中,DR为天麻切片的干燥速率,g/(g·min);Δt为干燥时间间隔,min;Mt+Δt为t+Δt时刻的天麻切片干基含水量,g/g;Mt为t时刻的天麻切片干基含水量,g/g。
1.3.5 水分比
水分比按式(3)计算[17]:
式中,MR为天麻切片的水分比;Mt为干燥至t时刻的天麻切片干基含水量,g/g;M0为天麻切片的初始干基含水量。
1.3.6T2的采集及反演
序列参数参考吴钊龙等[12]的方法。热风干燥每隔20 min、微波干燥每隔2 min取出样品称量后,置于核磁管中并放入磁体线圈中心,先用FID(Free Induction Decay)序列获得样品的中心频率,再用CPMG (Carr-Purcell-Meiboom-Gill)脉冲序列测样品中的横向弛豫时间T2,每份样品重复采集3次信号,并将结果取平均值。序列参数设置:主频SF1=18 MHz、偏移频率O1=418 100.47 k Hz、90°脉冲时间P90=10μs、180°脉冲时间P180=20μs、采样点数TD=240 008、累加次数4 次、回波时间TE=600 ms、回波次数=4 000。
1.3.7 LF-NMR 成像测定
成像参数参考吴钊龙等[13]的方法。成像参数设置:主频SF1=18 MHz、偏移频率O1=159.609 131 k Hz、采样点数TD=256、采样频率SW=20 k Hz、采样时间DW=50μs、信号采样总时间ACQ=12.8 ms、接收机死时间DT2=1.4 ms、模拟增益RG1=20 d B、数字增益DRG1=3 d B、选层方向Gslice Y=1、相位编码方向GphaseZ=1、频率编码方向Gread X=1、90°脉冲宽度P1=1 200μs、180°脉冲宽度P2=1 200μs、90°脉冲幅度RFA1=3%、180°脉冲幅度 RFA2=6%、射频脉冲形状 RFSH1 为5sinc256、重复采样次数 NS=4、累加次数RP1count=4、相位编码步数RP2count=128。
1.4 干燥模型的拟合
筛选5种最常用的动力学模型对天麻切片进行非线性拟合(表1)。
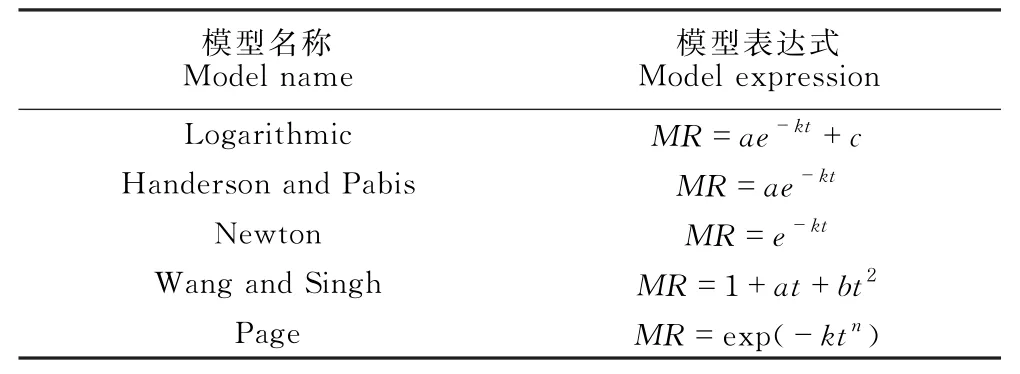
表1 5种动力学模型Table 1 Five dynamic models
1.5 数据统计
每组试验均重复3次,试验结果表示为平均值±标准偏差。采用Origin 8.0 绘制图;采用JMP Pro 16.0进行非线性拟合,选取决定系数R2、均方根误差RMSE、误差平方和SSE 作为拟合评价指标,R2越大,RMSE和SSE越小则说明模型拟合效果越好;采用SPSS 17.0进行显著性分析。
2 结果与分析
2.1 干燥特性
2.1.1 HAD
天麻切片HAD 过程的干燥曲线和干燥速率曲线见图1。由图1(a)可知,不同热风干燥温度的天麻切片干基含水量均持续降低,其中热风温度80℃的天麻切片干基含水量下降更明显,达到恒重的时间更短。主要是由于热风干燥温度越高,水分蒸发越快,从而加速干燥过程[18]。60、70、80℃下干燥时间分别为160、140和120 min。
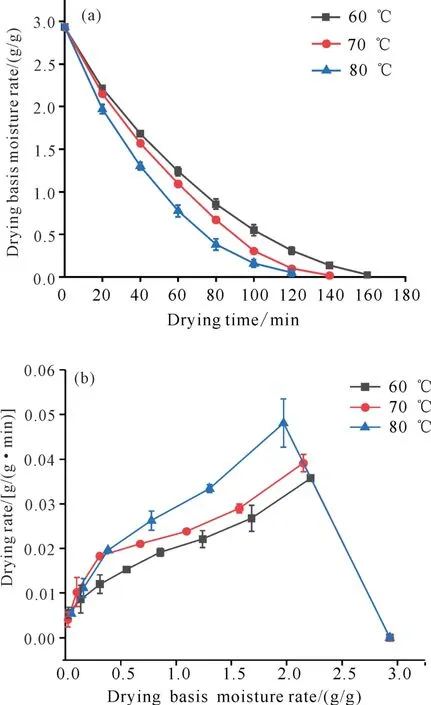
图1 不同热风干燥温度下天麻切片干燥曲线(a)及干燥速率曲线(b)Fig.1 Drying curves(a)and drying rate curves(b)of G.elata Blume slices under different hot air drying temperature
从图1(b)的3条不同温度干燥速率曲线中可以看出,整个热风干燥过程均有增速和降速两个阶段,天麻切片在整个热风干燥过程中以降速为主;初期干燥速率较快,中后期干燥速率逐渐降低。对比不同热风温度之间的干燥速率可知,在干燥初期,温度对干燥速率影响显著,随着干燥的进行,温度对其影响逐渐减小,这与柠檬、牛大力等的热风干燥过程相似[19,20]。这是因为在干燥初期,主要以物料表面水分散失为主,随着干基含水量的逐渐降低,天麻切片收缩变形,水分迁移阻力增大,干燥速率逐渐下降。
2.1.2 MWD
天麻切片MWD 过程的干燥曲线和干燥速率曲线见图2。由图2(a)可知,随着干燥时间的延长,不同微波功率密度条件下的干基含水量呈现下降的趋势;微波功率密度越大,干燥曲线越陡峭,达到恒重所需的干燥时间越短。2、3、4 W/g下干燥时间分别为34、20和14 min。
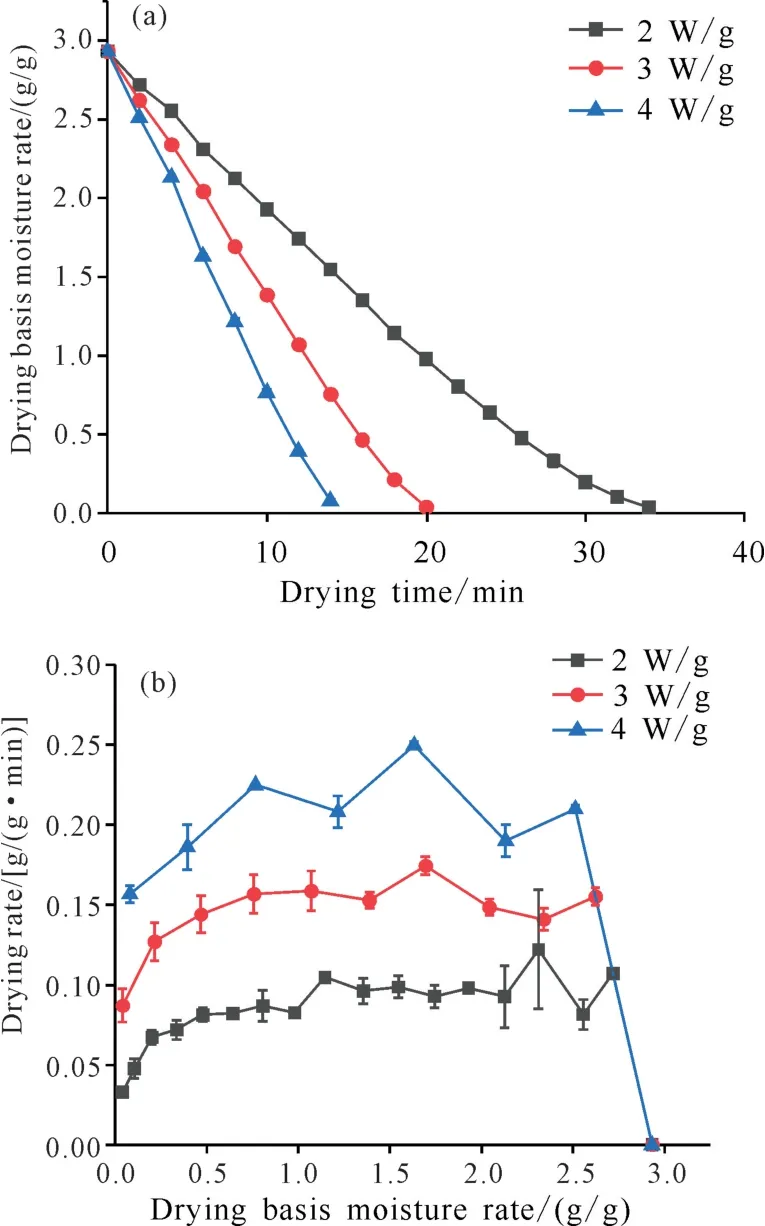
图2 不同微波功率密度下天麻切片干燥曲线(a)及干燥速率曲线(b)Fig.2 Drying curves(a)and drying rate curves(b)of G.elata Blume slices under different microwave power density
由图2(b)可知,微波功率密度为2 W/g和3 W/g时有明显的加速阶段、恒速阶段和降速3个阶段,微波功率密度为4 W/g 时只有加速和降速两个阶段。微波功率密度越大,干燥速率越快,恒速阶段越不明显,然而微波功率密度越大会导致天麻切片焦糊;但微波功率密度越小,加工效率越低[21]。从实际生产应用方面来说,选择适当的微波功率密度干燥天麻切片还需进一步考察。
2.1.3 干燥动力学模型拟合
根据不同干燥方式所得的天麻切片干燥过程中的干燥时间和水分比数值,采用JMP Pro16.0软件对5种常见的动力学模型进行非线性拟合,各模型的参数及评价指标见表2。可以看出,无论何种干燥方式,在5种干燥动力学模型中Logarithmic模型的R2最高,均在0.997 以上,其RMSE 和SSE 分别为0.008-0.019 和0.000-0.002,说明Logarithmic模型的拟合精度明显高于其他模型,因此可用Logarithmic模型来描述和预测天麻切片HAD 和MWD过程中的水分变化规律。
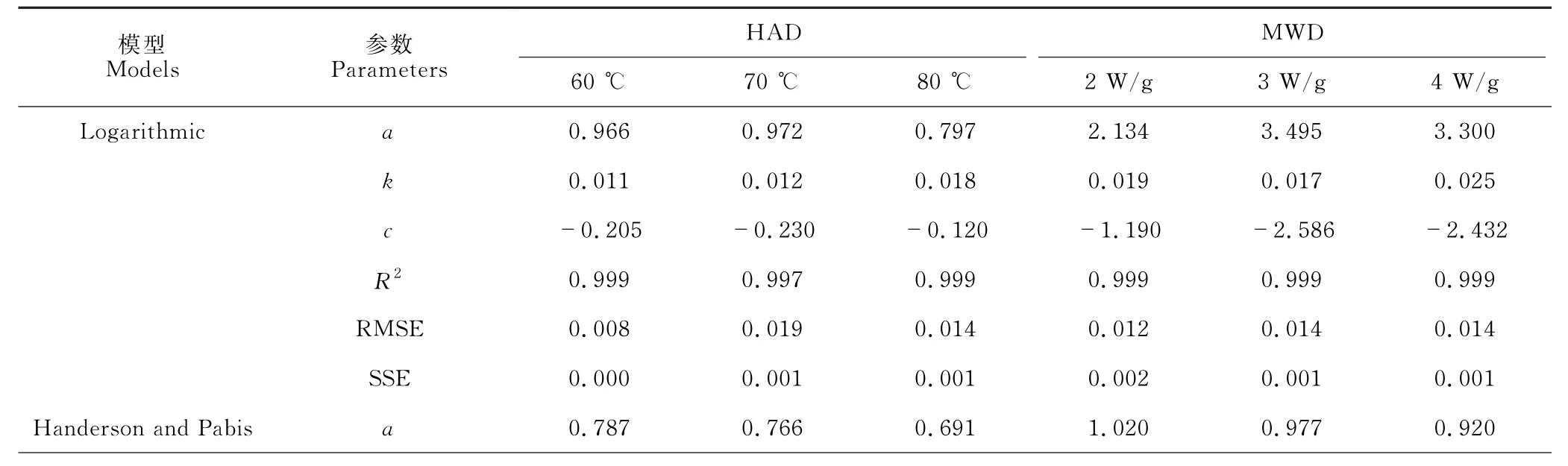
表2 天麻切片干燥模型统计分析结果Table 2 Results of statistical analysis of G.elata Blume slices drying model
2.2 干燥过程水分变化规律
2.2.1T2反演谱图及质子密度加权图像
新鲜天麻切片和蒸煮后天麻切片的横向弛豫时间(T2)曲线如图3所示。由图3可知,蒸煮前后的横向弛豫时间(T2)均有3个波峰,表明天麻切片内部均存在3种不同状态的水。其中,T21(0-10 ms)、T22(10-200 ms)、T23(200-1 700 ms)分别对应结合水、不易流动水和自由水。
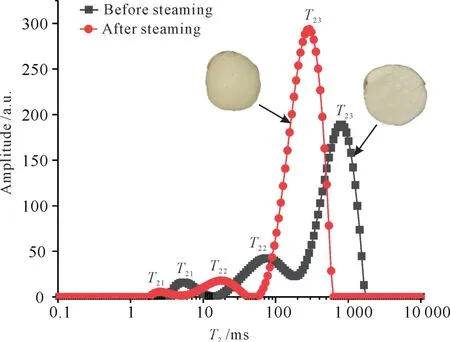
图3 新鲜天麻切片及蒸煮后天麻切片的T 2 反演谱图Fig.3 T 2 inversion spectrum of fresh and steamed G.elata Blume slices
结合水、不易流动水、自由水的弛豫峰面积分别用A21、A22、A23表示。由表3可以看出,新鲜天麻切片和蒸煮后天麻切片的横向弛豫时间(T2)曲线中的T21、T22、T23相比均发生显著性变化(P<0.05),结合水、不易流动水与自由水的自由度显著降低,峰向左移动。无论是新鲜天麻切片还是蒸煮后天麻切片,其自由水的弛豫峰面积A23最大,说明自由水含量最高,占天麻切片总水分的70%以上。蒸煮后的天麻切片A21、A22、A23与新鲜天麻切片A21、A22、A23相比有显著性差异(P<0.05),天麻切片经蒸煮后的自由水含量由3 407.63 g-1增加到5 318.65 g-1,不易流动水由960.36 g-1下降到305.04 g-1,结合水含量由176.36 g-1下降到51.27 g-1。这可能是由于蒸煮破坏了天麻切片的组织结构,内外力差使天麻切片本身的水分向外分散,所以自由水显著增加。蒸煮前后的总峰面积A2分别为4 544.34 g-1和5 674.96 g-1,表明蒸煮后的天麻切片总水分增多。

表3 蒸煮前后天麻切片中各状态水的横向弛豫时间和弛豫峰面积Table 3 Transverse time and relaxation peak area of different states of water G.elata Blume slices before and after steaming
图4为蒸煮前后天麻切片的横切面核磁共振成像(nuclear Magnetic Resonance Imaging,MRI)图,不同颜色代表不同的水分含量,结合右边的颜色条带可知,颜色越红表示天麻切片组织结构中含水量越高,颜色越蓝表示天麻切片组织结构中含水量越低[22,23]。由图4可知蒸煮前天麻切片内部水分分布不均匀,其本身的水分由内向外逐渐增加,蒸煮后会破坏天麻切片的内部结构,内部不同水组分重新排布,并加速其中的水分迁移,使内部水分趋于均匀分布。这也是蒸煮会提高天麻切片干燥速率的原因。

图4 新鲜天麻切片(a)和蒸煮后天麻切片(b)的质子密度加权图像Fig.4 Proton density weighted images of fresh(a)and steamed(b)G.elata Blume slices
2.2.2 干燥过程T2曲线变化
图5为天麻切片在HAD 和MWD 不同条件下干燥过程的低场核磁共振T2曲线的变化。由图5可知,无论是HAD 还是MWD,在各温度或微波功率密度条件下T2曲线变化趋势基本一致,整体均发生了不同程度的左移。这表明天麻切片在干燥过程中,3种状态的水分含量均有所减少,其中自由水减少最多,不易流动水次之,结合水最少,类似的结果在Cheng等[24]的研究中也有报道。主要是因为自由水的自由度高、流动性强,在干燥过程中容易先被脱去,而结合水和不易流动水这两种形态的水自由度和流动性低,极难脱除[25]。干燥结束时天麻切片内部仅含有结合水和少量不易流动水。W/g)
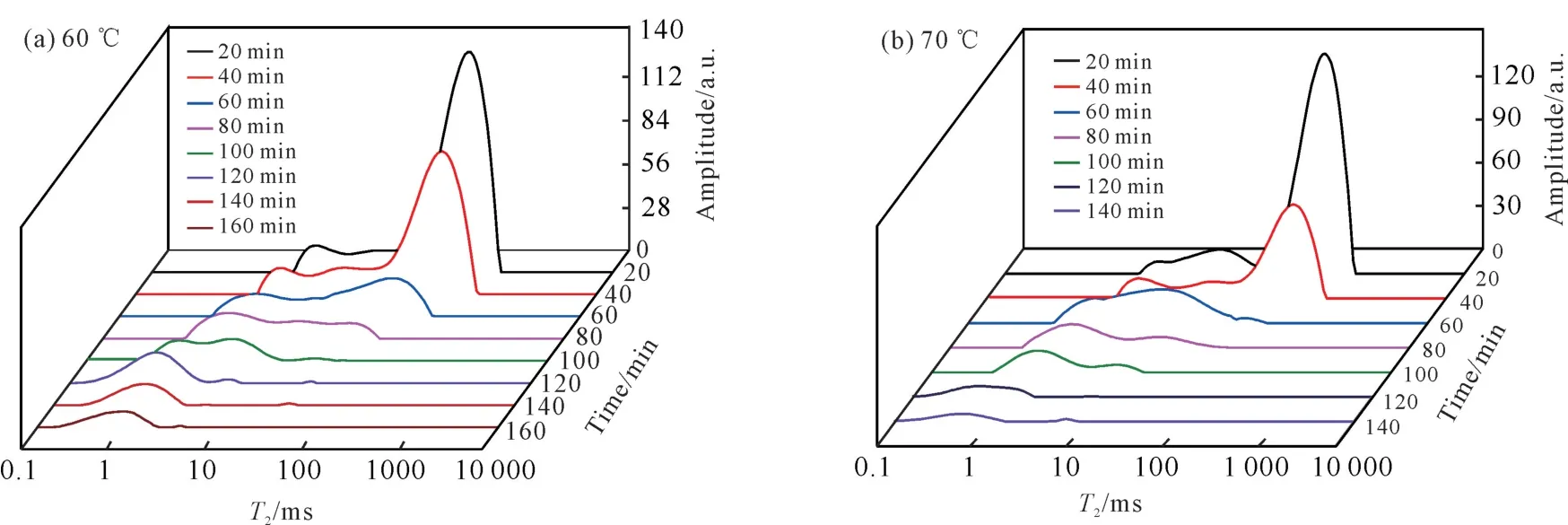
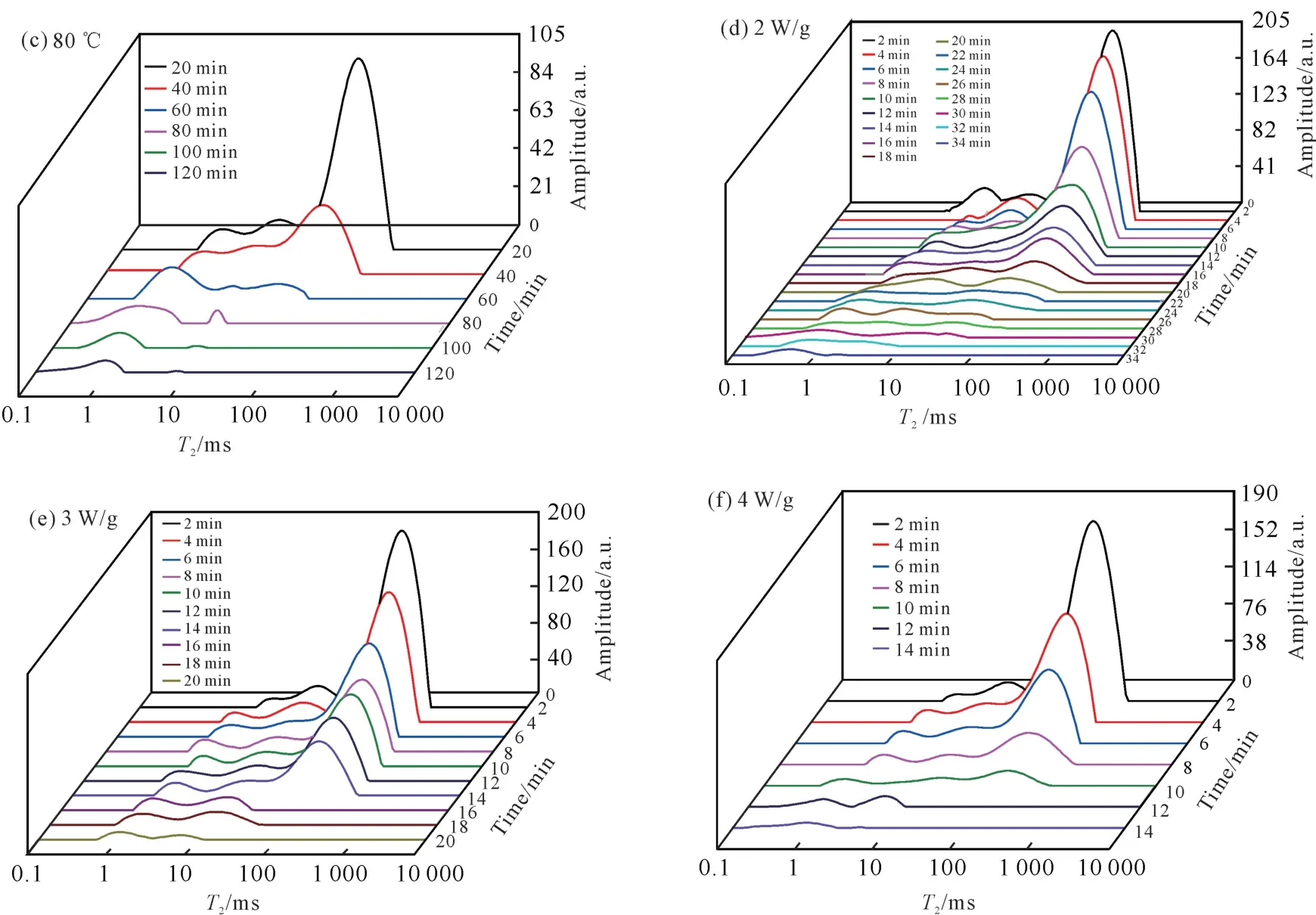
图5 HAD 过程(60、70、80℃)和MWD 过程(2、3、4 W/g)天麻切片T 2 曲线的变化Fig.5 Changes of T 2 curve of G.elata Blume slices during HAD process (60,70 and 80℃)and MWD process(2,3 and 4
2.2.3 水分状态及含量变化
由图6可知,无论是HAD 还是MWD,在不同干燥条件下,天麻切片在干燥过程中结合水T21值变化幅度均很小,原因是结合水与天麻切片内的大分子物质结合紧密,导致干燥过程中该状态水难以脱除[26]。T22和T23值在干燥过程中明显下降,说明不易流动水和自由水在干燥过程中不断地被脱除。在HAD过程中,温度越高,T22值和T23值下降越快;在MWD 过程中,微波功率密度越大,T22和T23值下降越快。

图6 HAD 过程(60、70、80℃)和MWD 过程(2、3、4 W/g)天麻切片中各状态水的横向弛豫时间变化Fig.6 Changes of relaxation time of water in G.elata Blume slices during HAD process (60,70 and 80℃)and MWD process(2,3 and 4 W/g)
由图7可知,无论是HAD 还是MWD,在各温度或微波功率密度条件下A2值均随干燥时间的延长而逐步减小,与图1和图2中天麻切片干基含水量的变化趋势一致。不同之处在于,对于HAD 而言,在60、70和80℃条件下干燥时,A23值降为0的时间分别为160、80和80 min;而对于MWD 而言,在2、3、4 W/g条件下干燥时,A23降为0的时间分别为32、16、12 min,MWD与HAD 相比具有更高的干燥速率。此外,从图7可以看出,A23值是天麻切片中占比最大的水分,是干燥时最容易脱除的水,A23值的变化规律还与总峰面积A2值变化规律相似[27]。无论HAD还是MWD过程中,不易流动水均呈波动的、无明显规律的变化趋势。同种干燥方式下干燥条件的不同使A22呈现不同的变化趋势,总体表现为在干燥结束之前有一个升高的过程,类似的结果在陈文玉等[28]的研究中也有报道。原因可能是干燥过程中天麻切片内部分自由水逐渐转化为不易流动水。A21值是天麻切片中占比最小的水分,也是干燥时最不容易脱除的水,无论是HAD 还是MWD,各条件下A21值均呈先上升后下降的趋势,在干燥终点时天麻切片中剩余总水分信号均以少量结合水和不易流动水为主。从整体上看,A21值在HAD 和MWD 过程中整体呈较轻微的波动,在干燥中期有略微的升高,之后逐渐降低直到干燥结束。推测其原因可能是干燥引起的有机物结构性质的改变使不易流动水与大分子的结合度提高,不易流动水转化为结合水[29]。
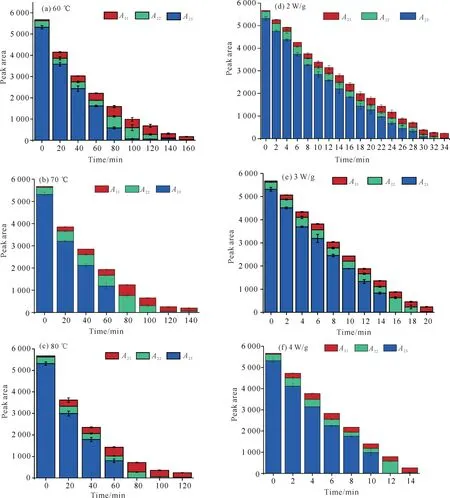
图7 HAD 过程(60、70、80℃)和MWD 过程(2、3、4 W/g)天麻切片中各状态水的弛豫峰面积变化Fig.7 Changes of relaxation peak area of water in G.elata Blume slices during HAD process (60,70 and 80℃)and MWD process(2,3 and 4 W/g)
2.2.4 天麻干基含水量和T2反演谱总峰面积A2相关性分析
为了研究天麻切片在HAD 和MWD 过程中A2与干基含水量的相关性,建立了天麻切片HAD 和MWD 过程A2与干燥过程中的实际干基含水量的关系方程(图8)。由图8可知,利用LF-NMR测定的数据与对应的天麻切片干基含水量进行相关性分析,发现无论是HAD 还是MWD,各干燥条件下天麻切片总峰面积A2和干基含水量相关性较好,R2均在0.99以上。因此,低场核磁共振可作为快速检测天麻切片HAD 和MWD 过程中含水量和水分状态及分布的有效手段。
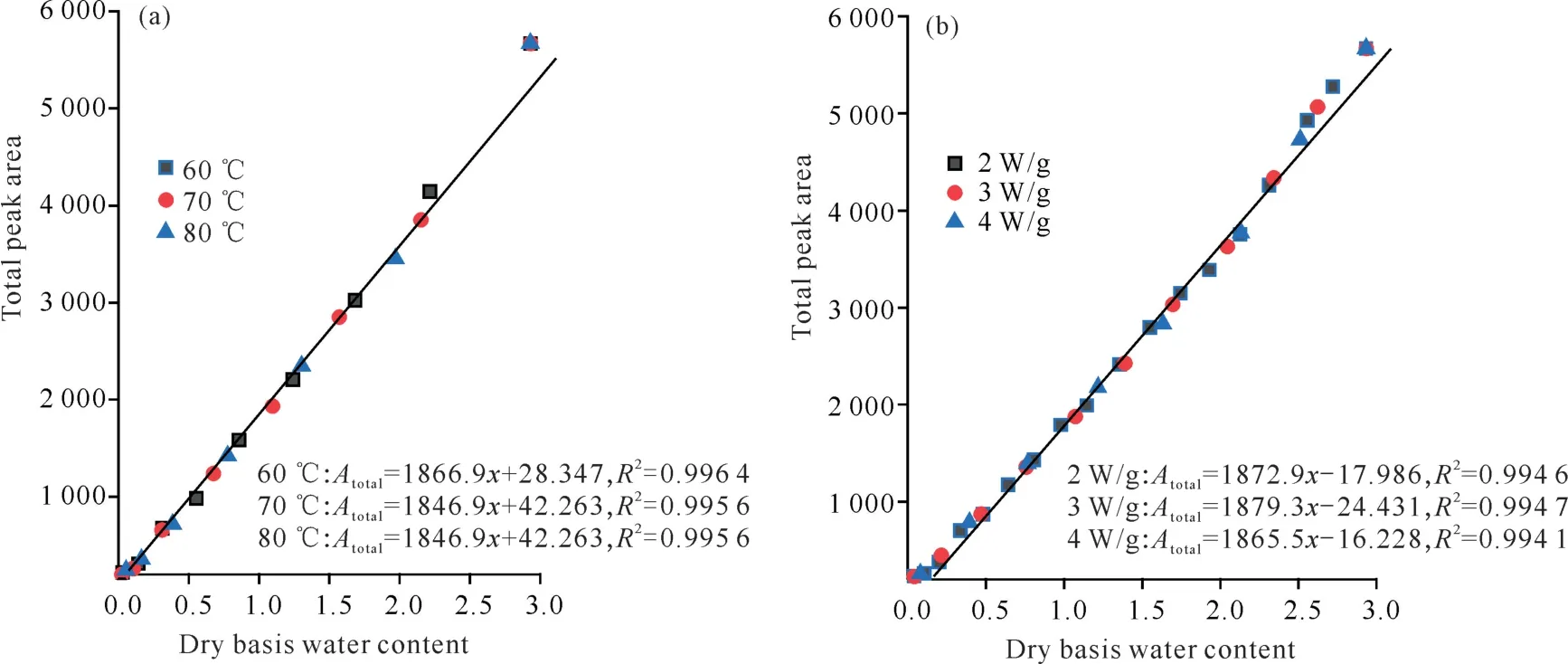
图8 HAD 过程(60、70、80℃)和MWD 过程(2、3、4 W/g)天麻切片干基含水量和总峰面积的相关性分析Fig.8 Correlation analysis between dry basis water content and total peak area of G.elata Blume slices during HAD process(60,70 and 80℃)and MWD process(2,3 and 4 W/g)
3 结论
Logarithmic模型可描述天麻切片干燥过程中干基含水量变化;在HAD 过程中,干燥温度越高越有利于加快干燥速率,缩短干燥时间;在MWD 过程中,微波功率密度越高,干燥速度越快,干燥时间越短;MWD 可以渗透到物料中,实现内部加热,与HAD 相比,干燥效率更高,干燥时间更短。
LF-NMR 分析显示,新鲜天麻切片中主要存在结合水、不易流动水和自由水3 种状态的水。在HAD 和MWD 过程中,干燥结束时天麻切片中的自由水完全被脱除,仅存少量的不易流动水和结合水。无论何种干燥方式,总峰面积A2和干基含水量相关性较好,R2均在0.99以上。
