阿法替尼脂质体冻干粉的制备与性质
2024-01-13朱效素王晓雯梁涪淮于晓锋
朱效素,王晓雯,王 玉,梁涪淮,张 蓬,于晓锋,刘 沙
(1.烟台大学药学院,分子药理和药物评价教育部重点实验室(烟台大学),新型制剂与生物技术药物研究山东省高校协同创新中心,山东 烟台 264005;2.烟台毓璜顶医院,山东 烟台 264000)
目前,肺癌的治疗手段及抗癌药物存在一定的临床问题[1]。近年来,小分子靶向制剂开启了肺癌靶向治疗的新时代[2],其中表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)对于肺癌病灶的靶向性治疗具有不可替代的作用。阿法替尼(Afatinib,AT)是第二代不可逆的EGFR-TKI,能够阻止EGFR激酶形成共价键和不可逆键,进而抑制肿瘤细胞生长,加速肿瘤细胞凋亡[3]。但目前市售AT为片剂,口服生物利用度较低,且易导致腹泻等胃肠道不良反应[4]。为提高肺癌患者的耐受性,更好地发挥药效,亟需开发一种生物利用度高、不良反应少的AT新型制剂。
脂质体是一种两亲性纳米载体,具有良好的靶向性、缓释性、细胞亲和性和生物相容性等优势,可提高药物生物利用度,降低药物的毒副作用[5]。脂质体冻干粉作为吸入剂可增加负载药物在肺内的保留和吸收,使其在局部更好地发挥作用,降低口服给药产生的胃肠道及全身性不良反应[6-7]。
基于上述背景,本研究首次制备阿法替尼脂质体冻干粉(AT-LP-FDP),优化冻干处方工艺,考察冻干制剂的理化性质和稳定性,并对制剂的肿瘤细胞杀伤作用和安全性进行初步评价,为开发抗肿瘤药物吸入剂提供重要技术支持。
1 材 料
1.1 仪器
EYELA 旋转蒸发仪N-1300D-W (瑞徽电子(上海)有限公司),集热式磁力搅拌器 DF-101s (西安太康生物科技有限公司),万分之一电子分析天平(成都市科恒达仪器设备有限责任公司),纳米粒度仪(美国PSS公司),离心机 PrimoR (美国 SORVALL 公司),双光束紫外分光光度计 UV-6100 (济南慧红医疗设备有限公司),真空冷冻干燥机(上海皓庄仪器有限公司),多功能酶标仪(Molecular Devices)。
1.2 试剂
阿法替尼双马来酸盐(AT)(上海东苍生物科技有限公司),大豆卵磷脂(上海脉铂医药科技有限公司),胆固醇(上海如吉生物科技发展有限公司),无水乙醇(南通润丰石油化工有限公司),甲醇、甘露醇(上海吉至生化科技有限公司),乳糖(上海创赛科技有限公司),蔗糖(武汉丰泰威远科技有限公司),海藻糖(南通润丰石油化工有限公司),叔丁醇(天津市富宇精细化工有限公司),A549人非小细胞肺癌细胞(上海语纯生物科技有限公司),噻唑蓝(MTT)试剂盒(碧云天生物技术有限公司)。
2 方 法
2.1 阿法替尼脂质体的制备及含量测定方法
采用硫酸铵梯度法制备阿法替尼脂质体 (Afatinib Lipsome,AT-LP)[8],具体操作如下:取适量大豆卵磷脂、胆固醇,按比例溶于适量无水乙醇,超声溶解后,将膜材置于60 ℃水浴旋转蒸发仪中除去无水乙醇,成膜后迅速加入相同温度的硫酸铵溶液,60 ℃磁力搅拌和超声各20 min,即得空白脂质体(Lipsome,LP)。将LP置于质量分数为0.9%的氯化钠溶液中透析6 h,3 h时换水一次。透析完成后,将一定浓度的AT溶液加入LP中,混合,于55 ℃孵育15 min,即得AT-LP。用纳米粒度仪测定脂质体的粒径和zeta电位。
为了确定AT溶液的最大吸收波长,取一定量的AT溶于甲醇溶液中,并取相应量的LP,加入甲醇破乳。以甲醇作为空白对照,采用紫外分光光度法进行检测。在200~700 nm范围内对AT甲醇溶液与LP甲醇稀释液进行扫描,确定AT的最佳检测波长为342 nm。配制一定浓度的AT甲醇溶液作为母液,依次稀释至系列浓度后,测定其在342 nm处的吸光度值,制作AT标准曲线。将经过葡聚糖凝胶过滤分离获得的AT-LP和未经葡聚糖凝胶过滤的AT-LP,分别用甲醇稀释后测定吸光度,代入AT标准曲线中计算浓度,得出脂质体中包封的AT的质量WAT包封和载药脂质体投药总质量WAT总,WAT-LP总为脂质体的总质量,再通过如下公式求得AT-LP的包封率(EE)和载药量(DL):
EE=WAT包封/WAT总×100%,
DL=WAT包封/WAT-LP总×100%。
2.2 AT-LP-FDP的制备及冻干工艺的考察
冷冻干燥一般分为预冻、升华干燥、解析干燥3步[9],研究表明冷冻干燥可以有效保留脂质体及内容物的稳定性。采用冷冻干燥技术制备AT-LP-FDP,以粒径、包封率、冻干样品外观和溶解性为主要评价指标,分别对冻干保护剂的种类、预冻方式、预冻温度、预冻时间及干燥时间进行单因素考察。
2.2.1 冻干保护剂的考察 固定加入冻干保护剂的总量、预冻时间、温度及干燥时间等其他条件,分别以蔗糖、甘露醇、海藻糖、乳糖、叔丁醇为冻干保护剂,设为实验组;以不加任何保护剂的AT-LP为空白对照组,考察不同单一冻干保护剂对AT-LP的保护作用。
固定加入的冻干保护剂的质量分数为10%,两种保护剂质量比为1∶1,以冻干制品的外观、溶解性、包封率等为评价指标,考察联用冻干保护剂对冻干样品的保护效果。
2.2.2 预冻方式/温度/时间的考察 预冻方式可以分为速冻和慢冻。采用速冻(液氮速冻,将样品放入液氮中迅速成冰,后放入-80 ℃冰箱中进行样品的预冻)和慢冻(将样品分别放入-20、-40、-80 ℃冰箱预冻24 h); 考察预冻温度为-20、-40、-80 ℃(固定冻干保护剂为5%甘露醇+5%乳糖,慢冻,预冻时间24 h,干燥时间12 h);预冻时间为12、24 和48 h时(固定冻干保护剂为5%甘露醇+5%乳糖,慢冻,预冻温度为-80 ℃,干燥时间12 h)AT-LP-FDP的冻干效果。
2.2.3 干燥时间的考察 干燥时间是影响样品水分含量的重要因素,样品中的水分含量会影响样品的外观和溶解度[10]。考察了总干燥时间分别为8 h、12 h、24 h时对AT-LP-FDP的影响(固定冻干保护剂为5%甘露醇+5%乳糖,慢冻,预冻温度为-80 ℃,预冻时间为24 h)。
2.3 AT-LP-FDP理化性质的考察
2.3.1 外观形态 采用扫描电子显微镜(SEM)对AT-LP-FDP表面形态进行观察。在干燥环境下,取少量样品粉末洒落在导电胶布上,吹掉多余粉末,置于离子溅射仪上喷金200 s后,用SEM观察并采集图像,电压为5 kV,放大倍数为1000~10 000倍。
2.3.2 引湿性 根据《中国药典》2020版药物引湿性试验指导原则的测定方法。取干燥的玻璃具塞称量瓶(外径为50 mm,高为15 mm),于试验前一天置于(25±1) ℃的恒温干燥器中(下部放氯化铵或硫酸铵饱和溶液),相对湿度为(80±2)%,精密称定重量(m1),取供试品适量,平铺于上述称量瓶中,供试品厚度为1 mm,精密称定重量(m2)。将称量瓶敞口,并与瓶盖同置于上述恒温恒湿条件下24 h,盖好称量瓶盖子,精密称定(m3)。计算引湿率:
引湿率=(m3-m2)/(m2-m1)×100%。
2.3.3 密度测定 分别称量一定量的阿法替尼冻干粉(AT-FDP)和AT-LP-FDP,每组3份,置于量筒中,记录其体积V1,轻轻振动,使粉末落下并观察量筒中粉体的体积变化,至体积无明显变化后,第二次记录粉末在量筒中的体积V2,分别称量加样前后量筒重,其差值即为所加入粉体的质量(m)。计算堆密度(ρb)、振实密度(ρt):ρb=m/V1,ρt=m/V2。
2.3.4 休止角 休止角代表粉末的流动性。采用固定漏斗注入法测定AT-FDP和AT-LP-FDP的休止角[11]。将漏斗对准培养皿的圆心,将样品粉末注入,直至粉体在培养皿上形成圆锥体,停止注入,测量锥体的高度(h),与锥体的半径(r),将高度(h)与半径(r)相比即得休止角的正切值(tanβ=h/r)。
2.3.5 体外释放 分别取2份含量为1.0 mg的AT-LP-FDP,以PBS为释放介质,加2 mL PBS置于透析袋内,分别放入装有40 mL PBS和40 mL含20%FBS的PBS的离心管中,置于100 r/min、温度为37 ℃的摇床中震荡。分别于0.08、0.5、1、2、4、8、12、24、48 h时各取2 mL释放介质,并补充2 mL 相应释放介质。采用紫外分光光度法测量并计算累积释放量,绘制体外释放曲线。
2.3.6 稳定性 加速实验:取样品3份在恒温恒湿箱(35±2)℃、(75±5)%中保存,于实验期间0、1、2、3月末分别取样,考察其外观、粒径、包封率、溶解性;长期实验:取样品3份在普通药柜(25±2)℃、(50±10)%中保存,于试验期间0、3、6、9、12月末分别取样考察其外观、粒径、包封率、溶解性。
2.4 体外细胞实验考察
2.4.1 空白载体细胞毒性实验 采用MTT法对空白脂质体冻干粉(LP-FDP)的安全性进行考察[12]。将A549细胞按5000个/孔的密度接种于96孔板中,每孔加入100 μL 细胞悬液,放入培养箱中培养24 h。将96孔板中的培养基吸去,每孔分别加入100 μL用完全培养基配成的质量浓度分别为500、200、100、50、20、0 μg/mL的LP-FDP复溶液,每个浓度设置3个复孔。将上述96孔板放入二氧化碳培养箱中分别培养24 h和48 h后,每孔分别加入20 μL 5.0 mg/mL的MTT溶液继续培养4 h;然后再次将96孔板中的培养基吸去,用PBS清洗3遍后,每孔加入200 μL DMSO,置于37 ℃摇床振摇10 min,用多功能酶标仪测定570 nm处各孔的吸光度(A),计算细胞存活率,公式如下:
细胞存活率=(At-Ao)/(Ac-Ao)×100%,式中,At、Ac、Ao分别代表给药孔、对照孔、调零孔的A值。
2.4.2 AT-LP-FDP细胞毒性实验 按照最优工艺制备AT-LP和AT-LP-FDP,用完全培养基分别配制浓度为0、0.625、1.25、2.5、5、10、20 μg/mL的AT-LP溶液和AT-LP-FDP复溶液。按照“2.4.1”的方法对AT-LP-FDP的毒性进行考察。
3 结 果
3.1 AT-LP标准曲线和包封率的测定
通过紫外分光光度计测定AT标准曲线:以吸光度为纵坐标,质量浓度为横坐标,绘制AT标准曲线得回归线方程:y=0.028 8x+0.023 7,R2=0.999 1,表明AT在5~25 μg/mL之间的线性关系良好。通过硫酸铵梯度法制备的AT-LP,如图1~2,粒径为(168±0.5) nm,zeta电位为(-19.44±2.1) mV,多分散系数PDI为(0.186±0.031,n=3),证明制备的AT-LP粒径较小且均一,为负电荷脂质体且稳定。根据“2.1”的葡聚糖凝胶过滤法测定的包封率为(91.43±3.2)%,载药量为(6.38±0.57)%,证明制备的AT-LP包封率和载药量较高。

图1 AT-LP粒径分布

图2 AT-LP电位分布
3.2 冻干工艺考察结果
分别以粒径、包封率、冻干样品外观和溶解性为参考指标,对冻干保护剂进行筛选。溶解性评价:+++表示30秒内溶解,++表示1分钟内溶解,+表示2分钟内溶解。
3.2.1 冻干保护剂的考察结果 由表1~3可知,通过对冻干保护剂的种类和用量等因素进行考察,结果表明以5%甘露醇+5%乳糖作为冻干保护剂时,制备的AT-LP-FDP的外观饱满,粒径较小,复溶后脂质体与冻干前相比粒径变化差别小,包封率略降低,溶解性较好。

表1 不同种类冻干保护剂对AT-LP-FDP的影响(n=3)

表2 甘露醇比例及联合冻干保护剂对AT-LP-FDP的影响(n=3)
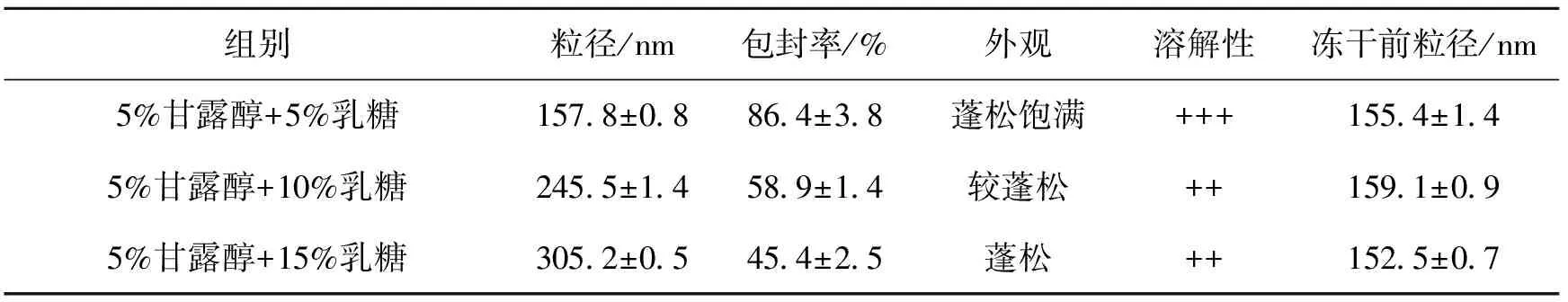
表3 联合冻干保护剂用量对AT-LP-FDP的影响(n=3)
3.2.2 预冻方式/温度/时间的筛选 由表4可知,液氮速冻法与-80 ℃冰箱慢冻法相比,采用慢冻法作为预冻制得的脂质体干粉的粒径小,包封率高,外观蓬松多孔,有颗粒感。当预冻温度为-80 ℃、预冻时间为24 h时得到的脂质体干粉的效果更好,符合生产的需要。

表4 预冻方式、温度、时间对AT-LP-FDP的影响(n=3)
3.2.3 干燥时间的考察 如表5,干燥时间为8 h时的样品,表面塌陷,24 h时脂质体包封率降低。干燥时间为12 h时,样品外观蓬松饱满,包封率较高。

表5 干燥时间对AT-LP-FDP的影响(n=3)
3.3 AT-LP-FDP的理化性质考察
3.3.1 外观形态 如图3,AT-LP-FDP表面蓬松多孔,形态不规则,变现为聚集状态,符合固体分散体的特性;制剂外观图显示,制剂整体为白色、蓬松多孔的粉末,表面平整呈颗粒感。

图3 AT-LP-FDP的SEM照片与外观图
3.3.2 引湿性 测定结果显示,在相对湿度低于70%时,引湿率低于1%,相对湿度为80%时,引湿率为(1.47±0.13)%,均低于2%,略有引湿性。
3.3.3 密度及休止角 测定结果显示,AT-LP-FDP的休止角比AT-FDP小,堆密度和振实密度比AT-FDP大,表明制备的粉末流动性较好(表6)。

表6 AT-LP-FDP的密度及休止角(n=3)
3.3.4 体外释放 实验结果如图4,AT-LP-FDP在PBS和含20%FBS的PBS中的体外释放曲线在6 h内无明显差别,无突释现象,在48 h时最大累积释放量达到60%左右。

图4 AT-LP-FDP的体外释放曲线
3.3.5 稳定性 加速实验中温度为(35±2)℃、相对湿度为(75±5)%条件下放置3个月(表7),制剂外观、粒径和溶解性并无明显变化,放置3个月时包封率降低了30%。

表7 AT-LP-FDP加速实验结果(n=3)
长期实验中在(25±2)℃、相对温度为(50±10)%条件下,0~3个月时制剂的外观形态、粒径、包封率等无明显变化(表8),6~12个月时制剂开始出现塌陷,粒径增大,包封率和溶解性降低。

表8 AT-LP-FDP长期实验结果(n=3)
3.4 体外细胞实验
3.4.1 空白载体的细胞毒性 如图5,不同质量浓度的LP-FDP与A549细胞共孵育24 h和48 h时,细胞存活率无明显差别,且都在80%以上,说明空白载体对A549肺癌细胞无明显毒性。

图5 空白载体的细胞毒性
3.4.2 AT-LP-FDP细胞毒性实验 如图6,给药24 h后A549细胞存活率随着浓度的增大而显著下降,AT-LP-FDP与AT-LP相比差异有统计学意义;给药48 h后,细胞存活率随浓度的增大而下降的趋势更显著,AT-LP与AT-LP-FDP的IC50值分别为(7.2±1.3)μg/mL和(4.9±0.6)μg/mL,表明AT-LP-FDP对A549肺癌细胞的细胞毒性作用比AT-LP的效果更强。
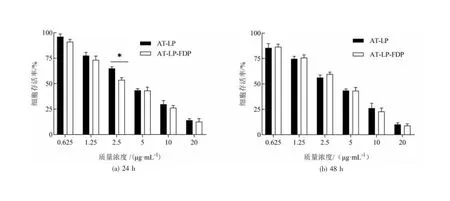
图6 AT-LP和AT-LP-FDP的细胞毒性对比与AT-LP组比,*P<0.05)
4 讨 论
本研究首先采用硫酸铵梯度法制备了AT-LP,然后通过优化冻干工艺制备了可用于吸入的AT-LP-FDP。以冻干前后粒径、包封率、外观等为考察指标,筛选冻干保护剂的种类及用量、预冻时间、预冻温度、干燥时间等工艺参数,得到最优冻干工艺;以此方法制备的AT-LP-FDP的粒径、包封率均在3个月内维持稳定;释放实验结果表明,AT-LP-FDP在两种不同的释放介质中的释放量相近,血清蛋白对药物的释放无影响;空白载体细胞毒性实验结果表明,冻干后的空白载体组细胞存活率均在80%以上,实验所用的载体材料和冻干保护剂无细胞毒性;AT-LP-FDP细胞毒性实验中48 h时的IC50值结果显示,AT-LP-FDP比AT-LP的毒性略强,表明冻干工艺不会影响药物活性。
本研究报道的AT-LP-FDP的制备方法操作简单、可重复性好,制得的AT-LP-FDP粉外观蓬松,溶解性好,引湿性较低,释放量可达要求,抑制细胞作用较好。本研究为AT的给药提供了新的思路,在减轻患者的不良反应方面做出了努力,为AT的应用和肺癌治疗药物新制剂的开发提供新方法。
