一种用于过氧亚硝酸根检测的近红外比率荧光探针的研制
2024-01-13韩志湘代晓婷
韩志湘, 代晓婷, 熊 杰
(江苏大学 环境与安全工程学院, 江苏 镇江 212013)
过氧亚硝酸根(ONOO-)是由一氧化氮自由基(NO·)与超氧阴离子自由基(·O2-)反应生成的一种重要活性氧(ROS).由于其非凡的氧化能力和强大的亲核特性,ONOO-可直接与富电子部分发生反应,进而破坏包括DNA、脂质和蛋白质在内的多种生物分子.研究[1]发现,ONOO-的硝化活性可通过硝化酪氨酸以及免疫原性应答刺激细胞之间信号进行转导.由于ONOO-的生物半衰期非常短,导致其稳态浓度较低,并无法使其在生物体内直接分离和检测,这就对ONOO-荧光探针的研发提出了更高要求[2].因此研发性能优异的荧光探针,用以检测生物体内ONOO-的产生、分布及浓度变化对深入理解ONOO-的分子作用机制具有重要意义.
近年来,科研人员利用ONOO-的强氧化性研发了一系列基于氧化酮类化合物[3-4]、硼酸或硼酸酯化合物[5-8]、硫族(硫、硒、碲等)化合物[9-11]、N-苯丙氨酸[12-14]等机理的荧光探针.但是这部分探针仍存在选择性差、灵敏度低、响应时间长等缺点.同时,仅依靠荧光强度变化的OFF-ON型探针,易受仪器参数、探针分子周围微环境、探针分子局部浓度、光漂白、激发光强度、温度等因素的影响,从而干扰了检测结果[15-16].相比之下,比率荧光探针可同时调节2个发射信号,具有自我校准的功能,可以极大地消除上述干扰,并获得更为精确的结果[17].而较大的发射位移有利于提高信噪比,具有更高的灵敏度.基于荧光共振能量转移(FRET)的探针需要2种荧光团,它们可以显示出合适的发射位移(100~200 nm),但其合成比较复杂[18-19]. 因此,开发合成简单、大发射位移、可用于过氧亚硝酸根准确检测的比率荧光探针仍然具有挑战性.
为此,笔者拟设计一种基于半花菁的近红外比率荧光探针分子Cy-P,并将其用于ONOO-的近红外比率检测,同时与其他各种可能干扰的生物分析物相对比,研究该探针对ONOO-的识别特点.
1 材料和方法
1.1 试剂与仪器
氯化亚锡购自上海泰坦科技有限公司.DMEM高糖培养基、胎牛血清(FBS)、青霉素/链霉素、胰蛋白酶、脂多糖(LPS)购自合肥博美生物有限公司.其他所有化学药品均为市售分析纯试剂,无需进一步纯化即可直接使用.层析柱所用硅胶(100~200目)购自上海泰坦科技有限公司.硅胶板购自山东烟台江友硅胶开发有限公司.整个试验所需用水均由优普超纯水器(UPH-111-10T)制得.
核磁共振氢谱(1H NMR)和碳谱(13C NMR)分别在400 MHz和100 MHz的Varian INOVA-400光谱仪上获得.高分辨率质谱(HRMS)在Bruker Daltonics Autoflex II MALDI-TOF MS光谱仪上测定.所有的荧光分析试验均在Thermo Scientific Lumina 荧光分光光度计上进行.使用瑞士Mettler Toledo Five Easy Plus FE28型精密pH计进行溶液的pH值测定.HeLa细胞或RAW 264.7细胞通过FBS质量分数为10%的完全培养基进行传代培养.采用Synergy H5酶标仪进行探针细胞毒性测量.
1.2 近红外比率荧光探针分子Cy-P的合成
图1为探针分子Cy-P的合成路线示意图.
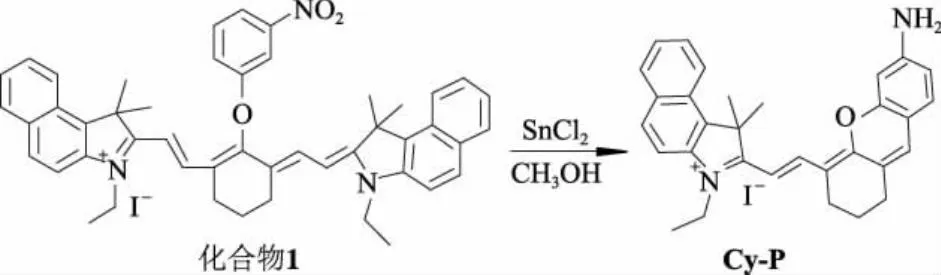
图1 探针分子Cy-P的合成路线示意图
氮气保护下,将溶解于4.0 mL浓盐酸中的氯化亚锡(3.80 g,20.0 mmol)溶液加入化合物1(0.75 g,0.9 mmol)的甲醇溶液中,加热至70 ℃,并搅拌过夜.冷却后,用饱和NaHCO3溶液中和,抽滤并用CH2Cl2溶液洗涤.将收集的滤液和洗涤液用水洗涤3次,使用无水Na2SO4进行干燥.减压旋除溶剂,残余物以V(CH2Cl2)/V(CH3OH)=50 ∶3的溶液作为洗脱剂,在硅胶柱上进行柱层析,得到0.45 g深蓝色固体产物Cy-P,产率为88%.
1H NMR (400 MHz, DMSO-d6)δ:1.36 (t, 3H,J=6.8 Hz) , 1.83 (m, 2H), 1.98 (s, 6H), 2.71~2.70 (m, 4H), 4.41(q, 2H,J=6.4, 6.8 Hz), 6.32 (d, 1H,J=14.4 Hz), 6.73~6.76 (m, 2H), 7.40 (d, 1H,J=8.4 Hz), 7.55 (t, 1H,J=7.6 Hz), 7.63 (s, 1H), 7.70 (t, 1H,J=7.2 Hz), 7.82 (d, 1H,J=8.8 Hz), 8.09~8.15 (m, 2H), 8.25 (d, 1H,J=8.4 Hz), 8.56 (d, 1H,J=14.4 Hz).13C NMR (100 MHz, DMSO-d6)δ:12.890, 20.717, 24.191, 27.835, 28.433, 52.388, 97.973, 100.137, 112.099, 113.241, 114.281, 114.873, 122.507, 123.048, 125.615, 127.872, 128.359, 130.181, 130.482, 131.047, 132.065, 134.187, 138.274, 139.656, 141.721, 155.211, 156.036, 162.554, 175.176.HRMS(C31H31N2O+)m/z的计算值为 447.243 1, 测定值为447.241 8.
1.3 测量过程
称取一定质量的探针分子Cy-P,溶解于N,N-二甲基甲酰胺(DMF)中,得到浓度为1 mmol/L的探针储备液.将20 μL的探针分子Cy-P储备液加入磷酸盐缓冲液(PBS,0.1 mol/L,pH=7.4)中,再加入一定体积的ONOO-储备液,用磷酸盐缓冲液定容至2 mL,得到含有浓度为10 μmol/L的荧光探针Cy-P溶液和浓度为0~15 μmol/L的ONOO-混合待测溶液.所有的光谱测试均在磷酸盐缓冲液(PBS,0.1 mol/L,pH=7.4)中进行.在波长为380 nm和680 nm激发光的激发下测量荧光发射光谱,发射波长分别为400~550 nm和710~800 nm,激发狭缝和发射狭缝均设置为10 nm.
使用超纯水配制K+、Ca2+、Ag+、Cu2+、Fe2+、Fe3+、谷胱甘肽(GSH)、同型半胱氨酸(Hcy)、半胱氨酸(Cys)、HS-、 HSO3-、H2O2、ClO-、·OH和ONOO-的储备溶液.将分析物样品添加到含有10 μmol/L探针Cy-P的PBS溶液中,通过荧光光谱进行检测.
1.4 细胞试验
HeLa细胞和RAW264.7细胞在添加有10%胎牛血清(FBS)的DMEM培养基(37 ℃,5%CO2)中进行培养.然后将细胞转移到35 mm细胞培养皿上,放置24 h,使其贴壁.外源性和内源性ONOO-的荧光成像试验分别以HeLa细胞和RAW264.7细胞为研究对象.将所有细胞在37 ℃下孵育,并在荧光成像前用PBS溶液洗涤3次.所有图像均通过激光共聚焦荧光显微镜(Leica TCS SP5)获得.
2 结果与讨论
2.1 设计与合成
由于花菁染料荧光量子产率高,摩尔吸光系数大,且吸收和发射波长相对较长,因而被广泛用于荧光探针分子的设计[20].笔者通过还原硝基取代的花菁染料得到氨基取代的新型近红外荧光探针分子Cy-P,并通过对其1H NMR、13C NMR和HRMS进行表征而得到确认.该方法合成步骤简便,收率高.
2.2 光谱性质
研究了在PBS溶液中随着ONOO-浓度c(ONOO-)的增加,浓度为10 μmol/L的探针分子Cy-P的荧光光谱变化情况如图2所示,其中F为荧光强度,λ为波长.
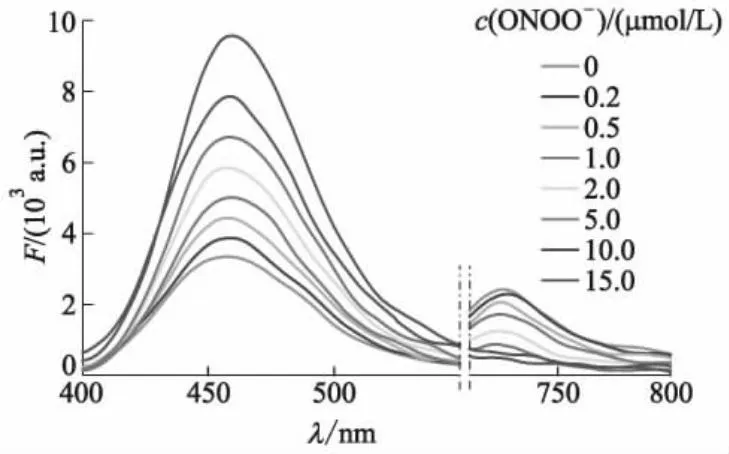
图2 与不同浓度ONOO-作用后的Cy-P荧光光谱
由图2可知:探针Cy-P自身在发射波长为726 nm(激发光波长λex=680 nm)处显示荧光发射峰;加入ONOO-后,在726 nm处的发射峰强度逐渐减小,在458 nm(λex=360 nm)处出现的新荧光发射峰强度逐渐增加.这表明加入ONOO-后,探针分子自身的共轭结构遭到了破坏,生成了新的物质.在浓度为0~15 μmol/L的ONOO-作用下,在458 nm和726 nm处荧光强度比值F458/F726从1.37增加至19.81,增加了13.46倍,荧光最大发射波长移动了268 nm.此外,在0~15 μmol/L的ONOO-浓度范围内可获得极好的线性关系,如图3所示,计算出的检测下限为13 nmol/L.这些结果表明,该探针具有良好的灵敏度和定量检测ONOO-浓度的功能.
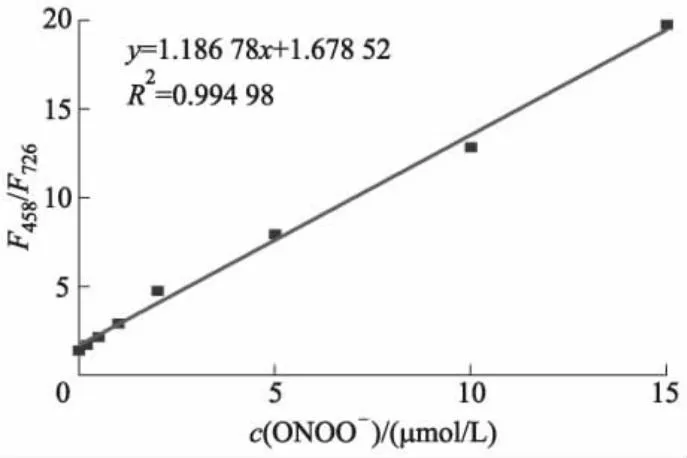
图3 Cy-P在458 nm和726 nm处荧光强度比值与ONOO-浓度的线性关系
2.3 选择性试验
为了评估探针分子Cy-P对ONOO-的选择性,测试了Cy-P对各种潜在干扰分析物的响应性能,这些干扰分析物包括阳离子、阴离子、活性氧(ROS)和活性硫(RSS).研究了浓度为10 μmol/L的荧光探针对浓度为40 μmol/L干扰物的荧光响应情况.图4为360 nm和680 nm激发光激发下,在458 nm和726 nm处荧光强度比值F458/F726的对比,图中横坐标数值1-16分别代表探针Cy-P、K+、Ca2+、Ag+、Cu2+、Fe2+、Fe3+、GSH、Hcy、Cys、HS-、HSO3-、H2O2、ClO-、·OH和ONOO-,其中ONOO-浓度为10 μmol/L,其他分析物浓度为40 μmol/L.

图4 ONOO-及干扰分析物荧光强度比值的对比
由图4可知,相同的条件下,只有ONOO-会引起荧光强度比值F458/F726的显著增加,Cys、ClO-和HSO3-仅仅引起了溶液产生较小的荧光强度比值增加.由此可知,Cy-P对ONOO-具有优异的选择性,这使其能够在复杂的生物系统中检测到ONOO-.
2.4 pH的影响
考虑到pH对探针性能及后续生物体内的分析检测应用有重要影响,研究不同pH条件下,浓度皆为10 μmol/L的探针分子Cy-P与ONOO-反应前后荧光强度比值的变化,结果见图5.由图5可知:探针自身在pH=2~12时没有荧光;将ONOO-添加到Cy-P溶液中后,pH=7~12时观察到探针Cy-P在波长458 nm和726 nm处荧光强度的比值F458/F726显著增加,这个pH范围涵盖了细胞内生理溶液的pH.可见,该探针适用于细胞内ONOO-的检测.

图5 未含和含有ONOO-时Cy-P的荧光强度比值随pH变化的曲线
2.5 响应时间的影响
监测了加入浓度为10 μmol/L的ONOO-后,浓度为10 μmol/L的Cy-P荧光强度比值F458/F726随反应时间t变化的情况(见图6).由图6可知,反应16 min后荧光强度比值达到最大值,且基本保持稳定.因而,探针Cy-P可用于ONOO-的快速检测,且该特性有利于探针Cy-P在活细胞内的应用.
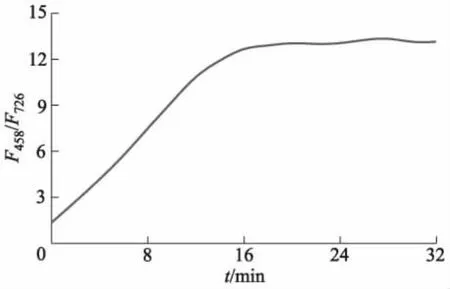
图6 与ONOO-溶液作用后Cy-P荧光强度比值随反应时间变化的曲线
2.6 反应机理

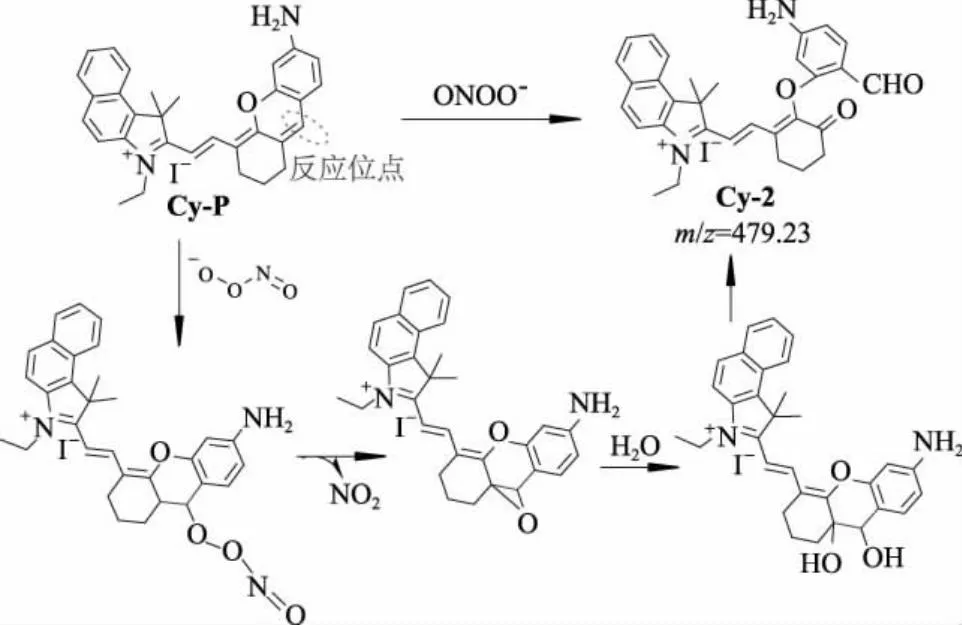
图7 Cy-P和ONOO-的可能反应机理示意图
2.7 细胞内荧光成像
鉴于采用探针Cy-P检测ONOO-的方法具有信噪比高、响应速度快、选择性强和能够在生理条件下响应等优点,将探针Cy-P进一步应用于细胞中内源性和外源性ONOO-的可视化检测.在荧光成像之前,通过常规MTT测定法评估了活细胞中Cy-P的细胞毒性.图8为浓度为0~20 μmol/L的Cy-P与HeLa细胞、RAW264.7细胞培养12 h后的细胞存活率k的情况.图9为不同培养时间下,浓度为10 μmol/L的Cy-P与HeLa细胞、RAW264.7细胞作用后细胞存活率k的情况.由图8和图9可知:细胞在探针分子Cy-P溶液中培养12 h后,仍可保持大于 80%的细胞存活率;在10 μmol/L探针溶液中培养48 h后,细胞存活率也大于 80%.可见,Cy-P在HeLa细胞和RAW264.7细胞中细胞毒性较小,因而适用于活细胞内的荧光成像.

图8 Cy-P与HeLa细胞、RAW264.7细胞作用后细胞存活率随ONOO-浓度变化的情况
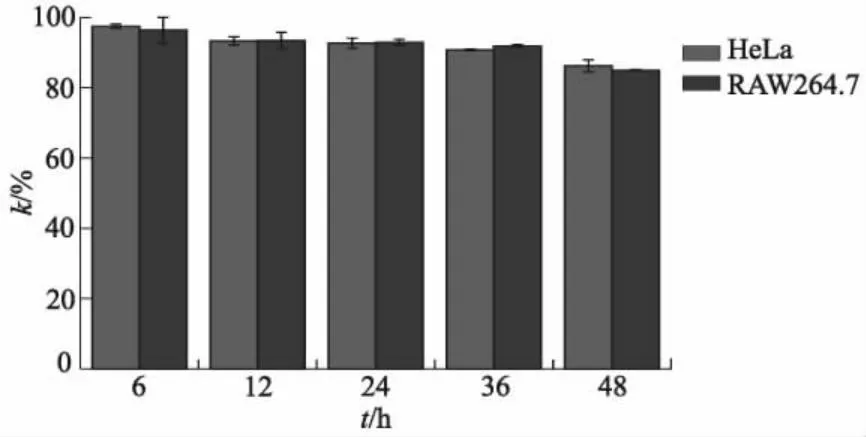
图9 Cy-P与HeLa细胞、RAW264.7细胞作用后细胞存活率随时间变化的情况

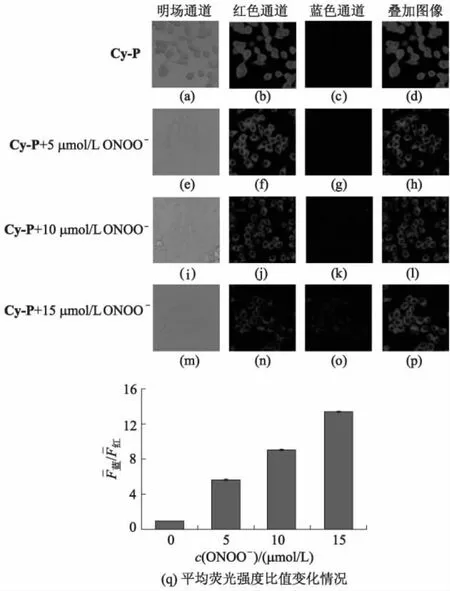
图10 Cy-P在HeLa细胞中检测ONOO-的荧光图像
进一步评估探针Cy-P用于内源性ONOO-检测的可行性.已知RAW264.7细胞可通过LPS刺激产生更高浓度的内源性ONOO-.采用Cy-P检测RAW 264.7细胞中内源性ONOO-的荧光图像如图11所示.
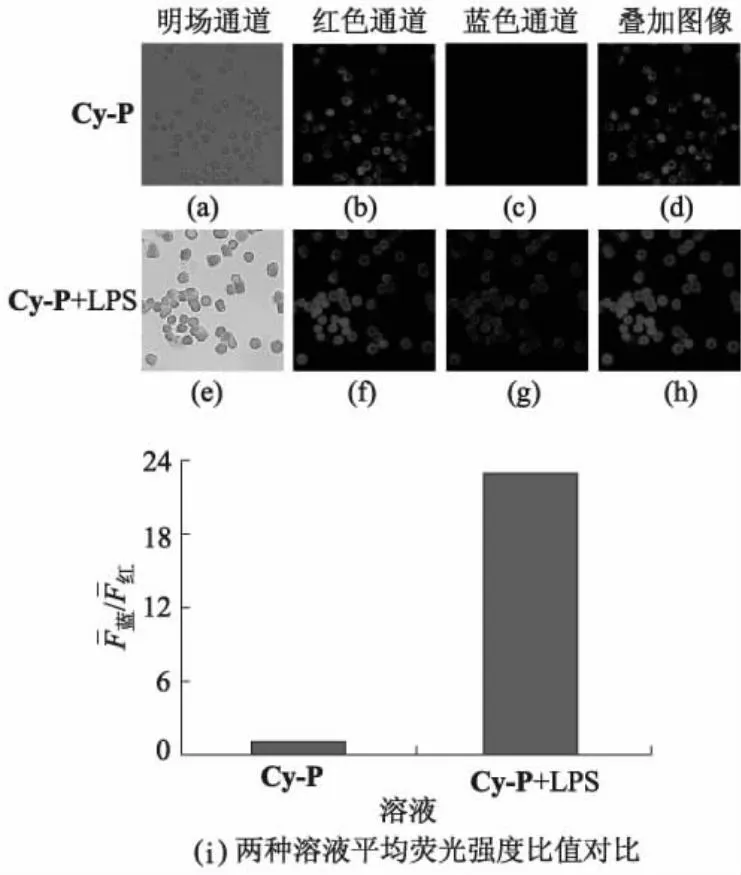
图11 采用Cy-P检测RAW264.7细胞中内源性ONOO-的荧光图像
图11d、h为红色通道和蓝色通道叠加图像.红色通道中,λex=680 nm,λem=690~850 nm;蓝色通道中,λex=360 nm,λem=370~670 nm.图11a-d为RAW264.7细胞与Cy-P(10 μmol/L)培养30 min的荧光图像;图11e-h为LPS(1 μg/mL)刺激RAW264.7细胞12 h,然后与Cy-P(10 μmol/L)培养30 min的荧光图像;图11i为量化每组图像蓝色通道与红色通道的平均荧光强度比值随处理方式不同而变化的情况.
由图11可知:当仅用Cy-P处理细胞时,红色通道中荧光较强,而蓝色通道中的荧光几乎观察不到;与LPS(1 μg/mL)培养12 h,然后用Cy-P处理的细胞在蓝色通道中荧光显著增强,而在红色通道中的荧光有所降低.可见,Cy-P适合用于检测活细胞中内源性ONOO-.
3 结 论
1) 设计并合成的基于半花菁的近红外比率荧光探针分子Cy-P结构简单,可以通过简单的合成方法获得.探针分子Cy-P对ONOO-的光谱响应性能良好,并且观察到荧光最大发射波长蓝移了268 nm,这有利于提高信噪比.
2) ONOO-的浓度为0~15 μmol/L时,探针Cy-P在458 nm和726 nm处荧光强度的比值F458/F726与ONOO-的浓度有很好的线性关系,检测下限为13 nmol/L.
3) 探针在生理条件下对ONOO-具有特异性识别能力,而对常见阳离子、阴离子、ROS和RSS几乎没有荧光响应.探针对ONOO-的响应速度快,响应的pH范围宽.
4)Cy-P具有较小细胞毒性,适用于活细胞中外源性和内源性ONOO-比率可视化荧光成像检测.
