两种不同海洋生物材料对大鼠急性创面修复效果的研究
2024-01-13吕康宁李文军姜晓锐
王 蕾,吕康宁,李文军,王 凯,姜晓锐,秦 松
两种不同海洋生物材料对大鼠急性创面修复效果的研究
王 蕾1, 2,吕康宁1,李文军1,王 凯3,姜晓锐3,秦 松1
(1. 中国科学院烟台海岸带研究所, 山东 烟台 264003; 2. 中国科学院大学, 北京 100049; 3. 烟台毓璜顶医院, 山东 烟台 264001)
为研究来源于海洋的鱼类胶原蛋白和海藻酸盐对创面的修复效果, 建立大鼠皮肤急性创面模型, 对两种材料的功效进行探索。研究采用临床常用创面敷料使用方法, 将两种材料植入创面处, 采用细胞生物学、病理学等方法进行观察评价。结果显示, 鱼胶原蛋白和海藻酸盐均具有良好的生物相容性和诱导创面修复能力, 但在诱导血管长入、材料降解融合以及整体创面修复状态等方面, 鱼类胶原蛋白要优于海藻酸盐。结果证明, 两种不同的海洋生物材料均可以创造良好的伤口愈合环境, 有效促进创面的修复。
创面修复; 海藻酸盐; 胶原蛋白; 诱导
皮肤作为人体抵御外界侵袭的第一道屏障, 具有重要的机体保护作用, 由创伤、烧伤、割伤等各种物理或化学因素造成的皮肤组织缺损在临床上也颇为常见[1]。皮肤创面修复过程分为凝血期、炎症期、肉芽组织形成期及组织重构期四个时期, 是一个多种因子参与、多种机制调控的复杂过程, 任何环节出现问题, 都会导致创面不愈合、创面感染、血管神经受损以及自身免疫功能受损等[2]。因此, 对于大面积皮肤缺损, 尤其是人体难以自愈的缺损, 一般需要借助自体皮肤、皮肤修复材料等进行辅助修复。
在创面修复过程中, 作为细胞外基质最基本、最主要结构性大分子-胶原蛋白的合成、代谢、分解等起到重要的作用, 尤其是作为皮肤结构中的重要类型、与皮肤张力密切相关的Ⅰ型胶原在此当中的作用尤为重要[3]。前期研究发现, 使用从鲑鱼中提取的Ⅰ型胶原蛋白制成的敷料, 在烧烫伤造成的大鼠皮肤损伤治疗过程中, 表现出良好的促进修复效果; 有研究表明鱼皮脱细胞基质具有优异的急性创面修复效果, 具有良好的临床应用前景[4]。已在临床应用的海藻酸盐是一种聚阴离子的天然亲水性多糖, 主要由D-甘露糖醛酸(M)和 L-古洛糖醛酸(G)聚合而成, 含有游离羧基, 性质活泼, 与一价以上金属离子结合后转化为海藻酸盐, 高M-嵌段量的海藻酸盐可以诱导更高水平的细胞因子产生, 促进伤口愈合[5]。虽然两种来源的海洋生物材料在创面湿润环境创造、促进创面修复等方面均表现出优异的性能, 但由于原材料来源、生产检验标准、功效验证标准等因素的缺乏, 使得原材料生产环境可控、生产工艺可控、质量和功效可控的海藻酸盐已在临床广泛使用, 而尚不具备上述条件的鱼类胶原蛋白尚未获得医疗器械上市许可。本研究构建了大鼠背部皮肤急性创伤模型, 对使用鲑鱼鱼皮提取的Ⅰ型胶原蛋白海绵和海藻酸盐敷料修复效果进行了对比性评价, 参照对比海藻酸盐敷料的功效和性能, 为鱼类Ⅰ型胶原蛋白海绵作为生物医用材料修复创面提供理论依据, 为其功效评价标准提供一定的依据, 为后期临床应用提供数据支持。
1 材料与方法
1.1 材料
鲑鱼胶原蛋白海绵(由实验室使用大西洋鲑鱼鱼皮, 经过除杂、脱色、脱脂、脱蛋白、酸溶、酶解、透析等步骤获得浓缩液后, 放入模具, 低温冷冻干燥制备而成)。海藻酸钠敷料购自正规医疗器械生产厂家(由褐藻中提取的海藻酸盐经过湿法纺丝、无纺布加工、切割包装、灭菌等工艺加工后制成的无菌医用敷料)。SD大鼠(Sprague Dawley, 远交群大鼠, 购自济南朋悦实验动物繁育有限公司)。
1.2 方法
1.2.1 材料与细胞共培养
使用含有10%胎牛血清和1%青霉素-链霉素的DMEM培养基(dulbecco’s modified eagle medium, Dulbecco的改良eagle培养基)将L929细胞在37 ℃含5%CO2的培养箱中, 培养至对数生长期。
活/死染色: 将两种材料分别放入48孔板, 在相应孔中植入L929细胞, 细胞植入密度5×104个细胞/cm2。培养至第3 d, 将正常细胞培养基换成含1.5 μL碘化丙啶和1 μL钙黄绿素-AM(Calcein-AM / PI Double Staining Kit, 日本)的PBS溶液, 孵育30 min。将样品用PBS轻轻洗涤后, 在荧光显微镜下观察。
细胞黏附: 将胶原蛋白海绵、海藻酸盐敷料分别放入48孔板中, 以5×104个细胞/cm2的密度植入对数生长期的L929细胞, 培养至第3 d, 取出海绵和敷料样品, 用PBS溶液轻轻洗涤3次后, 用2.5%的戊二醛溶液固定3 h, 低温冷冻干燥后, 喷金, 扫描电镜观察细胞黏附、爬行生长情况。
1.2.2 大鼠皮肤缺损模型制备及处理
将SD大鼠随机分为A、B、C、D四组, 每组9只, 背部脱毛处理后, 使用直径1.5 cm的环钻在裸露位置取全层皮肤, 制作大鼠皮肤缺损模型。A组在缺损处填充鱼胶原蛋白海绵; B组填充海藻酸钠伤口敷料, C组每两天使用消毒液消毒一次, 常规医用纱布覆盖伤口。D组作为正常组对照, 不做任何处理。所有大鼠术后在正常条件下饲喂, 正常饮水。
1.2.3 表征观察
术后, 观察记录大鼠创面位置炎性反应、创面生长、创面周围红肿等情况; 同时, 观察各组植入材料的状态。记录每组大鼠创面完全愈合个体出现时间、所有个体完全痊愈时间等, 各组之间进行比较分析。
1.2.4 组织学观察
建模后, 第3、7、14 d每组大鼠处死3只大鼠, 测量创面区大小后, 沿创面缺损区边缘外0.5 cm, 内部至肌肉层剪取整个创面缺损区组织。常规石蜡固定、切片后, 进行HE染色、Masson染色, HE染色观察创面愈合过程中, 缺损部位细胞种类、细胞形态以及组织结构、血管、神经等变化情况; Masson染色观察大鼠皮肤缺损区胶原蛋白、新生胶原蛋白、植入材料变化情况等。
2 结果和讨论
2.1 细胞生长、黏附状态
通过材料与细胞的共培养, 观察细胞在材料表面和内部的状态, 可以判断材料是否有细胞毒性, 是否有诱导细胞进入、爬行的能力。活/死细胞染色结果显示(图1), 胶原蛋白海绵凭借其优异的生物相容性、高孔隙率、高比表面积, 提供了丰富的细胞结合位点, 促使细胞沿孔隙和支架结构生长到材料内部, 并在内部增殖; 海藻酸盐纤维也可以起到细胞爬行支架功能, 同样有大量的细胞进入材料内部生长、增殖。扫描电镜结果进一步确认了细胞在胶原蛋白海绵内部的爬行、生长情况, 在支架内部可见大量的细胞黏附在材料表面(图1), 部分细胞伸出伪足进行爬行, 部分细胞在材料表面进行分裂; 海藻酸盐敷料内部同样有细胞在爬行、增殖, 但数量略少于鱼胶原蛋白海绵。由此说明, 细胞可沿胶原蛋白海绵孔隙爬行、分裂, 生长繁殖, 证实材料具有良好的生物相容性、空间结构和细胞结合位点, 无细胞毒性, 适合细胞在其表面和内部黏附、爬行、生长。同样, 海藻酸盐也具有良好的诱导细胞黏附、爬行能力。
注: Ⅰ: 鱼胶原蛋白海绵; Ⅱ: 海藻酸盐敷料
2.2 模型制备及伤口愈合情况
由环钻处理后, 皮肤缺损区直径达1.5 cm, 未伤及肌肉。鱼胶原蛋白海绵与海藻酸盐敷料均可在短时间内吸收创面处的组织液和血液, 形成类似血痂的结构, 有效保护创面。第3 d, 鱼胶原蛋白组个体缺损处的材料与血痂结构融合在一起, 发生不同程度的吸收, 创面明显缩小; 海藻酸盐敷料也与血痂融为一体, 创面也明显缩小; 两种材料组大鼠个体创面缩小程度差异不大, 但剩余面积明显小于自愈组个体。第7 d, 两组皮肤创面面积进一步缩小, 材料覆盖位置均高于周围皮肤组织, 可判断有大量肉芽组织生长, 但鱼胶原蛋白组剩余缺损区面积明显小于海藻酸盐组。第10 d, 鱼胶原蛋白组有部分个体的痂脱落, 伤口完全愈合; 第12 d, 海藻酸盐组有部分个体伤口完全痊愈; 第14 d, 两种材料组的所有个体的伤口全部愈合, 对照组尚未出现痊愈的个体(图2)。可以初步判断, 鱼胶原蛋白海绵与海藻酸盐均具有优异的创面修复能力, 具有良好的促进皮肤愈合能力。
注: Ⅰ: 鱼胶原蛋白海绵; Ⅱ: 海藻酸盐敷料; Ⅲ: 自愈组
2.3 组织病理学检查
HE(图3)和Masson(图4)染色结果显示, 第3 d,两个材料组个体创面位置均可见少量炎症细胞, 部分区域出现血管、胶原纤维、成纤维细胞等, 肉芽组织和成纤维细胞数量明显多于对照组, 但两组之间差异不明显, 鱼胶原蛋白组新生胶原排列规则有序, 在连续性和数量方面明显优于海藻酸盐组; 对照组创面内部有大量的炎症细胞, 也可见少量血管组织出现, 胶原纤维和成纤维细胞数量明显低于两组材料组。第7 d, 鱼胶原蛋白组创面处出现大量的胶原纤维组成的肉芽组织, 纤维纤细致密, 排列有序, 内部有大量的血管, 成纤维细胞数量和密度明显增加, 有大量的新生胶原沉积, 表面上皮组织已可以完全覆盖创面。海藻酸盐组大鼠创面处也形成大量的肉芽组织, 表面被上皮组织覆盖, 内部可见大量血管和成纤维细胞, 但肉芽组织致密程度和新生胶原数量明显低于鱼胶原蛋白组。两种材料组创面修复状态明显好于对照组。第14 d, 鱼胶原蛋白组和海藻酸盐组大鼠创面处均形成完整的上皮组织和轻度的疤痕组织, 鱼胶原蛋白组的疤痕组织胶原纤维密度和直径略小于海藻酸盐组, 上皮组织与疤痕组织的贴合紧密度要强于海藻酸盐组。对照组大部分个体尚未完全愈合。
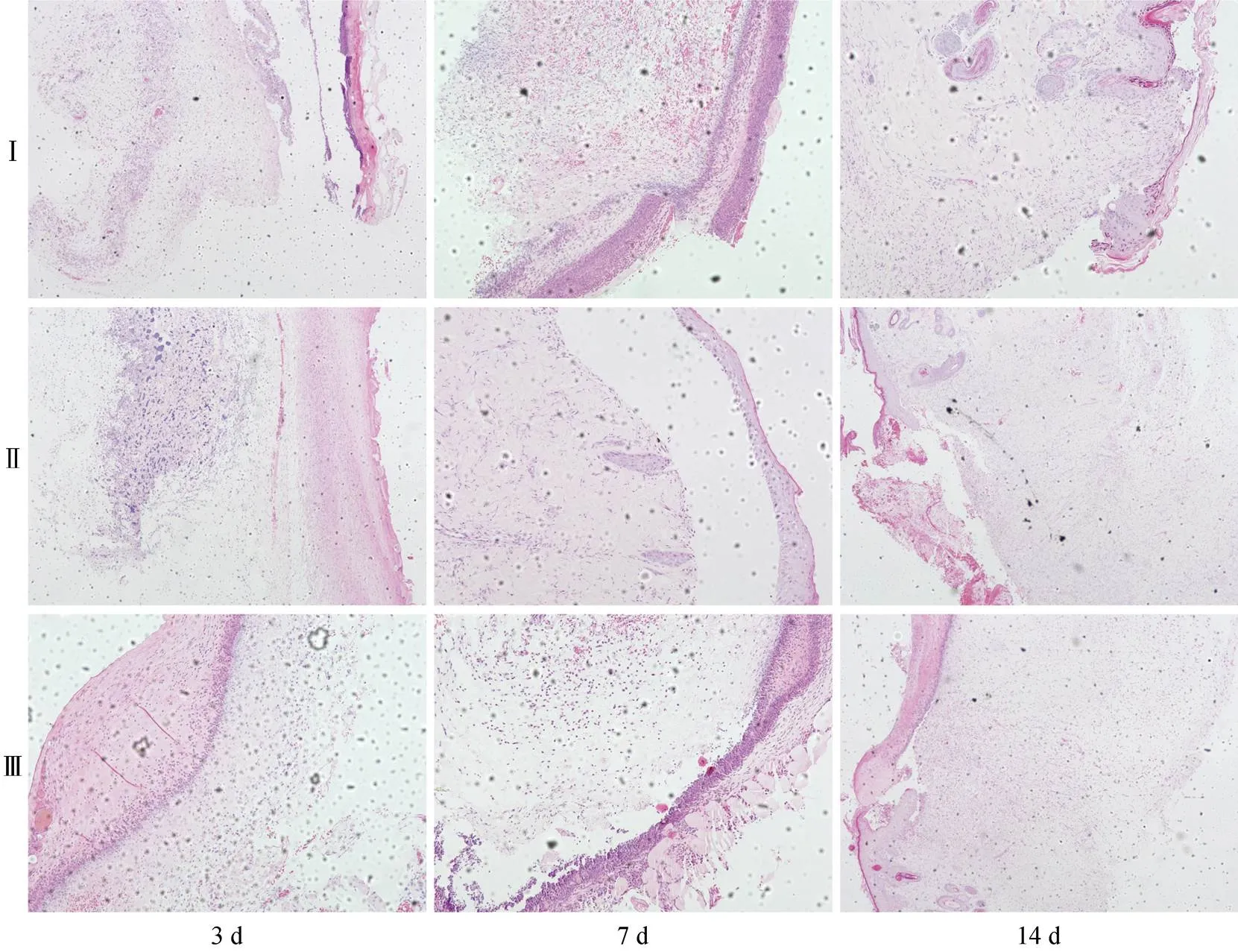
图3 Hematoxylin-Eosin染色结果
注: Ⅰ: 鱼胶原蛋白海绵; Ⅱ: 海藻酸盐敷料; Ⅲ: 自愈组

图4 Masson’s trichrome染色结果
注: Ⅰ: 鱼胶原蛋白海绵; Ⅱ: 海藻酸盐敷料; Ⅲ: 自愈组
上述实验结果表明, 两种海洋来源的生物医用材料-鱼胶原蛋白海绵和海藻酸盐均适合作为细胞支架, 具有良好的诱导细胞黏附和爬行能力。鱼胶原蛋白在诱导肉芽组织生长、胶原再生等方面, 优于海藻酸盐。在创面修复效果方面, 两者差异不明显, 都具有良好的创面修复能力, 都可以作为有效促进创面的愈合。
参照HE染色量化指标(表1, 分数越高, 伤口愈合越好), 对上述各组染色结果进行评分, 结果如表2所示, 鱼胶原蛋白组3个时间点评分均高于海藻酸盐敷料组, 说明鱼胶原蛋白组伤口愈合效果优于海藻酸盐组, 两组均明显优于对照组。

表1 Hematoxylin–eosin染色评分标准表
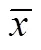
表2 三组Hematoxylin–eosin染色评分结果统计表(± standard deviation)
*: 与对照组相比, 有显著性差异(<0.05)
3 讨论
皮肤创面修复是一个涉及多种细胞、多种因子、多种路径的复杂调控过程, 涉及凝血、炎性反应、细胞迁徙、分化、增殖、瘢痕组织增生、血管长入、表皮生长、神经长入等过程[6]。1962年, Winter在研究中首次证实湿润、具有通透性的敷料所形成的湿润环境, 有助于表皮细胞的生长、迁徙和爬行, 有效促进伤口的愈合, 并提出了“湿润伤口愈合理论”, 随之, 多项研究证明了该理论的正确性, 为促进创面愈合敷料的研究指明了方向[7-9]。海藻酸盐纤维具有良好的吸湿性能和成凝胶性能[10], 植入伤口位置后, 可快速有效吸收可迅速渗出液和血液, 形成低黏度凝胶, 覆盖在伤口上, 保持伤口湿润, 为细胞迁移、爬行和血管再生, 提供一个合适的环境, 加快伤口愈合[11-12]。来源于鱼类的胶原蛋白与陆地哺乳动物胶原蛋白氨基酸结构类似, 具有细胞黏附的代表序列, 便于细胞在其空间结构上黏附, 有利于引导组织再生[13-14]; 同时, 肽链上有大量的二氨基二羧基的存在, 使得鱼类胶原蛋白具有极强的亲水性和止血性能, 是理想的创面修复敷料原料[15-16]。
研究中使用的海藻酸盐敷料为已获批在临床应用的医疗器械产品, 被广泛用于急性创面、溃疡面、慢性创面等方面[17-19], 实际应用效果显著; 但目前尚无鱼类胶原蛋白制成的医疗器械在国内使用, 为此, 选用同样来源于海洋的海藻酸盐进行对比, 观察来源于海洋的不同生物医用材料的具体功效。结果显示, 鱼类胶原蛋白与海藻酸盐敷料都具有良好的生物相容性, 无任何细胞毒性, 可诱导细胞黏附、爬行和生长, 充分证实其植入创面之后, 可有效诱导成纤维细胞、表皮细胞等创面修复细胞的长入和发挥作用。但两者在修复过程中, 又有所差异, 鱼胶原蛋白因为本身属于细胞外基质, 有大量与人体相同的成分, 如氨基酸等, 在创面愈合过程中, 鱼胶原蛋白可以有效的与新生组织融合在一起, 而海藻酸盐则无此功效; 另外, 鱼胶原蛋白在诱导血管长入、相关细胞长入方面以及胶原蛋白沉积量, 胶原纤维再生、致密性和粗细度等方面与海藻酸盐具有一定的差异, 鱼胶原蛋白表现相对优异; 同时, 从愈合后伤口处表征和组织切片观察可以发现, 鱼胶原蛋白组的疤痕组织要小于海藻酸盐组, 疤痕组织胶原纤维直径、致密性等方面也要高于海藻酸盐组。由此, 可以确认, 来源于鱼类的胶原蛋白具有相同甚至优于海藻酸盐敷料的创面修复能力, 具有作为创面修复敷料的潜力。
研究初步针对鱼类胶原蛋白与海藻酸盐的生物安全性、细胞诱导爬行生长能力、创面修复效果等方面进行了探索, 后期将会进一步探索两种材料在创面修复过程中的具体机理差异。
4 结论
经过上述研究表明, 鱼胶原蛋白和海藻酸盐都具有良好的生物相容性, 均可以在创面位置塑造良好的伤口愈合环境, 在诱导创面修复方面均表现优异; 但鱼胶原蛋白在诱导血管长入、材料在体内与自体组织融合、体内降解、整体修复状态等方面, 略优于海藻酸盐。
[1] 张文恺, 许超, 涂冬鹏, 等. 艾灸联合子午流注对大鼠背部创面修复作用的实验研究[J]. 新中医, 2019, 51(6): 246-249. ZHANG Wenkai, XU Chao, TU Dongpeng, et al. Experimental study on the effect of moxibustion combined with midnight-midday ebb flow on the wound healing of the backs of rats[J]. New Chinese Medicine, 2019, 51(6): 246-249.
[2] 张毛毛, 何伟, 吴舒, 等. ASCs对小鼠皮肤全层缺损创面修复机制的研究进展[J]. 中国医学工程, 2013, 21(9): 195-196. ZHANG Maomao, HE Wei, WU Shu, et al. Research progress of ASCs on the repair mechanism of full- thickness skin defect in mice[J]. China Medical Engineering, 2013, 21(9): 195-196.
[3] 胡康, 张伟. 胶原蛋白作为医用生物材料对缺损组织修复、再生及重建的作用与意义[J]. 中国组织工程研究, 2019, 23(2): 317-322. HU Kang, ZHANG Wei. Collagen as a medical biomaterial in tissue repair, regeneration and reconstruction[J]. Chinese Journal of Tissue Engineering Research, 2019, 23(2): 317-322.
[4] SALVATORE L, NUNZIA G, MARIA L, et al. Marine collagen and its derivatives: versatile and sustainable bio-resources for healthcare[J]. Materials Science and Engineering C, 2020, 113: 110963.
[5] FREDERICK U, MOMOHA, JOSHUA S, et al. Development functional characterization of alginate dressing as potential protein delivery system for wound healing[J]. International Journal of Biological Macromolecules, 2015, 81: 137-150.
[6] GOLDBLOOM-HELZNER L, HAO D, WANG A J. Developing regenerative treatments for developmental defects, injuries, and diseases using extracellular matrix collagen-targeting peptides[J]. International Journal of Molecular Sciences, 2019, 20(17): 4072.
[7] 孙桂芳, 张晓芬, 陈亚峰, 等. 皮肤创面修复治疗的研究进展[J]. 医学综述, 2015, 21(18): 3330-3333. SUN Guifang, ZHANG Xiaofen, CHEN Yafeng, et al. Research progress of skin wound repair and treatment[J]. Medical Review, 2015, 21(18): 3330-3333.
[8] RUTH N M, HASNAH B, PAUZI M R, et al. Natural-based biomaterial for skin wound healing (Gelatin vs. Collagen): Expert Review[J]. Polymers, 2021, 13: 2319.
[9] CABALLE-SERRANO J, SOPHIA Z, ANTON S, et al. Tissue integration and degradation of a porous collagen-based scaffold used for soft tissue augmentation[J]. Materials, 2020, 13(10): 2420.
[10] MONGJEN C, LU Y Q, NICHOLAS E, et al. In situ transplantation of alginate bioencapsulated adipose tissues derived stem cells (ADSCs) via hepatic injection in a mouse Model[J]. PLoS One, 2011, 10(9): e0138184.
[11] EMIL R, JONATHAN L, SMADAR C. The promotion of myocardial repair by the sequential delivery of IGF-1 and HGF from an injectable alginate biomaterial in a model of acute myocardial infarction[J]. Biomaterials, 2011, 32(2): 565-578.
[12] HELGA E. Alginate-modifying enzymes: biological roles and biotechnological uses[J]. Frontiers in Microbiology, 2015, 27(6): 523.
[13] SHEKHTER A B, FAYZULLIN A, VOKULOVA M N, et al. Medical applications of collagen and collagen-based materials[J]. Current Medicinal Chemistry, 2019, 26(3): 506-516.
[14] 蒋升, 蔚一博, 徐晓刚. 海洋胶原蛋白的提取及在组织工程学中的研究进展[J]. 药物生物技术, 2017, 24(2): 180-184. JIANG Sheng, WEI Yibo, XU Xiaogang, Extraction of marine collagen and research progress in tissue engineering[J]. Pharmaceutical Biotechnology, 2017, 24(2): 180-184.
[15] COPES F, PIEN N, VLIERBERGHE S V, et al. Collagen-based tissue engineering strategies for vascular medicine[J]. Frontiers in Bioengineering and Biotechnology, 2019, 7: 166.
[16] CHEN J J, GAO K L, LIU S, et al. Fish collagen surgical compress repairing characteristics on wound healing process in vivo[J]. Marine Drugs, 2019, 17(1): 33.
[17] 宋文山, 王园园, 杜芬, 等. 鱼皮胶原蛋白-壳聚糖复合海藻酸盐水凝胶敷料对烧烫伤创面的促愈合作用[J]. 中国海洋药物, 2019, 38(3): 1-6. SONG Wenshan, WANG Yuanyuan, DU Fen, et al. Effect of fish skin collagen-chitosan compound alginate gel dressing on promoting healing of burn and scald wound[J]. Chinese Journal of Marine Drugs, 2019, 38(3): 1-6.
[18] 叶翔凌, 夏远军, 章莹.海藻酸盐临床应用研究进展[J]. 中国骨科临床与基础研究杂志, 2018, 10(3): 172-179. ZHANG Xiangling, XIA Yuanjun, ZHANG Ying. Research progress on clinical application of alginate[J]. Chinese Orthopaedic Journal of Clinical and Basic Research, 2018, 10(3): 172-179.
[19] 张小林, 王兰兰, 翁林, 等. 海藻酸盐医用材料的制备技术及应用现状[J]. 棉纺织技术, 2019, 47(570): 75-80. ZHANG Xiaolin, WANG Lanlan, WENG Lin, et al. Preparation technology and application status of alginate medical materials[J]. Cotton Textile Technology, 2019, 47(570): 75-80.
Effect of two different marine biomaterials on acute wound repair in rats
WANG Lei1, 2, LV Kang-ning1, LI Wen-jun1, WANG Kai3, JIANG Xiao-rui3, QIN Song1
(1. Yantai Institute of Coastal Zone Research, Yantai 264003, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Yantai Yuhuangding Hospital, Yantai 264001, China)
To investigate the wound healing effects of marine fish collagen and alginate, we established rat skin acute wound models and evaluated the efficacy of these two materials. We employed commonly used clinical wound dressing methods by implanting both materials into the wounds and observed and evaluated the outcomes using cell biology and pathology techniques. The results indicated that both fish collagen and alginate exhibited excellent biocompatibility and the ability to stimulate wound repair. However, fish collagen outperformed alginate in terms of promoting blood vessel ingrowth, material degradation and fusion, and overall wound healing. These findings demonstrate that both marine biomaterials create a conducive environment for wound healing and effectively facilitate the wound repair process.
wound repair; alginate; collagen; induction
Jan. 22, 2022
[Shandong Province Key Research and Development Plan (Major Scientific and Technological Innovation Project), No. Project 2019JZZY011103]
Q819
A
1000-3096(2023)10-0087-07
10.11759/hykx20220120004
2022-01-22;
2023-09-26
山东省重点研发计划(重大科技创新工程)(2019JZZY011103)
王蕾(1985—), 男, 山东潍坊人, 博士, 主要从事海洋生物材料研究, E-mail: leiwang@yic.ac.cn; 秦松(1968—),通信作者, 男, 山东曲阜人, 研究员, 主要从事海洋生物高值化利用研究, E-mail: sqin@yic.ac.cn
(本文编辑: 杨 悦)
