盐度胁迫下凡纳滨对虾体内虾青素在着色与抗氧化的资源权衡
2024-01-13杨梦煊王宝杰蒋克勇
杨梦煊, 王宝杰, 刘 梅, 蒋克勇, 仲 晨, 王 雷, 3
盐度胁迫下凡纳滨对虾体内虾青素在着色与抗氧化的资源权衡
杨梦煊1, 3, 王宝杰1, 2, 刘 梅4, 蒋克勇1, 2, 仲 晨4, 王 雷1, 2, 3
(1. 中国科学院海洋研究所 中国科学院实验海洋生物学重点实验室, 山东 青岛 266071; 2. 中国科学院 海洋大科学中心, 山东 青岛 266071; 3. 中国科学院大学, 北京 100049; 4. 山东省海洋科学研究院 青岛市水产生物品质评价与利用工程研究中心, 山东 青岛 266104)
工厂化养殖中产生的环境压力, 会导致对虾应激反应的发生以及体色的减弱。为了探究胁迫下对虾体内虾青素的消耗规律以及对虾的着色与抗氧化之间的关联性, 本研究通过虾青素强化后盐度胁迫的方法进行了实验。结果表明, 与强化前相比, 虾青素强化后植物源(夏侧金盏花)虾青素(d-AST)、合成虾青素(p-AST)处理的对虾肝胰腺中虾青素含量分别增加48.0%和17.5%; 虾壳中分别增加42.8%和45.2%。富含酯化型虾青素的d-AST在肝胰腺中具有更高的沉积量; 而由游离虾青素组成的p-AST在虾壳中具有更高的沉积量, 不同形式的虾青素在不同组织中的沉积具有一定的偏好性。两个处理组对虾的体色明显增强。与盐度胁迫前相比, 胁迫后d-AST、p-AST肝胰腺中虾青素含量分别减少了15.1%和5.7%, 对照组(Ctrl)含量无变化; 虾壳中分别减少了17.8%、52.9%和14.3%, 各组对虾的体色均显著减弱。胁迫24 h检测到编码虾青素转运蛋白β-1, 3-葡聚糖结合蛋白(βGBP-HDL)基因的显著上调表达, 可能与虾壳中虾青素的减少有关。随着胁迫的进行, 与对照组相比, 两个处理组的抗氧化基因均呈现上调表达的趋势; 各组抗氧化能力呈现先上升后下降的趋势, 并在48 h时达到最大值, d-AST、p-AST分别为对照组的1.35和1.30倍。据此, 作者推测对虾体内的虾青素是按照资源权衡的原则在着色和抗氧化功能中进行分配的, 在遭受环境胁迫时, 对虾会优先将用于着色部分的虾青素(虾壳中)转运至肝胰腺中参与抗氧化, 进而表现为体色的减弱和抗氧化能力的上升。
凡纳滨对虾(); 虾青素; 体色; 抗氧化
在工厂化的养殖、采捕和运输过程中, 一些物理压力如分级、运输、处理、拥挤和密闭等, 会导致凡纳滨对虾()应激反应的发生[1]和体色的减弱。这一现象提示, 对虾的体色与应激过程发生的反应或许具有某种联系。虾青素与水生动物皮肤和肌肉的色素沉着密切相关[2-4], 同时具有强大的抗氧化性能, 在水生动物的生长和存活以及抗应激和提高免疫等方面发挥着重要作用[5-7]。虾青素表现出与资源权衡假说相吻合的特征, 这表明其在对虾的体内可能以资源权衡的方式发挥作用。
资源权衡假说是动物性选择中维持颜色显示的信号诚实的假设之一[8-9], 该假说认为只有健康状况良好的个体才能“负担得起”形成高质量的具有装饰功能的体貌特征[10]。这种假说有两个关键假设: (1)着色所需的资源稀缺或难以获得; (2)着色所需的资源同时具有重要的生理功能。在鸟类中, 类胡萝卜素被认为以资源权衡的方式在装饰功能和生理功能(主要是在抗氧化过程中)进行分配权衡[11-14],在发育过程中, 个体可以改变用于装饰的类胡萝卜素的数量。FAIVRE等[15]对欧洲黑鸟()进行的实验有力地证明了免疫激活过程中类胡萝卜素从着色转向免疫和抗氧化功能。而在遭受环境压力后对虾体色变淡意味着虾青素含量降低, 那么消失的虾青素是否与对虾的应激反应有关?
因此, 为了探究对虾的体色变化与应激反应的关系, 本研究以两种不同来源的虾青素产品作为添加剂进行短期强化以获得不同虾青素水平的对虾, 并通过急性盐度胁迫使对虾充分应激, 从而研究虾青素在对虾体内着色和抗氧化之间的分配, 以期对资源权衡假说进行补充, 并为虾青素在对虾养殖中的应用提供参考。
1 材料与方法
1.1 实验用虾与饲料
所有动物实验均按照《实验动物管理与使用指南》[16]进行。实验用凡纳滨对虾由青岛瑞滋海珍品发展有限公司暂养, 幼虾发育65 d后(初始体质量, 6.40±0.25 g)正式进行实验。实验饲料采用南美白对虾配合饲料(山东海博农牧科技有限公司), 基础饲料中虾青素浓度为2.83±0.19 mg/kg。不同虾青素产品以90 mg/kg的终浓度添加到饲料中均匀混合后进行投喂, 现用现配。实验所用虾青素产品均为购买所得, 分别为d-AST (夏侧金盏花()提取物, 主要成分为双酯虾青素)和 p-AST (合成的游离虾青素), 不同来源虾青素产品信息见表1。
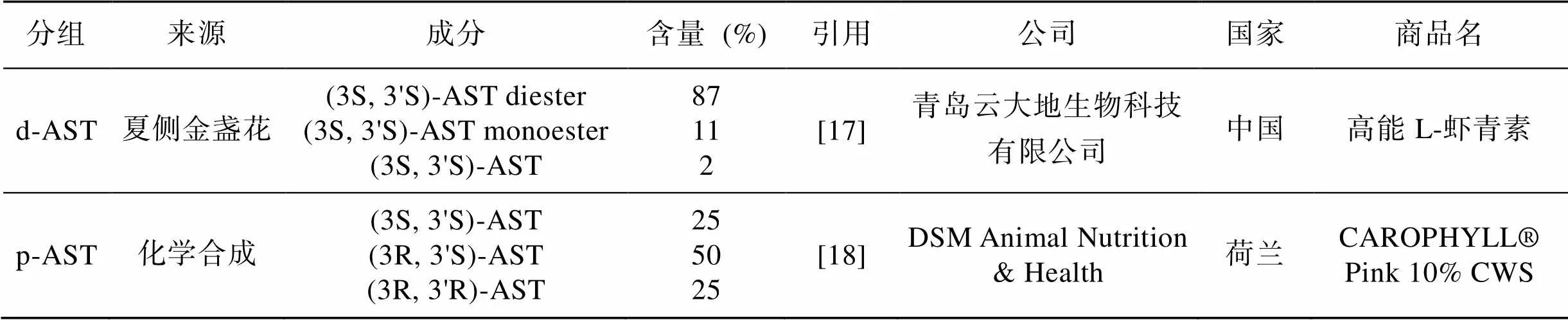
表1 不同来源虾青素产品信息
1.2 实验设计与日常管理
实验设计见图1, 分为两个阶段, 第一个阶段是虾青素强化阶段, 对虾被随机分配到9个PVC水槽中(0.5 m3, 每桶250只虾), 分为两个处理组和一个对照组, 分别投喂添加90 mg/kg d-AST、90 mg/kg p-AST的饲料和基础饲料, 每组3个平行。日投喂量为对虾体质量的3 %, 持续14 d。实验期间水温维持在27~29 ℃, 溶解氧>5.0 mg/L, pH为7.0~7.8, 氨氮浓度为 0.1~2.0 mg/L, 亚硝酸盐浓度为0.1~1.8 mg/L, 盐度为30。第二个阶段是胁迫阶段, 经过强化后的对虾被随机分配到9个PVC水槽(0.3 m3, 每桶70只虾), 均投喂基础饲料, 设置盐度3‰进行胁迫实验。
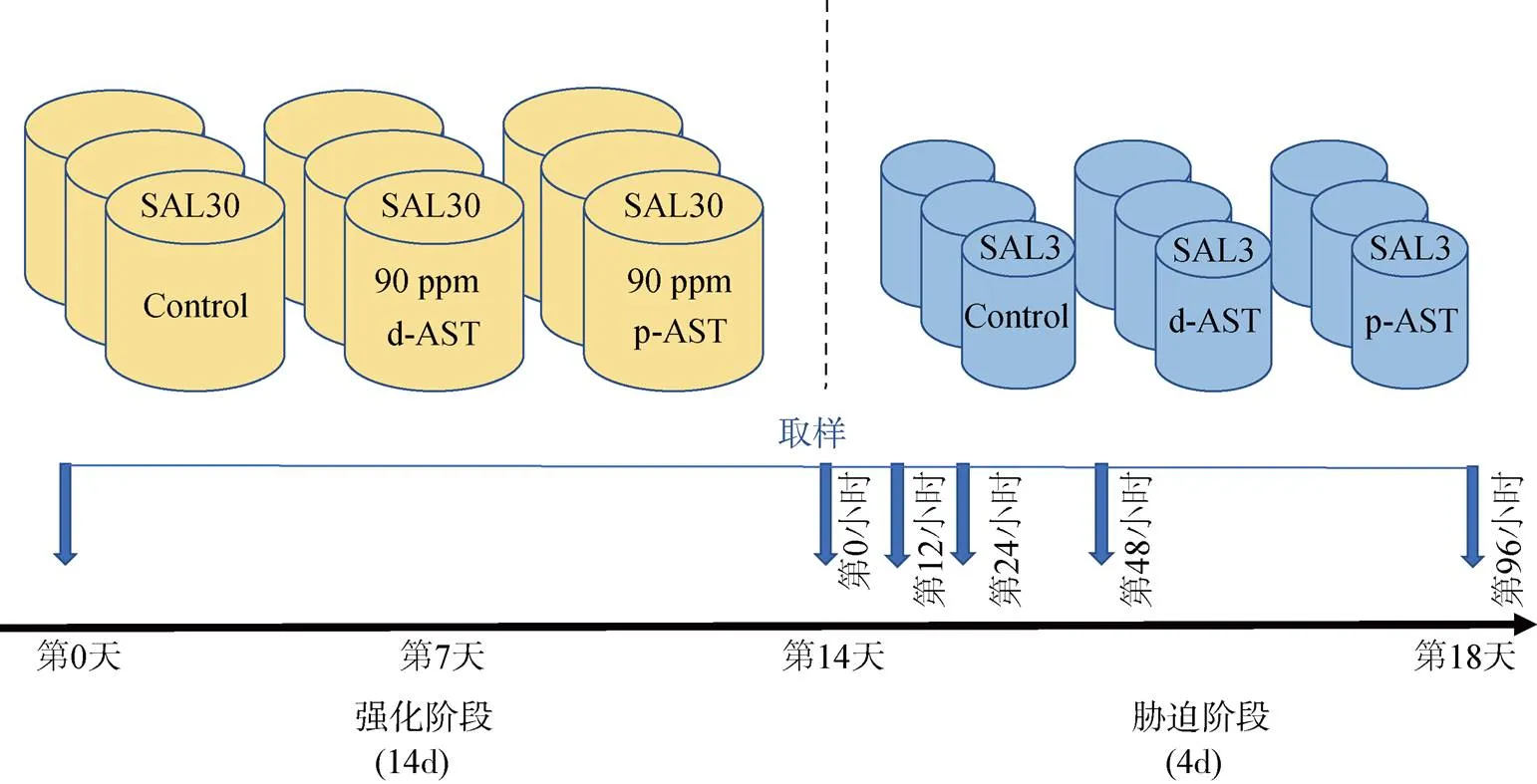
图1 实验设计示意图
注: 实验由连续的两个阶段组成, 分别为强化阶段和胁迫阶段; Ctrl: 对照组; d-AST: 植物源(夏侧金盏花)虾青素; p-AST: 合成虾青素
1.3 体色检测
分别在实验的第1天、第14天(0 h)和第18天(96 h)在每处理组中取若干只对虾, 煮熟后比较体色, 方法参照NOGUEIRA等[19]。使用在白色参考板上校准的NR200色度计(三恩时科技有限公司)进行比色分析。根据国际照明委员会的概念[20], 颜色是外观的三维特征, 由一个亮度属性(L*)和两个色度属性(色调和色度)组成。对虾的颜色主要由a*(红/绿色度)和b*(黄/蓝色度)表示。所有对虾煮熟后立即进行颜色测量, 在虾的腹部区域分别进行3次读数, 总是在虾的右侧。主观评分是在标准化的荧光灯下使用Lineal Salmofan (帝斯曼(中国)有限公司)进行的, 3名研究人员为每种动物记录的分数都是一致的。
1.4 虾青素含量检测
分别在实验的第1天、第14天(0 h)和第18天(96 h)在每处理组中取若干只对虾, 分别取肝胰腺、虾壳以及去除肌肉后的整虾进行液氮速冻。实验结束后统一送至中国水产科学研究院黄海水产研究所测定虾青素含量, 检测方法参照CIFUENTES等[21]的方法进行, 通过高效液相色谱法(HPLC)从类胡萝卜素总提取物中分离并测定虾青素。
1.5 抗氧化能力检测
胁迫阶段开始后, 分别在0、12、24、48、96 h的每处理组取5只对虾肝胰腺放入离心管中, 使用0.86%冷生理盐水进行稀释匀浆, 然后在0~4 ℃下以2 500 r/min的速度离心10 min, 保留上清液, 根据制造商的说明使用试剂盒进行总抗氧化能力测定(南京建成生物工程研究所)。
1.6 基因表达检测
胁迫阶段开始后, 分别在0、12、24、48、96 h的每处理组取3只对虾肝胰腺保存于RNA guard中, 4 ℃放置24 h后液氮速冻。使用SPARKEasy组织/细胞RNA提取试剂盒(山东思科捷生物技术有限公司)从每个样本中提取总RNA, 并使用SPARKSCRIPT II RT Plus试剂盒反转录获得互补DNA。以β-actin为参照基因, 采用实时荧光定量PCR(RT-qPCR)技术测定抗氧化基因锰超氧化物歧化酶基因(), 谷胱甘肽过氧化物酶基因(), 谷胱甘肽巯基转移酶基因()以及热休克蛋白70基因()和虾青素载体蛋白β-1, 3-葡聚糖结合蛋白()的相对表达, 引物见表2。使用2–ΔΔCT方法对相对基因表达进行量化。所有样品都进行了1式3份的分析。

表2 RT-qPCR引物序列
1.7 数据统计与分析
实验数据以平均数±标准差表示, 采用SPSS 26.0统计软件进行单因素重复测量的方差分析和 Duncan法多重比较,<0.05为差异性显著。
2 结果
2.1 投喂不同来源虾青素对虾的生长性能
由表3可知, 在虾青素强化阶段, 添加虾青素的处理组增质量和特定生长率以及存活率均高于对照组, 但是差异并不显著(>0.05), 表明在为期两周的强化阶段, 日粮中添加外源虾青素对于对虾的生长并无显著影响。

表3 强化阶段不同处理组对虾的生长性能
注: 增质量(g)=M–0, 特定生长率(%/天)=[ (lnM–ln0)/]×100%, 存活率(%)=(N/0)×100%, M为对虾终末体质量,0为对虾初始体质量,为实验天数,N为实验终末存活对虾数量,0为实验初始投放对虾数量。数据以平均数±标准差表示(=20), 同一行不同上标表示差异有统计学意义(<0.05)。
由图2可知, 在盐度胁迫阶段, 胁迫开始后, 各组对虾均急剧死亡, 在12 h后存活率均下降至50%以下, 在48 h后稳定维持在30%~40%。整个胁迫阶段, 各组存活率均无显著差别(>0.05), 对虾受到了充分的急性盐度胁迫。
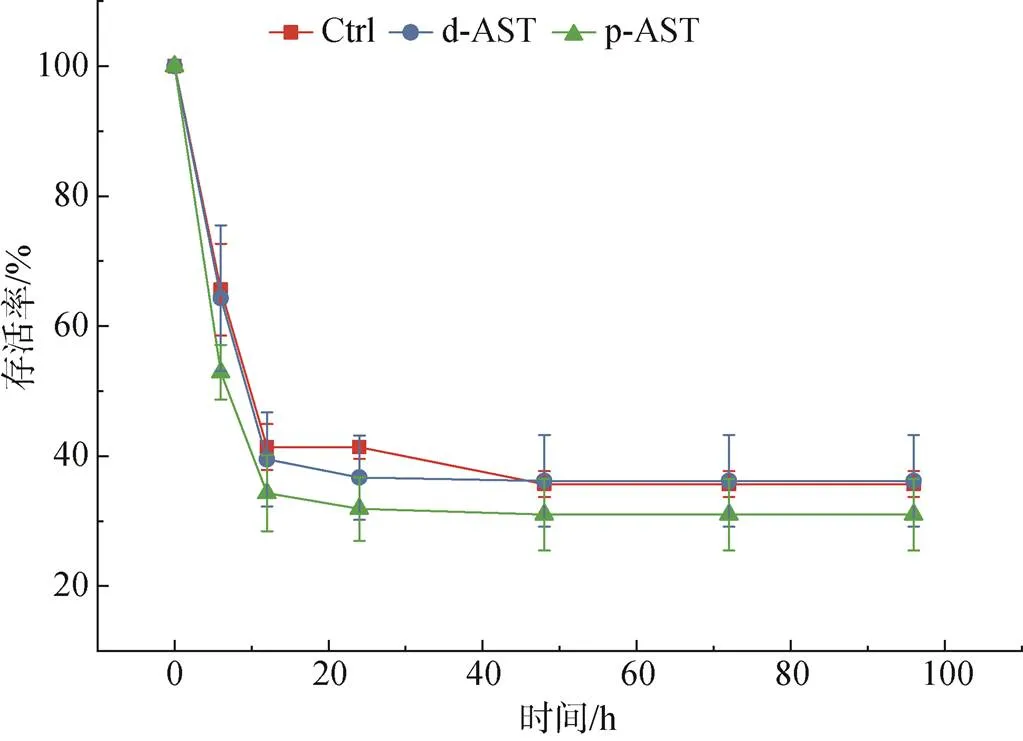
图2 胁迫阶段不同处理对虾的存活率
2.2 投喂不同来源虾青素对虾在盐度胁迫下体色的变化
由图3可知, 在经过虾青素强化后, 可以观察到体色(熟色)明显变红, 根据Salmofan评分可知, p-AST处理组具有更好的着色效果。在经过盐度胁迫后, 可以观察到体色明显变淡, 较实验起始时红度(a*)更低, d-AST组保持了相对较强的红色。
由表4可见, 在经过虾青素强化后, 各组对虾的尾部体色红度均增大, 黄度(b*)均减小, d-AST和p-AST处理组对虾的红度均显著强于对照组(0.05), 其中p-AST处理组红度值最大; 对虾经过盐度胁迫后, 各组对虾的尾部体色红度和黄度均减小, d-AST和p-AST处理组对虾的红度仍显著强于对照组(<0.05), 其中d-AST处理组维持了相对较高的红度, 这与图3中的结果一致。

图3 不同来源虾青素处理对虾体色的变化
注: 从左到右依次为初始、强化后和胁迫后; 右上角的数字是Salmofan评分。

表4 不同来源虾青素处理对虾的体色参数
注: a*: 红/绿色度; b*: 黄/蓝色度; 数据以平均数±标准差表示(=3), 同一列不同上标表示差异有统计学意义(<0.05)
2.3 投喂不同来源虾青素对虾在盐度胁迫下各组织虾青素含量变化
由图4a可知, 在经过虾青素强化阶段后, 对照组对虾整虾中的虾青素含量无明显变化, d-AST和p-AST处理组中整虾虾青素含量均显著增加(< 0.05), 并显著高于对照组(<0.05), 分别达到对照组的1.5倍和1.8倍, 表明两个处理组中外源虾青素有效沉积在对虾体内。经过盐度胁迫阶段后, 对照组和p-AST处理组整虾的虾青素含量均显著降低(<0.05), 而d-AST处理组中整虾虾青素含量无明显变化。
由图4b可知, 在经过虾青素强化阶段后, 对照组对虾肝胰腺中虾青素含量显著降低(<0.05); d-AST处理组中对虾肝胰腺虾青素含量显著升高(<0.05), 与起始相比增长48.0%; p-AST处理组中对虾肝胰腺虾青素含量升高 (=0.216), 与起始相比增长17.5%, d-AST处理组的对虾肝胰腺拥有最高的虾青素含量。经过盐度胁迫阶段后, 对照组对虾肝胰腺中虾青素含量无明显变化, d-AST处理组中肝胰腺虾青素含量降低(=0.093), 与前阶段相比降低15.1%; p-AST处理组肝胰腺虾青素含量降低(= 0.189), 降低5.7%。
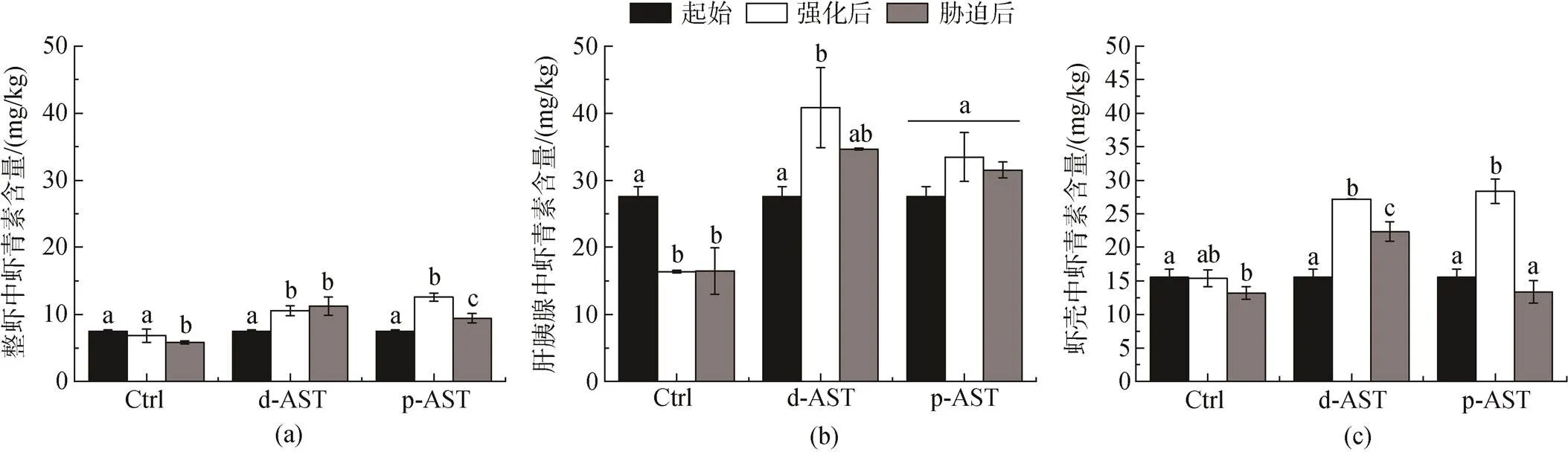
图4 不同处理各组织中虾青素的含量变化
注: 不同字母表示有统计学差异(<0.05,5)
由图4c可知, 在经过虾青素强化阶段后, 对照组对虾虾壳中虾青素含量无明显变化, d-AST处理组和p-AST处理组中对虾虾壳中虾青素含量均显著升高(<0.05), 与起始相比分别增长42.8%和45.2%, p-AST处理组的对虾虾壳中拥有最高的虾青素含量。经过盐度胁迫阶段后, 3个处理组对虾虾壳中的虾青素含量均显著降低(<0.093), 与前阶段相比分别降低14.3%、17.8%和52.9%。
2.4 投喂不同来源虾青素对虾在盐度胁迫下肝胰腺抗氧化能力
由图5可知, 在盐度胁迫阶段, 随胁迫时间延长, 3个处理组对虾的总抗氧化能力均呈先上升后下降的趋势, 与对照组相比, d-AST和p-AST处理组拥有相似水平的起点和终点, 但两个处理组上升趋势更急剧且在48 h达到更高水平的抗氧化能力最大值, 分别较对照组高35.4%和30.1%。
由图6可知, 在盐度胁迫阶段, 随胁迫时间延长, 与对照组相比, d-AST和p-AST处理组的抗氧化基因,,和的表达均表现出了先降低后升高再降低的趋势。与d-AST处理组相比, p-AST处理组抗氧化基因表达的变化表现出一定的滞后性, d-AST处理组和基因均在24 h达到最高的表达水平, 而p-AST处理组在48或48 h之后才达到最高水平的表达。
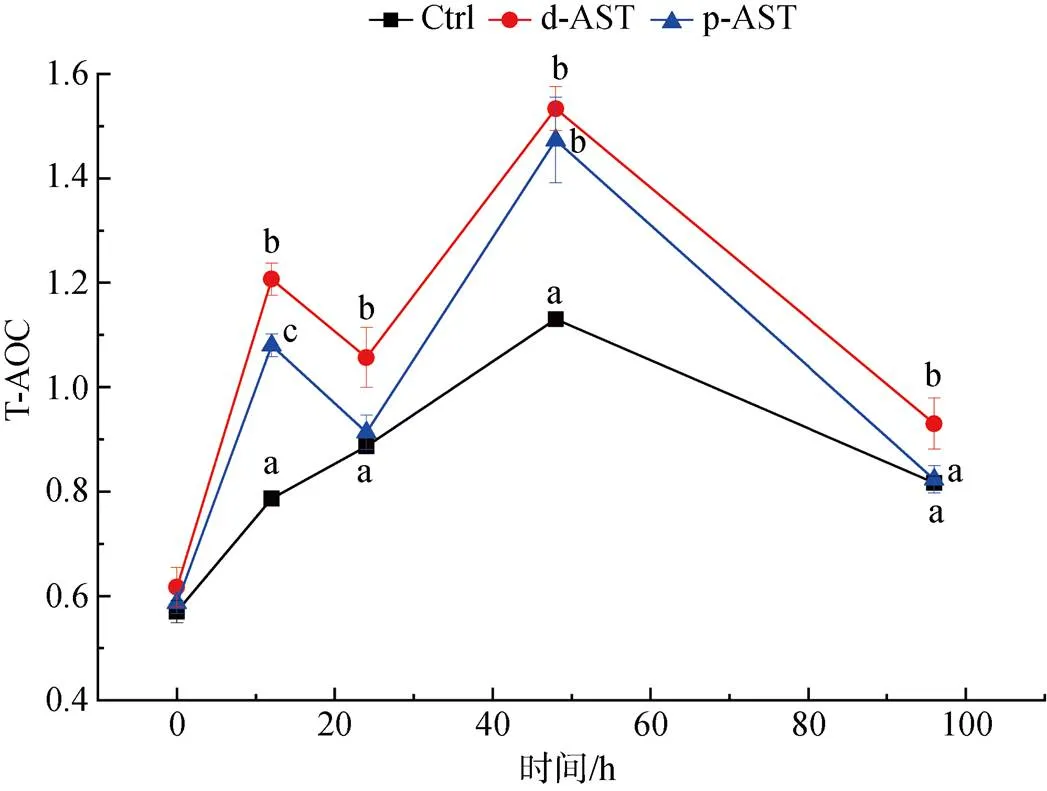
图5 投喂不同来源虾青素对虾在盐度胁迫下的总抗氧化能力变化
注: 不同字母表示有统计学差异(<0.05,=6)
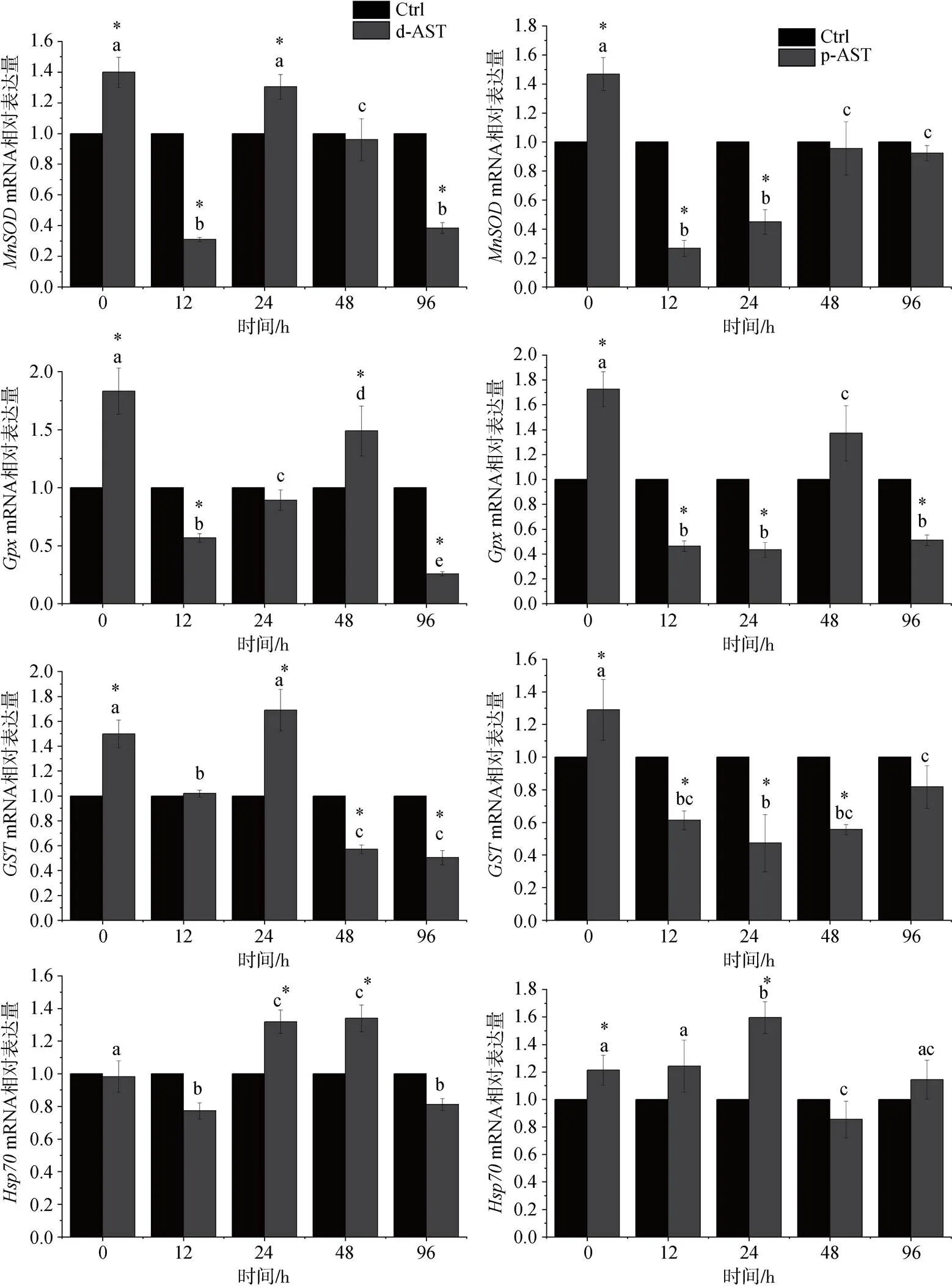
图6 投喂不同来源虾青素对虾在盐度胁迫下肝胰腺抗氧化基因表达情况
注: a. d-AST; b. p-AST, 不同字母表示不同时间之间有统计学差异(<0.05,=3) ; “*”. 同一时间对照组和处理组之间存在显著性差异(<0.05)
2.5 β-1, 3-葡聚糖结合蛋白的表达
由图7可知, 在盐度胁迫阶段, 随胁迫时间延长, 与对照组相比, d-AST和p-AST处理组的肝胰腺β-1, 3-葡聚糖结合蛋白(βGBP-HDL)基因均在24 h时达到了相当高的表达水平, 分别是对照组的97倍和145倍。在其他时间, d-AST处理组基因表达均显著强于对照组(<0.05)。
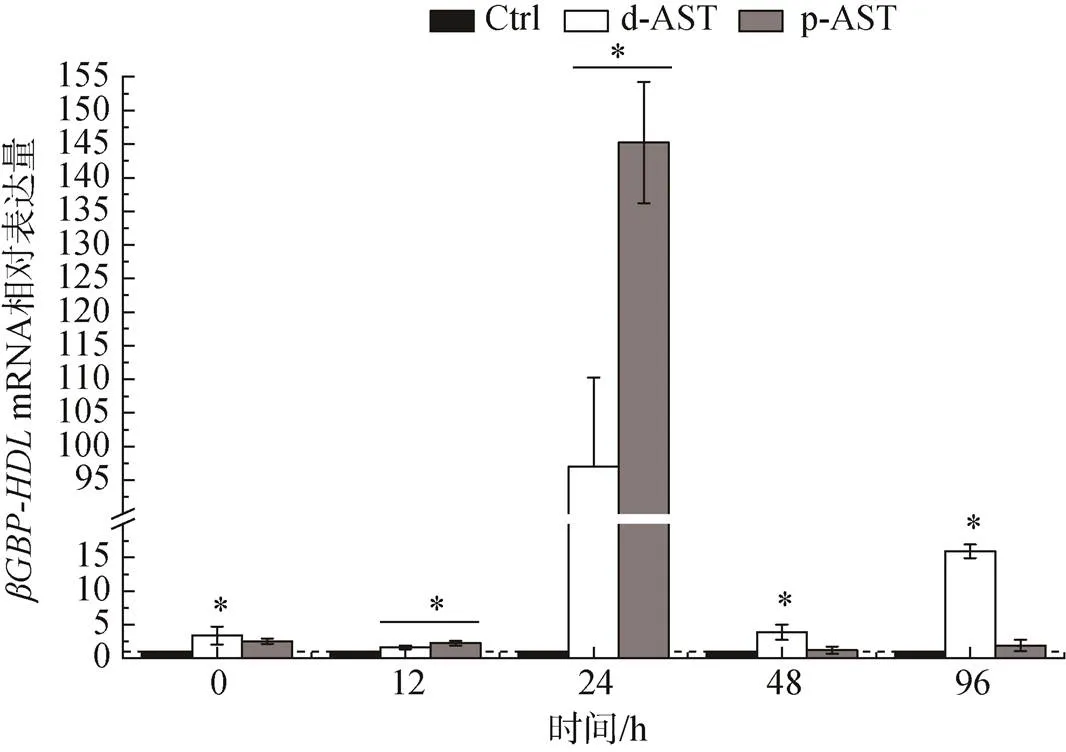
图7 投喂不同来源虾青素对虾在盐度胁迫下βGBP-HDL基因表达情况
注: “*”. 同一时间对照组和处理组之间存在显著性差异(<0.05)
3 讨论
研究表明, 虾青素可以显著增强动物的免疫力和对恶劣环境的抵抗力。在饲料中添加虾青素可增强对虾的抗逆性, 还可以促进对虾天然体色的产生。然而, 高密度养殖过程中产生的物理压力, 会导致对虾应激反应的发生和体色的减弱。因此探究环境胁迫下对虾体内虾青素的消耗规律以及对虾的着色与抗氧化之间的关联性具有重要意义。
本研究结果表明投喂添加虾青素的饲料对对虾的生长性能和存活率均有一定的改善作用, 但效果并不显著(>0.05), 在以前的研究中发现添加外源虾青素可显著增强对虾的生长性能[24], 但是也有一些研究报道添加虾青素对于对虾的生长并无显著影响[6, 25], 结合本实验结果, 这可能与虾青素的处理时间和添加剂量有关。本研究选择了一种短时间高剂量的虾青素强化方式进行实验, 而虾青素对于对虾生长的影响可能是长期的、缓慢的。在胁迫阶段, 结果显示添加虾青素的处理组的存活率与对照组有显著差别(>0.05), 这与CHIEN等[26]的研究不同, 在他们的研究中发现, 增加对虾体内虾青素含量可以明显增强对虾对热和渗透胁迫的抵抗力。这可能与胁迫处理的时间和程度有关, 为了使对虾受到充分的胁迫, 本研究采用了3‰盐度的持续处理, 这种长时间低盐度的胁迫可能超过了虾青素的可调节范围, 使得处理组和对照组在存活率上没有明显的差别。
虾青素是对虾中主要的类胡萝卜素, 是形成虾的体色的主要原因; 同时虾青素对对虾的抗氧化能力、应激缓解、免疫反应调节和抗病力均有积极影响, 这些生物学功能在很大程度上可以归因于虾青素强大的抗氧化性能[25-26]。同时, 对虾缺乏从头生物合成虾青素的能力[27], 这意味着对虾体内的虾青素符合资源权衡假说的两个关键假设, 即作为着色资源稀缺或难以获得以及具有其他重要的生理功能[10], 虾青素在对虾体内的利用或许也符合资源权衡假说, 在着色功能和抗氧化功能之间进行权衡的。
为了验证这一猜测, 本研究在饲料中添加两种不同来源的虾青素对凡纳滨对虾进行强化, 并成功获得了不同虾青素水平的对虾, 在两个处理组中, 虾青素有效沉积在肝胰腺或虾壳中。同时观察到了对虾体色的显著增强, 而对虾的体色主要是由皮下组织与虾壳中的虾青素决定[28-29], 因此, 虾壳中沉积的虾青素可以被认为是分配到着色功能的部分, 各组中虾壳虾青素的含量高低(图4c)与体色强弱(图3、表4)的对应关系也证明了这一假设。通过d-AST和p-AST处理组进行比较发现, 对虾对于不同构型的虾青素在不同组织中的沉积似乎具有偏好性, 富含酯化型虾青素的d-AST处理组中, 虾青素在肝胰腺中具有更高的沉积量; 而由游离虾青素组成的p-AST处理组中, 虾青素在虾壳中具有更高的沉积量, 这也解释了为何游离型虾青素具有更好的着色效果。
虾青素作为外源摄入的抗氧化剂与内源性抗氧化酶共同构成了甲壳类动物的综合抗氧化防御系统[30], 本研究通过盐度胁迫实验对虾青素的抗氧化功能进行了检验。随着胁迫实验的进行, 对虾受到了充分的胁迫, 对虾的总抗氧化能力逐渐增强, 并在48 h时达到最大值(图5)。d-AST和p-AST处理组的总抗氧化能力拥有与对照组相似的起始和终止水平, 但是在48 h表现出显著强于对照组的抗氧化能力(<0.05), 分别超出对照组35.4%和30.1%。这部分超出的抗氧化能力是由两个处理组中高水平的虾青素引起的。d-AST和p-AST处理组中抗氧化基因的表达同样呈现逐渐上升的趋势(图6)(0 h时各基因高水平的表达可能与胁迫实验开始时对虾环境的变化有关, 即从强化阶段的水槽中转移到胁迫阶段的水槽中), 这些抗氧化基因可以调节抗氧化酶和分子伴侣蛋白的表达, 构成对氧化应激的防御机制以维持免疫稳态[31-33]。与总抗氧化能力不同, 抗氧化基因上调表达的最高峰出现得较早, 多在24~48 h内达到最高水平的表达, 而总抗氧化能力的增长则在48 h或更晚, 这符合基因表达的规律。胁迫48 h后, 总抗氧化能力和抗氧化基因表达都呈现出下降的趋势, 表明对虾对于盐度胁迫的初步适应, 而48 h之后对虾存活率维持稳定也证明了这一点。
在观察到对虾抗氧化能力的增强的同时, 我们也发现了对虾体色的减弱。经过盐度胁迫后, 3个处理组中对虾的体色均大幅度减弱了, 同时检测到肝胰腺和虾壳中虾青素含量的减少(图4b、4c), 尤其在虾壳中, 与胁迫前相比, d-AST和p-AST处理组中虾青素含量均显著减少(0.05), p-AST处理组中甚至减少了52.9%。相比之下, 肝胰腺中虾青素含量虽然也减少了, 但均不显著(>0.05)。因此, 我们推测, 在经过胁迫后对虾体内免疫激活的过程中, 对虾体内发生了虾青素的重新分配, 用于着色部分的虾青素转向了抗氧化功能。这与FAIVRE等[15]在雄性欧洲黑鸟中进行的实验具有相似的结果, 在色素沉着过程的任何阶段, 个体可以改变用于着色的色素的数量进行代谢转化[34]。
对虾体内虾青素的转运是通过β-1, 3-葡聚糖结合蛋白(βGBP-HDL)进行的[35-36], 参照李晓华[23]的方法对基因的表达进行了检测, 结果表明d-AST和p-AST处理组中肝胰腺中的基因在24 h时均表现出了极高水平的表达, 分别达到对照组的97倍和145倍, 这表明在胁迫过程中, 大量βGBP-HDL被合成, 而虾壳中的虾青素也通过βGBP-HDL转运到肝胰腺中参与抗氧化。p-AST处理组中极高的基因表达水平也与之相关, 相比于d-AST处理组, p-AST处理组在强化阶段后在虾壳中拥有更高的虾青素水平, 然而在胁迫阶段后却含有更少的虾青素, 大量的虾壳中的虾青素被转运到肝胰腺中, 由此可见, p-AST处理组更多地依靠虾壳中的虾青素, 而d-AST处理组的肝胰腺中虾青素消耗更多, 这或许与两种形式虾青素的沉积的组织偏好性有关。p-AST处理组的对虾主要依靠虾壳中转运的虾青素发挥抗氧化作用, 因此需要消耗更多的时间, 这也能解释为什么p-AST处理组中抗氧化基因的表达变化相比于d-AST处理组更滞后。与虾壳相比, 肝胰腺中的虾青素的消耗则少得多。据此, 我们推测对虾体内的虾青素是按照资源权衡的原则在着色和抗氧化功能中进行分配的, 在遭受环境变化产生的胁迫时, 对虾会优先将用于着色部分的虾青素(虾壳中)转运至肝胰腺中参与抗氧化, 进而表现为体色的减弱和抗氧化能力的上升。
4 结论
不同来源和构型的虾青素在不同组织中的沉积具有偏好性, 植物源(酯化型)虾青素在肝胰腺中具有更高的沉积量; 而由合成(游离)虾青素在虾壳中具有更高的沉积量。
对虾体内的虾青素是按照资源权衡的原则在着色和抗氧化功能中进行分配的, 在遭受环境胁迫时, 对虾会优先将用于着色部分的虾青素(虾壳中)转运至肝胰腺中参与抗氧化, 进而表现为体色的减弱和抗氧化能力的上升。
[1] SCHOLTHOF K G. The disease triangle: pathogens, the environment and society[J]. Nature Reviews Microbiology, 2007, 5: 152-156.
[2] CHOUBERT G, CRAVEDI J, LAURENTIE M. Effect of alternate distribution of astaxanthin on rainbow trout () muscle pigmentation[J]. Aquaculture, 2009, 286: 100-104.
[3] DOOLAN B J, BOOTH M A, ALLAN G L, et al. Effects of dietary astaxanthin concentrations and feeding period on the skin pigmentation of Australian snapper(Bloch and Schneider, 1801)[J]. Aquaculture Research, 2008, 40: 60-68.
[4] WADE N M, BUDD A, IRVIN S, et al. The combined effects of diet, environment and genetics on pigmentation in the giant tiger prawn,[J]. Aquaculture, 2015, 449: 78-86.
[5] FLORES M, DIAZ F, MEDINA R, et al. Physiological, metabolic and haematological responses in white shrimp(Boone) juveniles fed diets supplemented with astaxanthin acclimated to low-salinity water[J]. Aquaculture Research, 2007, 38: 740-747.
[6] NIU J, TIAN L X, LIU Y J, et al. Effect of dietary Astaxanthin on growth, survival, and stress tolerance of postlarval shrimp,[J]. Journal of the World Aquaculture Society, 2009, 40(6): 795-802.
[7] WANG H, DAI A, LIU F, et al. Effects of dietary astaxanthin on the immune response, resistance to white spot syndrome virus and transcription of antioxidant enzyme genes in Pacific white shrimp[J]. Iranian Journal of Fisheries Sciences, 2015, 14: 699-718.
[8] PLAISTOW S J, ST CLAIR J J, GRANT J, et al. How to put all your eggs in one basket: empirical patterns of offspring provisioning throughout a mother’s lifetime[J]. The American Naturalist, 2007, 170(4): 520-529.
[9] BRITTON G, LIAAEN-JENSEN S, PFANDER H. Carotenoids: Volume 4: Natural Functions[M]. Basel: Birkhäuser Basel, 2008: 213-236.
[10] WEAVER R J, KOCH R E, HILL G E. What maintains signal honesty in animal colour displays used in mate choice?[J]. Philosophical Transactions of the Royal Society B-Biological Sciences, 2017, 372: 1724.
[11] BAETA R, FAIVRE B, MOTREUIL S, et al. Carotenoid trade-off between parasitic resistance and sexual display: an experimental study in the blackbird () [J]. Proc Biol Sci, 2008, 275(1633): 427-434.
[12] AGUILERA E, AMAT J A. Carotenoids, immune response and the expression of sexual ornaments in male greenfinches ()[J]. Naturwissenschaften, 2007, 94(11): 895-902.
[13] VINKLER M, ALBRECHT T. Carotenoid maintenance handicap and the physiology of carotenoid-based signalisation of health[J]. Naturwissenschaften, 2010, 97(1): 19-28.
[14] CLOTFELTER E D, ARDIA D R, McGRAW K J. Red fish, blue fish: trade-offs between pigmentation and immunity in[J]. Behavioral Ecology, 2007, 18(6): 1139-1145.
[15] FAIVRE B, GRÉGOIRE A, PRÉAULT M, et al. Immune activation rapidly mirrored in a secondary sexual trait[J]. Science, 2003, 300(5616): 103.
[16] 贺争鸣. 实验动物管理与使用指南[M]. 北京: 科学出版社, 2016. HE Zhengming. Guidelines for management and use of laboratory animals[M]. Beijing: Science Press, 2016.
[17] MAOKA T. Carotenoids in marine animals[J]. Mar Drugs, 2011, 9(2): 278-293.
[18] LI J, ZHU D, NIU J, et al. An economic assessment of astaxanthin production by large scale cultivation of[J]. Biotechnology Advances, 2011, 29(6): 568-574.
[19] NOGUEIRA N, CANADA P, CABOZ J, et al. Effect of different levels of synthetic astaxanthin on growth, skin color and lipid metabolism of commercial sized red porgy ()[J]. Animal Feed Science and Technology, 2021, 276.
[20] ISO. 11664-4-2008E. Colorimetry[S]. Switzerland: International Organization for Standardization, 2008.
[21] CIFUENTES A S, GONZ’ALEZ M A, VARGAS S, et al. Optimization of biomass, total carotenoids and astaxanthin production inflotow Strain Steptoe (Nevada, USA) under laboratory conditions[J]. Biol Res, 2003, 36 (3/4): 343-357.
[22] 韩丝银. 环境胁迫对凡纳滨对是肝肠功能影响的机制及应用[D]. 青岛: 中国科学院海洋研究所, 2018. HAN Siyin. Mechanism and application of effects of environmental stress on the hepatopancreas and intestine function of[D]. Qingdao: The Institute of Oceanology, Chinese Academy of Sciences, 2018.
[23] 李晓华. 中国明对虾双功能分子β-1, 3-葡聚糖结合蛋白—脂蛋白的研究[D]. 南昌: 南昌大学, 2008. LI Xiaohua. Study on the β-1, 3-glucan-binding protein- Lipoprotein in the Shrimp[D]. Nanchang: Nanchang University, 2008.
[24] MANSOUR A T, ASHOUR M, ABBAS E M, et al. Growth performance, immune-related and antioxidant genes expression, and gut bacterial abundance of pacific white leg shrimp,, dietary supplemented with natural astaxanthin[J]. Front Physiol, 2022, 13: 874172.
[25] PAN C H, CHIEN Y H, HUNTER B. The resistance to ammonia stress ofFabricius juvenile fed diets supplemented with astaxanthin[J]. Journal of Experimental Marine Biology and Ecology, 2003, 297: 107-118.
[26] CHEN Y H, PAN C H, HUNTER B. The resistance to physical stresses byjuveniles fed diets supplemented with astaxanthin[J]. Aquaculture, 2003, 216(1/4): 177-191.
[27] NORIHIKE MISAWA. Carotenoids: Biosynthetic and biofunctional approaches preface and introduction[M]. Japan, Ishikawa: Research Institute for Bioresources and Biotechnology Ishikawa Prefectural University, 2021.
[28] CHAYEN N E, CIANCI M, GROSSMANN J G, et al. Unravelling the structural chemistry of the colouration mechanism in lobster shell[J]. Acta Crystallogr D Biol Crystallogr, 2003, 59: 2072-2082.
[29] ARREDONDO-FIGUEROA J L, PEDRO-ISLAS R, PONCE-PALAFOX J T, et al. Pigmentation of pacific white shrimp (, Boone 1931) with esterified and saponified carotenoids from red chili () in comparison to astaxanthin[J]. Revista Mexicana de Ingeniería Química, 2003, 2: 101-108.
[30] BABIN A, SACIAT C, TEIXEIRA M, et al. Limiting immunopathology: Interaction between carotenoids and enzymatic antioxidant defences[J]. Dev Comp Immunol, 2015, 49(2): 278-281.
[31] FRANZELLITTI S, FABBRI E. Differential HSP70 gene expression in the Mediterranean mussel exposed to various stressors[J]. Biochemical and Biophysical Research Communications, 2005, 336(4): 1157-1163.
[32] JIANG W D, LIU Y, HU K, et al. Copper exposure induces oxidative injury, disturbs the antioxidant system and changes the Nrf2/ARE (CuZnSOD) signaling in the fish brain: Protective effects of myo-inositol[J]. Aquatic Toxicology, 2014, 155: 301-313.
[33] SHEIKHZADEH N, TAYEFI-NASRABADI H, OUSHANI A K, et al. Effects ofsupplementation on antioxidant system and metabolism in rainbow trout ()[J]. Fish Physiol Biochem, 2012, 38(2): 413-419.
[34] HILL G E, MONTGOMERIE R, INOUYE C Y, et al. Influence of dietary carotenoids on plasma and plumage color in the house finch-intrasexual and intersexual variation[J]. Functional Ecology, 1994, 8(3): 343-350.
[35] AAS G H, BJERKENG B, STOREBAKKEN T, et al. Blood appearance, metabolic transformation and plasma transport proteins of (14)C-astaxanthin in Atlantic salmon (L.)[J]. Fish Physiology and Biochemistry, 1999, 21(4): 325-334.
[36] 李晓华, 王宝杰, 王雷, 等. 对虾血淋巴脂蛋白的生化特征及分子克隆研究进展[J]. 海洋科学, 2008, 32(11): 80-83. LI Xiaohua, WANG Baojie, WANG Lei, et al. Biochemical characteration and molecular cloning of penaeid shrimp hemolymph lipoproteins[J]. Marine Sciences, 2008, 32(11): 80-83.
Resource tradeoff between coloring and antioxidation of astaxanthin inunder salinity stress
YANG Meng-xuan1, 3, WANG Bao-jie1, 2, LIU Mei4, JIANG Ke-yong1, 2, ZHONG Chen4, WANG Lei1, 2, 3
(1. CAS and Shandong Province Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4.Aquatic Organisms Quality Evaluation and Utilization Engineering Research Center, Marine Science Research Institute of Shandong Province, Qingdao 266104, China)
The environmental pressure generated by industrial culture causes stress and weakening of the body color of the shrimp. Our results show that astaxanthin (d-AST) and synthetic astaxanthin (p-AST) contents in the hepatopancreas of shrimps treated with astaxanthin increased by 48.0% and 17.5%, respectively, compared with those who were not treated with any form of astaxanthin. Astaxanthin content in shrimp shells increased by 42.8% and 45.2%, respectively. d-AST rich in esterified astaxanthin was deposited in high amounts in the hepatopancreas, whereas p-AST composed of free astaxanthin was deposited in high amounts in the shell. Different tissues had preferences for different forms of astaxanthin. The body color of shrimps in the two treatment groups was significantly enhanced. Astaxanthin content in hepatopancreas of d-AST and p-AST decreased by 15.1% and 5.7% after applying salinity stress, respectively, whereas its content in the control group remained unchanged. Astaxanthin content in shrimp shells of d-AST, p-AST and control group significantly decreased by 17.8%, 52.9%, and 14.3%, respectively. The expression of the gene encoding the astaxanthin transporter β-1, 3-glucan-binding protein (βGBP-HDL) was significantly upregulated after 24 h of stress, which may reduce astaxanthin content in the shrimp shell. A simultaneous upregulation in the expression of antioxidant genes with the progression of stress was observed in the two treatment groups compared with the control group. The antioxidant capacity of the groups increased, subsequently decreased, and finally reached the maximum value at 48 h. At 48 h, d-AST and p-AST were 1.35 and 1.30 times that of the control group, respectively. Therefore, we speculate that astaxanthin content in shrimp affects pigmentation and antioxidant functions according to the resource balance principle. Under environmental stress conditions, astaxanthin used for pigmentation (shrimp shell) is preferentially transported to the hepatopancreas to participate in antioxidation, which weakens body color and increases antioxidant capacity.
; astaxanthin; body color; antioxidation
Apr. 12, 2023
[National Natural Science Foundation of China-Joint 322 Fund of Shandong People’s Government, No. U1706209; Yellow River Delta Industry Leading Talent Project; Research Supplement Fund for Marine Science Research Institute of Shandong Province]
S963.14
A
1000-3096(2023)10-0032-11
10.11759/hykx20230412001
2023-04-12;
2023-04-26
国家自然科学基金项目(NSFC-山东联合基金)(U1706209); 黄河三角洲产业领军人才项目; 山东省海洋科学研究院科研补助经费
杨梦煊(1998—), 男, 湖北黄冈人, 硕士研究生, 主要从事凡纳滨对虾营养与免疫学研究, E-mail: yangmx998@163.com; 王雷(1966—),通信作者, 男, 研究员, 主要从事水产动物营养免疫、环境调控、病害防治及水产品安全学研究, E-mail: wanglei@qdio.ac.cn
(本文编辑: 谭雪静)
