SAP患者外周血PINK1/Parkin的表达及与凋亡因子的相关性研究
2024-01-13岑兰英黄秀权王语阳苏拾香覃宗帅甘慧芳覃月秋
岑兰英,黄秀权,王语阳,苏拾香,覃宗帅,甘慧芳,覃月秋
(1. 右江民族医学院附属医院消化内科,广西 百色 533000;2. 右江民族医学院研究生学院,广西 百色 533000)
急性胰腺炎(acute pancreatitis,AP)是临床常见的急症,近年来随着人们生活方式及饮食习惯的改变,我国AP的发病率呈上升趋势。AP起病急,进展迅速,部分患者可发展成重症急性胰腺炎(severe acute pancreatitis,SAP),因其治疗难度大,病死率可高达13%~35%[1]。研究表明,细胞凋亡与SAP的发生发展密切相关[2]。PINK1/Parkin是介导线粒体自噬的重要因子,当疾病引起细胞发生线粒体功能障碍时PINK1/Parkin表达增加,介导的线粒体自噬,发挥抗细胞凋亡作用,但当PINK1/Parkin的表达下降或缺陷时,线粒体自噬障碍,造成线粒体功能失调最终导致细胞结构和功能异常,促进细胞凋亡的发生[3]。细胞色素C(Cyt-C)是线粒体凋亡机制中的关键物质,当线粒体发生损伤时,Cyt-C可大量进入细胞质中,引起细胞凋亡[4-6]。Caspase-3是细胞质内凋亡信号传导途径的关键效应分子,Caspase-3水平升高提示凋亡系统的异常激活[7]。目前PINK1/Parkin在SAP患者外周血中的表达情况尚不清楚,其对SAP患者细胞凋亡的作用尚不明确,本研究通过检测SAP患者外周血PINK1/Parkin mRNA的表达,与正常对照组、MAP组、MSAP组对比,并分析SAP患者外周血PINK1/Parkin对细胞凋亡因子Cyt-C、Caspase-3表达的影响,为阐明SAP细胞凋亡机制提供理论依据。
1 资料与方法
1.1一般资料 收集2022年10月至2023年9月右江民族医学院附属医院住院治疗的64例AP患者资料,其中22例轻症急性胰腺炎(mild acute pancreatitis, MAP)、20例中度重症急性胰腺炎(moderately severe acute pancreatitis, MSAP)、22例重症急性胰腺炎(severe acute pancreatitis, SAP),同时选取本院同期健康体检者24例作为健康对照组,4组的一般资料比较,差异无统计学意义(P>0.05),AP诊断及严重程度分级标准符合《中国急性胰腺炎诊治指南(2021)》,器官功能障碍的诊断标准基于改良Marshall评分系统。入选病例均排除恶性肿瘤、脑部疾病、心血管疾病、肝肾疾病、自身免疫性疾病、血液系统疾病、感染类疾病、妊娠期、哺乳期等,本研究经医院医学伦理委员会批准,受试者签署知情同意书。
1.2主要试剂与仪器 人Cyt-C(CSB-E08530h-96T)、Caspase-3(CSB-E08856h-96T)、ELISA试剂盒购于武汉华美生物工程有限公司,TRIzol Reagent购于美国invitrogen 公司,三代逆转录预混液(含dsDNase)(MR05101M)购于莫纳(武汉)生物科技有限公司,qPCR SYBR○RGreen Master Mix(NoRox)(11201
ES08)购于上海翊圣生物科技有限公司。仪器使用普通PCR仪、荧光定量PCR仪、全自动酶标仪 (Thermofis,美国)。
1.3方法
1.3.1收集样本 收集患者的一般资料(年龄、性别)。所有AP患者外周血于入院后24 h内收集,5 mL抗凝外周血常温下离心15 min(3 000 r/min),收集最下层血细胞转接到1.5 mL无菌离心管。将所收集最下层血细胞于离心机离心15 min(4 ℃,12 000 r/min),吸除上层澄清液,将所得血细胞以每管500 μL分别装于无菌离心管中,置于-80 ℃保存,用于检测PINK1、Parkin mRNA表达。5 mL促凝外周血用离心机离心10 min(常温,4 000 r/min),收集上清液,分装置于-80 ℃保存,用于检测血清Cyt-C、Caspase-3蛋白水平,待收集完毕后统一检测。
1.3.2外周血细胞qPCR检测 采用RT-q PCR检测各组外周血细胞中PINK1、Parkin mRNA相对表达量。按照RNA试剂盒说明书对各组外周血细胞提取总RNA,用紫外分光光度计测量RNA浓度、OD260、OD280,使用反转录试剂盒按说明书方法反转录得到cDNA,使用2 μL cDNA配置20 μL的反应体系,应用SYBR Green Master Mix扩增上述cDNA,使用LightCycler○RR96qPCR仪进行检测。选取GAPDH为内参,引物由南宁捷尼斯生物科技有限公司提供,引物序列为,H-PINK1-F:5′-GCCTACATTGCCCCAGAACC-3′,H-PINK1-R:5′-TGGAGGAACCTGCCGAGAT-3′;H-Parkin-F:5′-TTTTCCTAACTGCCTAAGATAACCC-3′,H-Parkin-R:5′-TGTCACAGGTCTGTTGTCACCGT-3′;H-GAPDH-F:5′-GGTGAAGCAGGCGTCGGA-3′,H-GAPDH-R:5′-GGAGTGGGTGTCGCTGTTGA-3′。所有样品均设3个复孔,采用2-△△Ct法计算PINK1、Parkin mRNA相对表达量。
1.3.3ELISA检测 采用ELISA法检测样本血清Cyt-C、Caspase-3含量,ELISA检测的具体步骤严格按说明书进行,采用全自动酶标仪 (Thermofis,美国) 进行结果判定。
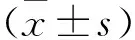
2 结果
2.1一般资料分析 各组性别、年龄差异无统计学意义(P>0.05),见表1。各组器官功能障碍情况及改良Marshall评分,见表2。

表1 各组性别、年龄一般资料分析结果
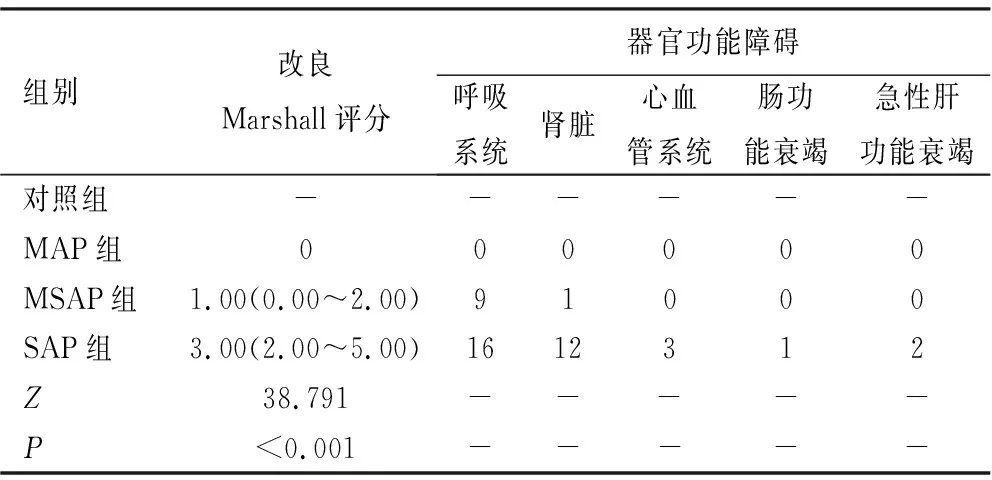
表2 各组器官功能障碍情况及改良Marshall评分
2.2各组PINK1 mRNA、Parkin mRNA相对表达水平 与正常对照组、MAP组、MSAP组比较,SAP组外周血细胞PINK1 mRNA、Parkin mRNA 表达明显下降(P<0.05),正常对照组、MAP组、MSAP组组间两两比较,PINK1 mRNA及Parkin mRNA表达差异无统计学意义(P>0.05)。见表3、图1。
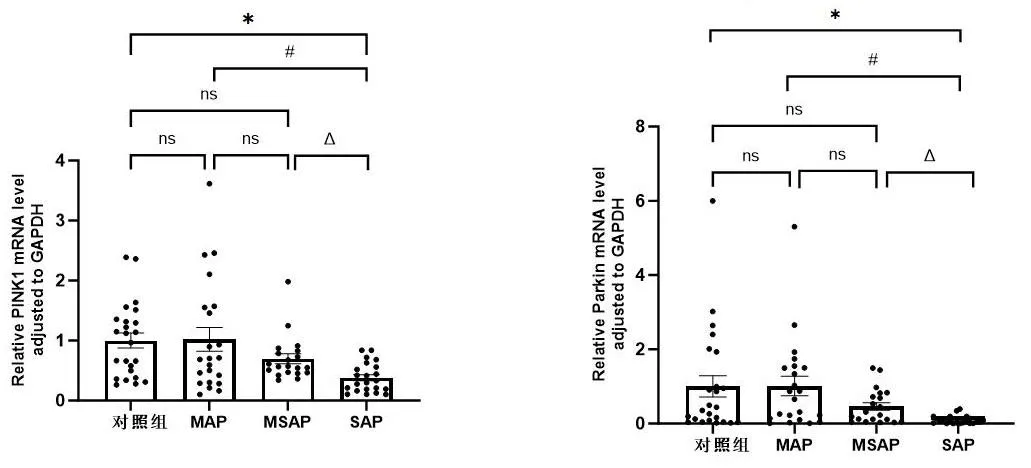
注:与正常对照组比较,*P<0.05;与MAP组比较,#P<0.05;与MSAP组比较,△P<0.05。图1 AP患者外周血PINK1 mRNA、Parkin mRNA相对表达量
2.3各组血清Cyt-C、Caspase-3水平比较 与对照组比较,MAP、MSAP、SAP组血清Cyt-C、Caspase-3水平升高(P<0.05),与MAP组比较,MSAP、SAP组血清Cyt-C、Caspase-3水平升高(P<0.05),与MSAP组比较,SAP组血清Cyt-C水平升高(P<0.05),Caspase-3水平升高,但差异无统计学意义。见表4、图2。

注:A.血清Cyt-C水平及组间比较;B.血清Caspase-3水平及组间比较。与正常对照组比较,*P<0.05;与MAP组比较,#P<0.05;与MSAP组比较,△P<0.05。图2 各组血清Cyt-C、Caspase-3水平

表4 各组血清Cyt-C、Caspase-3水平
2.4SAP组PINK1 mRNA、Parkin mRNA表达与血清Cyt-C、Caspase-3水平的相关性 SAP组PINK1 mRNA与血清Cyt-C、Caspase-3呈负相关(rs=-0.909,P<0.001;rs=-0.905,P<0.001);Parkin mRNA与血清Cyt-C、Caspase-3呈负相关(rs=-0.618,P<0.05;rs=-0.664,P<0.001)。见图3。
2.5SAP组血清Cyt-C与Caspase-3水平的相关性 SAP组血清Cyt-C与Caspase-3水平呈正相关(rs=0.916,P<0.001)。见图4。
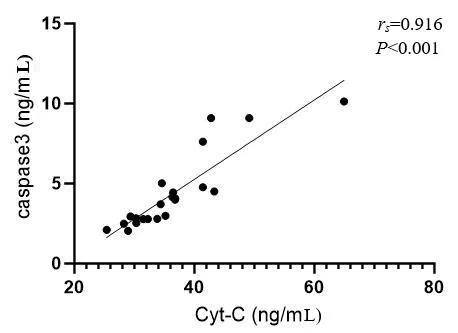
图4 SAP组血清Cyt-C与Caspase-3水平的相关性
3 讨论
SAP是AP病情发展严重的阶段,病死率可高达13%~35%[1]。研究发现,细胞凋亡与SAP发生发展密切相关[2]。目前认为参与SAP细胞凋亡的机制主要包括:①Fas/FasL与死亡受体凋亡通路;②Bcl-2家族与线粒体通路;③钙离子与内质网凋亡通路;④其他参与细胞凋亡的调控因子,如转录因子NF-КB、外源性过氧化氢、外源性HMGB1等[2]。其中线粒体通路是调控SAP细胞凋亡的重要途径,活性氧(reactive oxygen species,ROS)的释放、Ca2+超载引起线粒体跨膜电位改变,发生线粒体去极化,随后引起的Cyt-C的释放是细胞凋亡的中心环节[8]。在这过程中,ROS的释放、Ca2+超载等刺激引起的线粒体损伤可诱导线粒体自噬激活,发挥细胞稳态调节功能。
PINK1/Parkin是介导线粒体自噬的重要因子,当细胞发生线粒体功能障碍时PINK1/Parkin表达增加,介导线粒体自噬,抑制细胞凋亡,修复线粒体功能;但当PINK1/Parkin的表达下降或缺陷时,线粒体自噬障碍,造成线粒体功能失调,促进细胞凋亡的发生。目前研究表明,AP中腺泡细胞、外周血单个核细胞、血小板均存在线粒体功能障碍[9-11]。研究发现,SAP中PINK1/Parkin介导的通路参与胰腺细胞的线粒体自噬,且随着严重程度增加,PINK1/Parkin介导的线粒体自噬受到抑制[12]。而SAP患者外周血中PINK1/Parkin的表达及作用分析少有报道,本研究发现与正常对照组、MAP组、MSAP组比较,SAP组外周血细胞PINK1 mRNA、Parkin mRNA 表达明显下降,提示SAP患者外周血的线粒体自噬可能受到抑制。而正常对照组、MAP组、MSAP组两两比较,PINK1及Parkin mRNA表达差异无统计学意义。在AP发生的第一阶段,炎症介质引起的线粒体损伤可通过线粒体自噬进行线粒体稳态调节,但随着病情的加重,炎症介质的大量释放,线粒体损伤加重,线粒体自噬出现异常,线粒体自噬受到抑制,损伤线粒体出现堆积,并释放出大量ROS、Cyt-C,进而加重细胞损伤,促进细胞凋亡。
Cyt-C 是线粒体呼吸链上的重要组成成分,当线粒体膜结构发生损伤时,Cyt-C从线粒体内释放到胞质中,并作为重要的促凋亡因子,激活Caspase-9,然后进一步激活下游的Caspase-3,启动Caspases的级联反应,最终导致细胞凋亡的发生[13]。细胞凋亡过程发生的核心过程是Caspase酶原的活化。其中Caspase-3作为凋亡执行者其作用尤为重要,它的活化是凋亡进入不可逆阶段的标志[7]。朱绍华等[14]的研究表明血清Caspase-3水平在AP患者中升高,且与病情严重程度呈正相关。本研究发现,与正常对照组比较,MAP、MSAP、SAP组血清Cyt-C、Caspase-3水平升高,提示AP患者外周血中存在线粒体损伤相关性凋亡;与MAP组比较,MSAP、SAP组血清Cyt-C、Caspase-3水平升高,提示随着严重程度的增加,其凋亡的程度增加,本研究结果与朱绍华等[14]的研究结果一致。在SAP患者中,持续存在的器官功能障碍及感染诱导细胞凋亡,导致凋亡相关因子持续消耗,可能是Caspase-3在MSAP组、SAP组中差异不明显的原因。
研究发现SAP中PINK1/Parkin参与介导胰腺细胞的线粒体自噬,随着严重程度的增加,SAP的线粒体自噬受到抑制,在PINK1和PARK2基因敲除模型中,发现线粒体途径的凋亡细胞显著增加[12]。另有研究证实抑制PINK1-Parkin线粒体自噬导致创伤性脑损伤小鼠皮层神经细胞线粒体凋亡信号显著增加,PINK1-Parkin表达降低可导致Caspase-3等凋亡相关因子表达升高[15]。为了解SAP患者外周血线粒体自噬因子PINK1/Parkin与细胞凋亡因子表达的相互关系,本研究进行了相关性分析,结果显示PINK1 mRNA、Parkin mRNA与血清Cyt-C、Caspase-3均呈负相关。提示在SAP患者外周血中,线粒体自噬因子PINK1/Parkin表达越低,Cyt-C、Caspase-3表达越高,线粒体损伤相关性凋亡发生的程度越高,PINK1/Parkin可能通过负向调控Cyt-C、Caspase-3表达调节SAP细胞凋亡,本研究结果与前人研究结果一致。
为了进一步了解SAP线粒体损伤与细胞凋亡的关系,本研究还进行Cyt-C与Caspase-3相关性分析,结果提示Cyt-C与Caspase-3呈正相关,且相关性较强,说明Cyt-C对Caspase-3的激活产生了一定的作用。细胞凋亡是细胞的主动死亡过程,当胰腺炎发生时,炎症反应及代谢紊乱使细胞内的线粒体、内质网等细胞器发生功能障碍,各类细胞器首先进行融合、自噬等发挥细胞保护作用,但当细胞器稳态调节出现异常,细胞将通过凋亡的方式进行自我保护,以阻止病情进一步发展。因此当SAP中PINK1/Parkin表达下降,线粒体自噬受到抑制时,机体将通过增加细胞凋亡的方式进行自我保护。
综上所述,SAP患者外周血PINK1、Parkin表达降低且与凋亡因子表达水平升高有关,可能是SAP患者细胞凋亡增加的原因,为SAP的诊治靶点提供新的理论依据。
