固定化海洋脱氮假弧菌转氨酶实现可循环生物催化*
2024-01-12邵小芙
邵小芙,果 波,高 嵩,曹 阳
(江苏海洋大学 a.药学院; b.江苏省海洋药物活性分子筛选重点实验室,江苏 连云港 222005)
近年来,随着科学技术的发展与研究手段的丰富,陆地生物得以被广泛且更为深入地研究[1]。较之于陆地,海洋资源占据着全球面积的70%,且存在较为极端的生存环境,生物随之进化出可适应不同环境的生存能力[2-3]。随着对海洋研究的深入,一些结构新颖且具有独特生物活性的活性物质逐渐为人们所关注[4-5]。在对维系海洋生物生命活动的酶作用的探索中,由于生存环境的选择及限制,一些被挖掘的酶呈现出特殊的活性作用,如较高的渗透压承受能力及高盐溶液下的稳定性[6]。
海洋脱氮假弧菌ω-转氨酶区别于以往发现的大多数转氨酶,在其催化位点的远端手性中心同样具有立体识别能力[7],这种能力在转氨酶的报道案例中是极为罕见的[8],即使是少数存在第二位点选择能力的转氨酶,也更多是在靠近催化位点进行识别[9-10]。海洋脱氮假弧菌ω-转氨酶的远端(S)-型手性中心选择催化能力被Gavin等进行多底物深入研究,测试结果表明这种具有特殊催化活性的转氨酶可在以1-四氢萘胺和1-氨基茚满为胺基供体的转胺反应中发挥高效活性,并且可实现远端手性中心的识别与催化,生成的酮类产物对映体过量值可高达93%[7]。海洋脱氮假弧菌ω-转氨酶的远端(S)-型手性中心选择能力同样可以识别拆分抗抑郁药物舍曲林关键中间体[11]。经海洋脱氮假弧菌ω-转氨酶中间体拆分可简化舍曲林的合成工艺[12]。
但酶材料的制备工艺较为复杂,使用时易造成较差的稳定性,且无法实现持续性使用,导致大规模生产应用成本较高。固定化工艺是上述问题的有效解决途径。经固定化的酶相较于游离酶具备更强的稳定性及环境抗压能力,且固定化后的酶可克服游离酶无法回收利用的缺点,降低生产成本[13]。现有的吸附法[14]、交联法[15]、包埋法[16]、载体共价结合法[17]等主要固定化工艺由于非精细化固定方式的限制,往往会造成一定的酶活性损失。
噬菌体展示技术自20世纪90年代被开发应用以来[18],已成功应用于多种病毒疫苗作为展示载体[19]。T4噬菌体是一种T-偶数型裂解性细菌侵染病毒噬菌体,由头部、尾部及尾丝三部分构成[20]。T4噬菌体头部由主要衣壳蛋白gp23及次要衣壳蛋白gp24组成衣壳骨架。Hoc(高抗原性外衣壳蛋白)及Soc(小外衣壳蛋白)为二十面体形状的衣壳上附加结合蛋白。由于Hoc及Soc蛋白与T4噬菌体衣壳之间以可分离及高生物亲和的方式结合,外源肽段及蛋白序列被允许与其融合从而展示在T4噬菌体衣壳的结合位点[19]。本研究建立以T4噬菌体衣壳为固定化系统,采取亲和固定化工艺构建海洋脱氮假弧菌ω-转氨酶的精细化生物材料固定化体系,以期实现酶活的高效保留回收。
1 材料与方法
1.1 材料及试剂
海洋脱氮假弧菌ω-转氨酶质粒及融合蛋白扩增引物由通用生物(安徽)股份有限公司合成,Taq PCR扩增酶、高保真酶、PCR产物纯化试剂盒购自莫纳生物科技有限公司,NdeⅠ内切酶试剂盒、Hind Ⅲ内切酶试剂盒购自江苏愚公生物科技有限公司,大肠杆菌DH5ɑ感受态细胞、BL21(DE3)pLysS感受态细胞、BL21(DE3)-RIPL感受态细胞购自北京全式金生物技术有限公司,细菌蛋白抽提试剂盒购自康为世纪生物科技有限公司,(S)-ɑ-甲基苄胺、5′-磷酸吡哆醛、丙酮酸钠、乙腈购自上海麦克林生化科技股份有限公司。
1.2 仪器及设备
AKTA蛋白纯化系统,英国GE Healthcare公司;Centrifuge 5424R高速冷冻离心机,德国Eppendorf股份公司;低温超高压连续流破碎机,广州聚能纳米生物科技股份有限公司;岛津LC-20型高效液相色谱仪,日本岛津公司;PCR热循环仪器,伯乐生命医学产品有限公司;迷你金属浴,杭州米欧仪器有限公司;蓝光速射仪,北京诺禾致源科技股份有限公司;生化培养箱,上海博讯实业有限公司医疗设备厂;微量分光光度计,赛默飞世尔科技公司。
1.3 Soc位于海洋脱氮假弧菌ω-转氨酶N端的融合蛋白设计
将包含海洋脱氮假弧菌ω-转氨酶的大肠杆菌表达系统pET28a表达载体转入至DH5ɑ感受态细胞中复制,使用无缝克隆技术构建Soc位于海洋脱氮假弧菌ω-转氨酶N端的融合蛋白表达序列。以位于海洋脱氮假弧菌ω-转氨酶序列N端的NdeⅠ内切酶识别序列作为切割位点进行载体切割,形成线性化载体;无缝克隆重组技术中Soc片段插入载体所需的载体同源臂通过PCR扩增引物引入,正向引物及反向引物的两端各含一段载体及Soc片段序列。反向引物的载体序列及Soc片段序列之间引入9碱基大小的柔性linker,避免海洋脱氮假弧菌ω-转氨酶及Soc蛋白折叠表达的相互影响,Soc片段扩增正反引物序列见表1。

表1 Soc片段扩增引物序列Table 1 Primer sequence of Soc fragment amplification
1.4 Soc位于海洋脱氮假弧菌ω-转氨酶C端的融合蛋白设计
Soc位于海洋脱氮假弧菌ω-转氨酶C端的融合蛋白表达序列同样以无缝克隆技术构建,选择实验室原有的含有Soc片段的pET28b大肠杆菌表达系统作为构建载体。线性化载体的获得基于Soc片段序列N端存在HindⅢ内切酶识别位点;海洋脱氮假弧菌ω-转氨酶序列插入所需的载体同源臂同使用扩增引物引入,反向引物的载体序列及海洋脱氮假弧菌ω-转氨酶片段序列之间同引入9碱基大小柔性linker,避免海洋脱氮假弧菌ω转氨酶及Soc蛋白折叠表达的相互影响。海洋脱氮假弧菌ω-转氨酶扩增正反引物序列见表2。
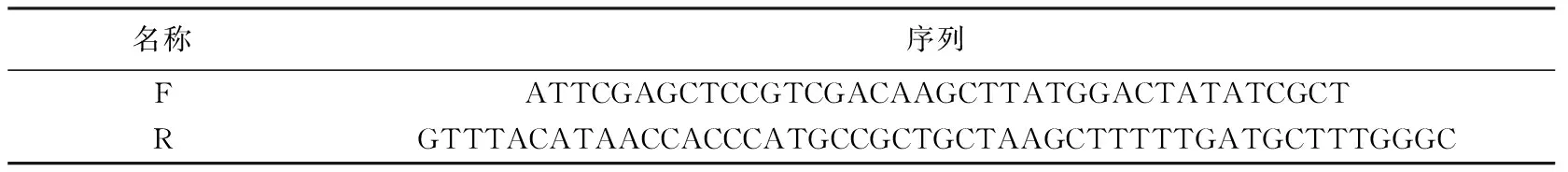
表2 海洋脱氮假弧菌ω-转氨酶片段扩增引物序列Table 2 Primer sequence of marine P. denitrificans ω-transaminase fragment amplification
1.5 Soc与海洋脱氮假弧菌ω-转氨酶重组融合蛋白表达
两种重组融合蛋白首先转入大肠杆菌DH5ɑ感受态细胞进行测序。选取测序结果正确的重组融合蛋白表达质粒转入大肠杆菌RIPL感受态细胞中进行重组体的少量培养表达,对重组融合蛋白的诱导表达温度进行了筛选,选取的温度分别为16 ℃和23 ℃。使用细菌蛋白抽提试剂盒对诱导表达后的细胞进行处理,结果通过10%SDS-PAGE进行可视化观察。
1.6 重组融合蛋白的T4噬菌体衣壳固定化
选取表达情况适宜的重组融合蛋白,进行固定化展示。重组酶固定化的反应体积为4 mL,加入酶3.86×10-2μmol,加入T4噬菌体衣壳1.172×10-6μmol,在固定化缓冲液(PI-Mg buffer)环境下孵育1 h,孵育温度为16 ℃。孵育后的反应液经离心收集固定化后的酶,离心转速为15 000 r/min,时间为70 min。用1 mL重组酶储存缓冲液重悬收集到的离心沉淀,清洗未固定化的游离酶,再以15 000 r/min离心70 min收集固定化酶,离心沉淀用100 μL储存缓冲液重悬。
1.7 固定化酶活性评价
固定后的酶活保留是酶固定化效果的一大指征。以(S)-α-甲基苄胺作为氨基供体底物,丙酮酸钠作为氨基受体,测定转氨酶经固定化后的催化活性保留效果。测定条件为反应温度30 ℃,时间1 h。以乙酸乙酯进行产物苯乙酮及残留氨基供体底物的有机相提取,收集的有机相通过TLC进行结果观察。TLC的展开条件为V(石油醚)∶V(乙酸乙酯)=9∶1。
固定化酶的酶活回收效率是固定化效果另一大指征。回收采用的测试底物及条件同酶活测试。加入酶溶液启动催化反应,待达到反应时间,将固定化酶反应体系放置于4 ℃离心机中,在15 000 r/min转速下离心70 min实现固定化酶回收;小心转移离心后的上清反应液于干净的1.5 mL EP管中,向离心沉淀中加入1 mL lysis buffer清洗残留的溶液,小心吸走清洗液,加入100 μL lysis buffer对固定化酶进行重悬,加入至反应液中开启下一轮循环催化反应。循环催化反应共计4组,设置3组平行。经催化的反应液同样以等体积的乙酸乙酯进行有机相萃取。萃取的乙酸乙酯通过高效液相进行检测,高效液相检测波长为254 nm。
2 结果
2.1 Soc与海洋脱氮假弧菌ω-转氨酶重组融合蛋白选择
两种不同诱导表达温度下的融合蛋白呈现出不同的上清融合表达效果。Soc位于海洋脱氮假弧菌ω-转氨酶N端的重组融合蛋白于胶图诱导上清通道中可见清晰明显条带;Soc位于海洋脱氮假弧菌ω-转氨酶C端的重组融合蛋白的诱导上清通道中目的条带几乎不可见,对比图如图1所示。胶图结果表明,Soc位于海洋脱氮假弧菌ω-转氨酶N端的重组融合蛋白上清可溶表达性质更佳,因此选择Soc位于海洋脱氮假弧菌ω-转氨酶N端的重组融合蛋白作为固定化反应使用的融合蛋白。
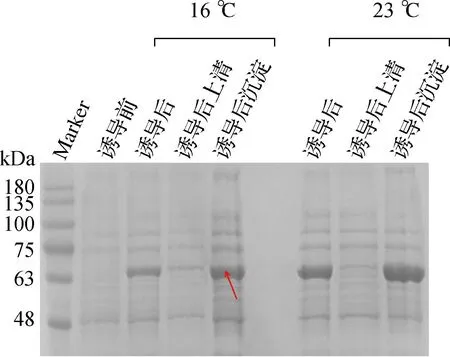
a Soc位于海洋脱氮假弧菌ω-转氨酶N端重组融合蛋白
b Soc位于海洋脱氮假弧菌ω-转氨酶C端重组融合蛋白注:红色箭头所指为重组融合目的蛋白。图1 两种重组融合蛋白上清融合表达可溶性验证Fig.1 Supernatants soluble expression verification of two recombinant fusion protein
2.2 Soc与海洋脱氮假弧菌ω-转氨酶重组融合蛋白表达优化
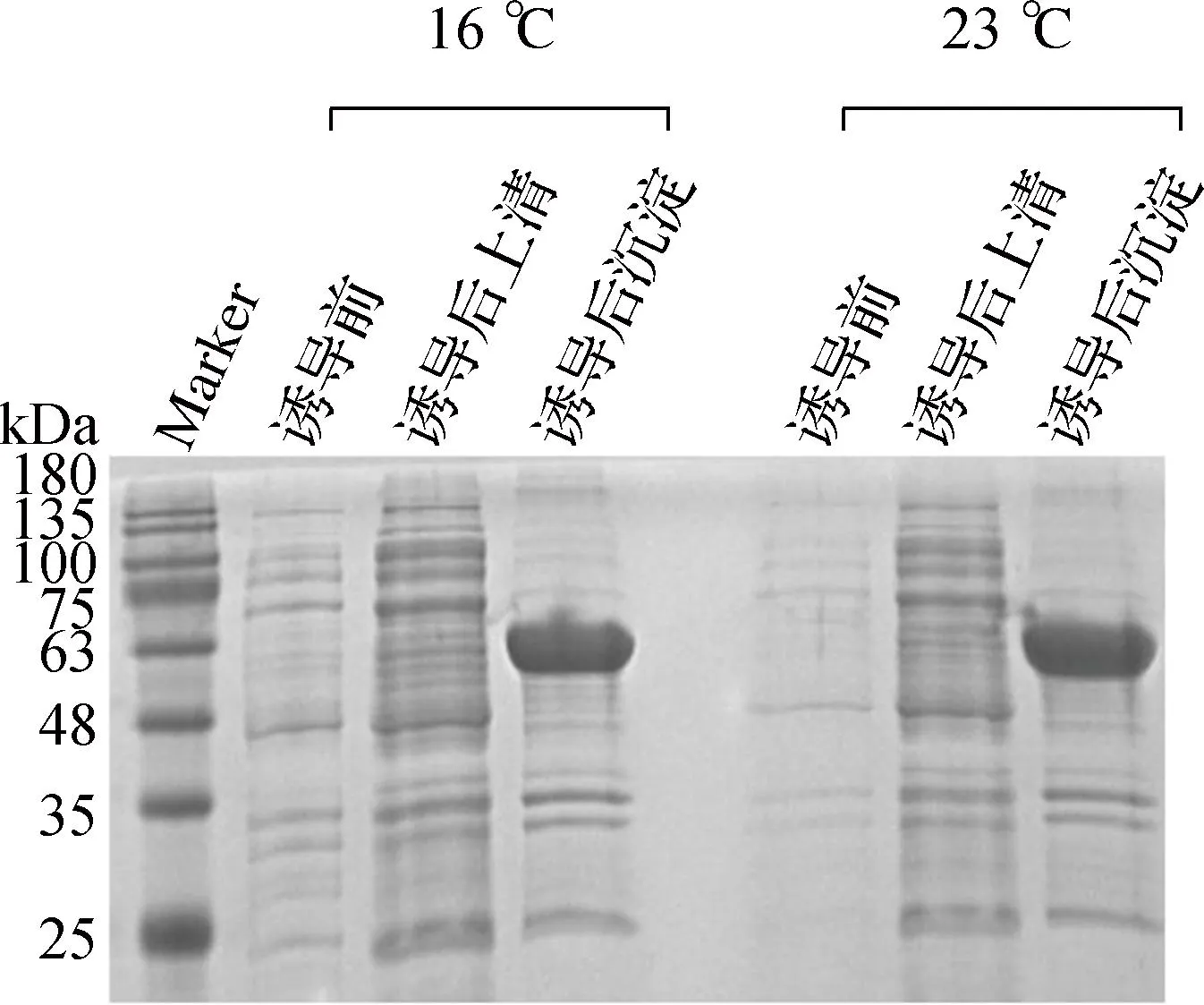
将选择的重组蛋白进行大批量发酵诱导表达发现,上清可溶表达的重组蛋白收率较低,无法满足后续实验的要求,因此需对重组蛋白的上清可溶表达进行优化。本文选择具有较高mRNA稳定性的BL21(DE3)pLysS感受态细胞作为重组蛋白的表达系统进行进一步表达。重组蛋白纯化结果对比胶图如图2所示。从图中可以看出,经BL21(DE3)pLysS感受态细胞表达的重组蛋白上清可溶表达量得到显著提升,可以满足后续实验对于重组蛋白产量的要求。
a 大肠杆菌RIPL感受态表达系统
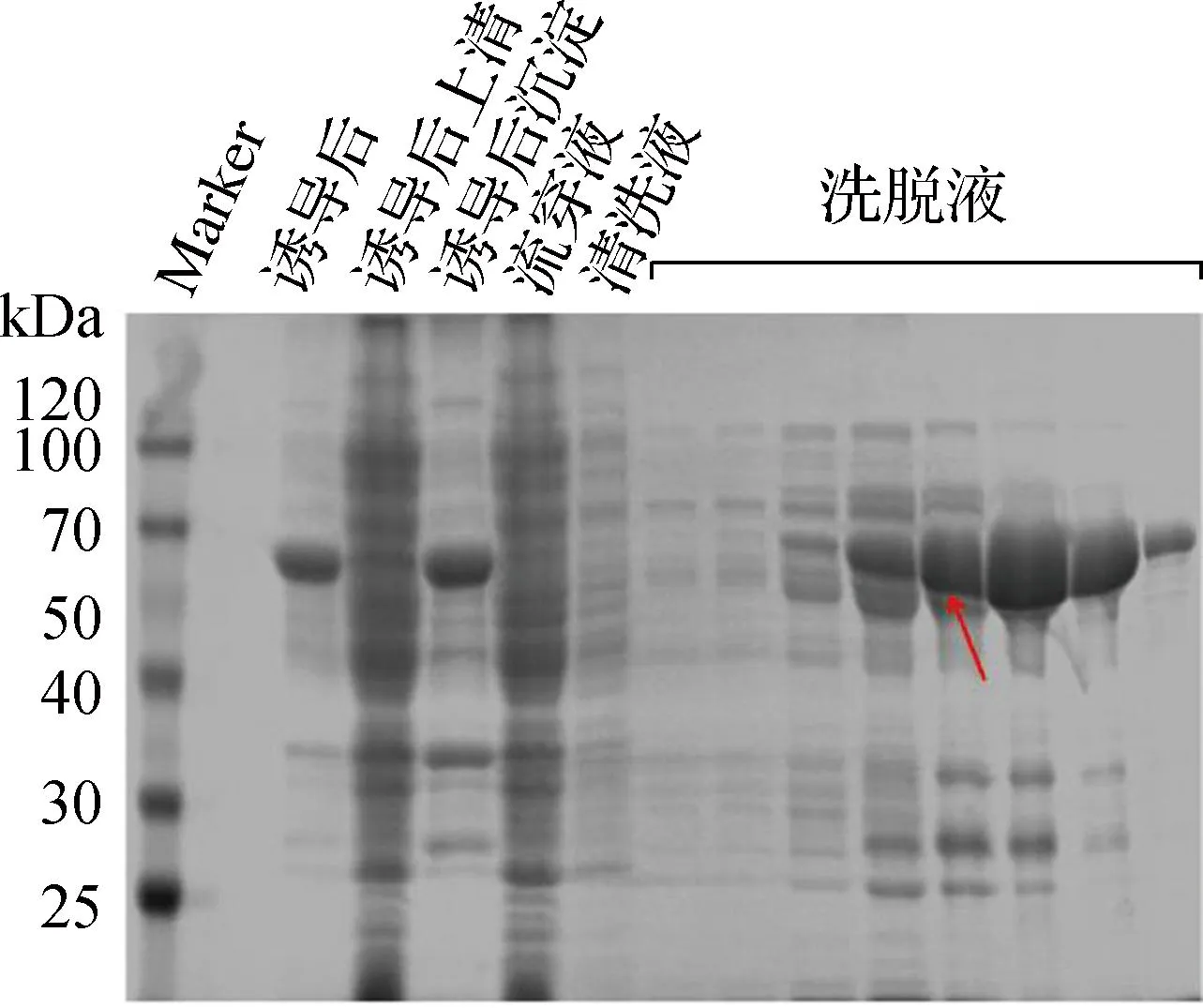
b 大肠杆菌BL21(DE3)pLysS感受态表达系统注:红色箭头指示为目的蛋白。图2 重组融合蛋白上清可溶表达优化前后纯化胶图Fig.2 Purified gel diagram of recombinant fusion protein before and after supernatant soluble expression optimization
2.3 重组融合蛋白位于T4噬菌体衣壳的固定化展示
固定化结果采取SDS-PAGE胶图进行可视化验证,T4噬菌体衣壳中组成数量为930拷贝的主要衣壳蛋白gp23(大小为49 kDa)可作为T4噬菌体存在的判定依据。如图3所示,经固定展示的体系电泳泳道中位于49 kDa附近处存在蛋白条带,证明了gp23蛋白的存在,且T4噬菌体衣壳其他位点处存在的蛋白皆可在固定展示体系电泳泳道中找到与之相对应的条带,验证了固定展示体系中T4噬菌体衣壳的存在。固定展示体系电泳泳道中位于重组融合蛋白大小(62 kDa)位置处的清晰条带证明了固定展示体系中重组融合蛋白的存在。以上结果说明,经重组构建表达的融合蛋白被成功固定于T4噬菌体衣壳的Soc结合位点处。
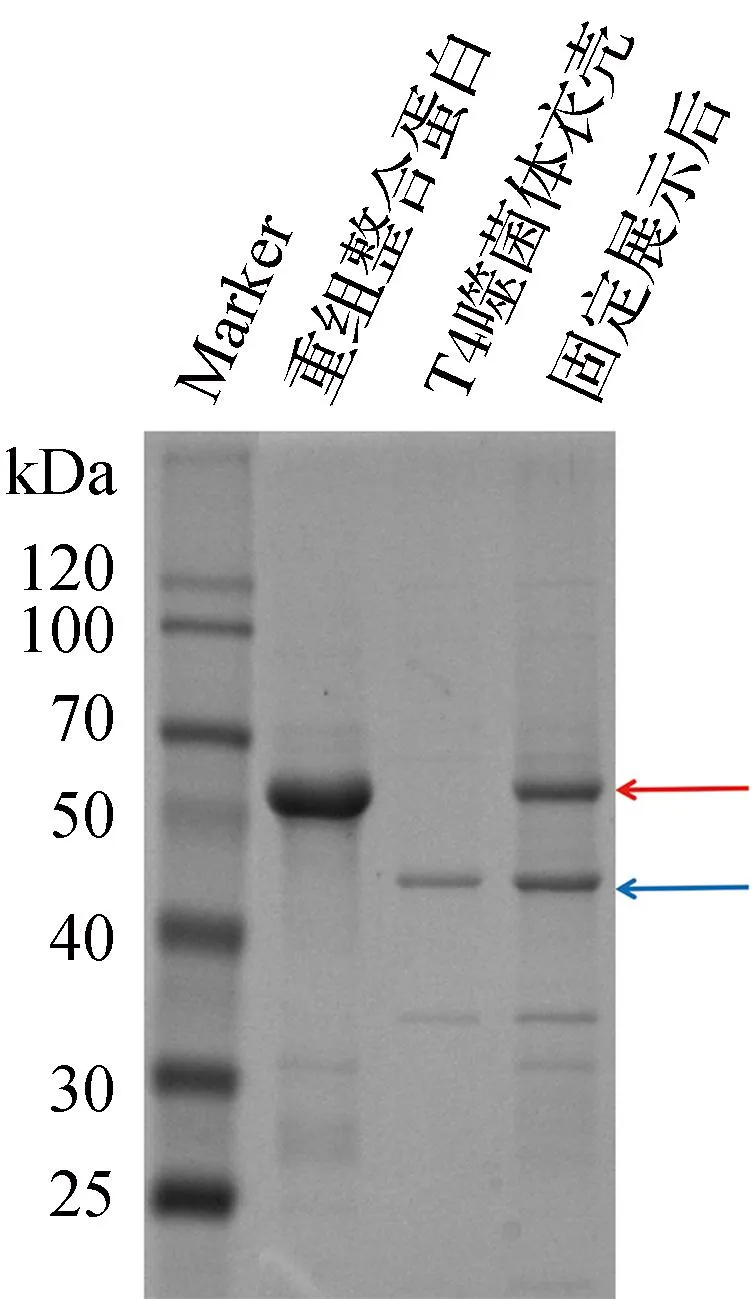
注:红色箭头指示为重组融合蛋白;蓝色箭头指示为T4噬菌体衣壳主要衣壳蛋白gp23。图3 重组融合蛋白与T4噬菌体衣壳固定化展示验证胶图Fig.3 Verified gel map of recombinant fusion protein immobilization with T4 phage capsid
2.4 固定化酶的活性验证
固定化酶催化性能检测的TLC结果如图4所示。游离酶及固定酶的反应体系加入的酶催化溶液的浓度相同,游离酶及固定酶的反应体系中位于产物苯乙酮标准品显影位置处均具有一致的显影产生,两者Rf值相同,且在底物(S)-α-甲基苄胺的检测通道内并无苯乙酮位置处的显影产生。TLC结果证明了游离酶及固定酶反应体系中有产物苯乙酮的生成,且游离酶及固定酶的反应体系中均无与(S)-α-甲基苄胺相同Rf值的物质显示,从而验证了经T4噬菌体衣壳固定化后的酶仍保留了较好的生物催化活性。

图4 固定化酶酶活TLC测试Fig.4 Immobilized enzyme TLC activity test
2.5 固定化酶回收性能验证
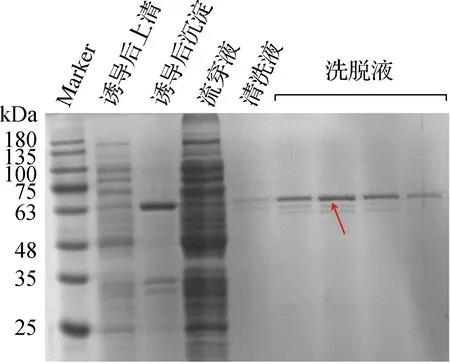
为确定经固定化酶的回收能力,对经离心回收的固定化酶催化反应体系上清进行了15%SDS-PAGE验证,以相同浓度的重组融合酶催化反应体系为对照,15%SDS-PAGE的测试量相同。测试结果如图5所示,重组融合酶的催化反应体系电泳泳道中可见60 kDa处明显蛋白条带,固定化酶催化反应体系中相应处的蛋白条带几不可见。由此可证,经T4噬菌体衣壳固定化后的重组融合酶经高速离心得到了较好回收。

注:红色箭头指示催化体系电泳泳道中的重组融合蛋白条带;蓝色箭头指示重组酶对照电泳泳道中的重组融合蛋白条带。图5 固定化酶回收测试Fig.5 Immobilized enzyme recovery test
固定化酶的酶活回收效率经HPLC测试后,绘制成线性图,回收结果如图6所示。经4轮催化测试,平均每轮酶活的回收效率>92%,由此可以看出,经T4噬菌体衣壳固定化的海洋脱氮假弧菌ω-转氨酶可实现良好的酶催化活性回收。
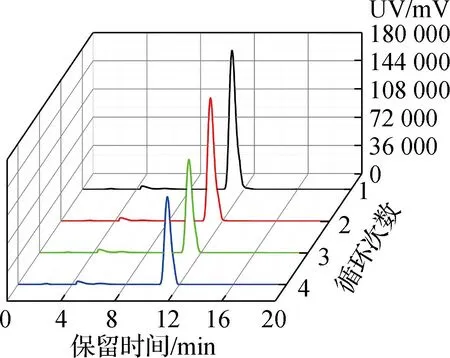
a 酶活回收测试体系的HPLC监测
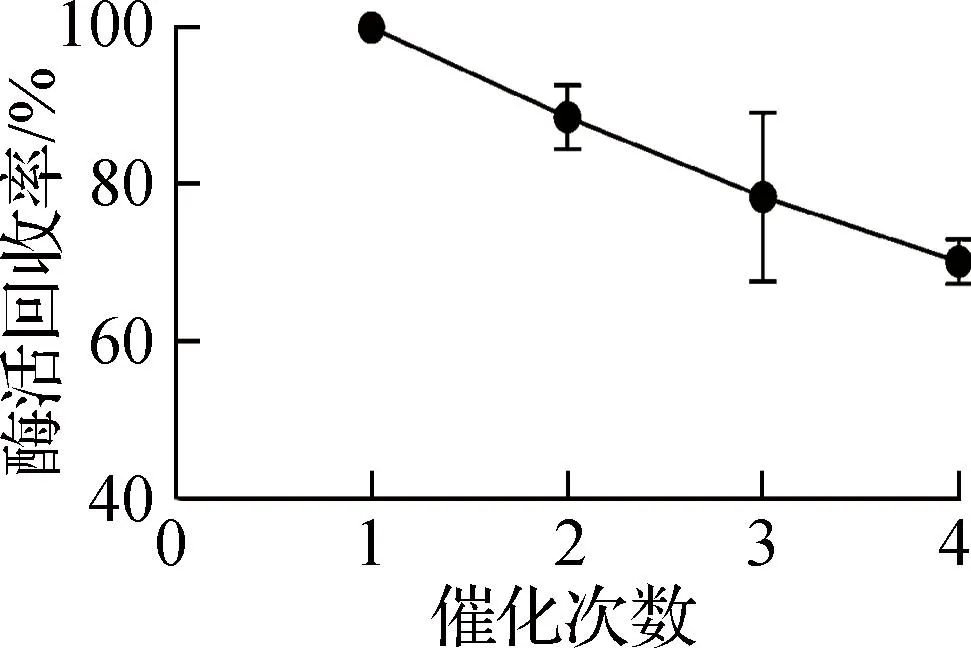
b 酶活回收率曲线图6 固定化酶酶活回收效率测试Fig.6 Enzyme activity recovery efficiency test of immobilized enzyme
3 讨论
由于海洋资源占据着全球资源的70%,且存在广泛的生物多样性,海洋活性物质的挖掘及开发占据了新型活性物质挖掘的重要一环。海洋环境与陆地具有较大差异,使得海洋生物的生命活动维持所需活性物质会区别于陆地生物。随着人们对海洋生物探索的不断深入,一些结构新颖、活性独特的活性物质逐渐被发现。
来自于海洋脱氮假弧菌的ω-转氨酶具有区别于以往发掘ω-转氨酶的独特远端手性中心(S)-型选择性,这在酶催化领域也是较为少见的。由于具有独特的选择性,海洋脱氮假弧菌ω-转氨酶可在1-四氢萘胺和1-氨基茚满的转氨反应中发挥特别的作用,生产的酮类也具有很高的对映体过量值,且这种独特胺手性中心选择性可应用于抗抑郁药物关键中间体的拆分制备。当前的酶催化材料存在着稳定性不高、无法重复性利用的缺点,这在一定程度上限制了其在工业生产中的应用,而引入固定化工艺则存在解决上述问题的可能性,但这面临着另外一个问题,即以往常用材料的固定化工艺通常存在吸附能力不强而易解析脱落、载体活化复杂、易造成酶的精细功能丧失等缺点。
本研究使用的T4噬菌体衣壳为生物固定化材料,与T4噬菌体衣壳附加Soc蛋白融合后的海洋脱氮假弧菌ω-转氨酶,可基于T4噬菌体衣壳与Soc蛋白之间的高生物亲和力自组装固定于T4噬菌体衣壳的Soc结合位点,在构象上给予酶催化活动更多的空间,这种精细化的固定化方式可实现酶催化活性的高效保留。通过两种不同结构重组融合蛋白的设计及选择优化,本研究成功实现可与T4噬菌体衣壳结合重组融合蛋白的表达,且获得可满足实验需求的较高上清可溶表达量的重组融合蛋白。通过TLC测定了固定化酶的催化活性,TLC的Rf值结果证明了固定化酶活性的保留。同时对固定化酶的催化体系进行了简单离心回收,催化活性回收实验结果显示,平均每轮的酶活回收率>92%。以上结果揭示,经T4噬菌体衣壳固定化后,海洋脱氮假弧菌ω-转氨酶的催化性能得以被有效保留,且能够实现高效回收,可进一步推动海洋脱氮假弧菌ω-转氨酶催化工艺中的应用。
