条斑紫菜绿斑病优势病原菌的鉴定及其生长特性与药敏分析*
2024-01-12赵龙成王浩同杜建周王洪斌赵晓恒程汉良许建和陈香凝丁祝进
王 颖,赵龙成,王浩同,杜建周,王洪斌,赵晓恒,程汉良,许建和,陈香凝,丁祝进
(1.江苏海洋大学 a.海洋科学与水产学院; b.江苏省海洋生物技术重点实验室; c.江苏省海洋生物资源与环境重点实验室; d.江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005; 2.盐城工学院 材料科学与工程学院,江苏 盐城 224051)
0 引言
条斑紫菜[1](Porphyrayezoensis),隶属红藻纲、红毛菜科。藻体鲜紫红色或略带蓝绿色,卵形或长卵形,一般高12~70 cm。作为我国重要的经济海藻之一,年总产值超50亿元,广泛栽培于江苏、山东沿海地区[2]。条斑紫菜是一种常见的海藻,也被称为紫菜、海苔或海带。它是一种富含营养的食物,特别是富含蛋白质、维生素和矿物质,被广泛用于制作寿司、海苔包饭等传统食品,也可作为调味料或零食食用。近年来,随着对条斑紫菜的需求增加和认识的提高,其养殖规模也在不断扩大,但也带来一些问题,如过高密度的栽培和水质恶化等。这些问题会对养殖环境和紫菜的健康生长产生一定影响[3]。
条斑紫菜绿斑病是严重危害紫菜生长的病害,在整个紫菜栽培期间都有可能发生,尤以每年的11—12月份最为严重,特别是降雨或采收后极易发生[4]。绿斑病主要出现在幼叶或成叶阶段,并且多数发生在营养丰富的海湾或有机物废水较多的外海性海区[5]。绿斑病通过水体传播,感染紫菜叶片,导致叶片出现绿色斑点或绿色条纹。严重的病情会导致叶片变形、腐烂甚至死亡。已有报道表明,上述病害在韩国和日本的暴发给条斑紫菜养殖业带来了巨大的经济损失[6-7]。本文实验主要是对条斑紫菜绿斑病优势致病菌进行研究。利用16S rRNA测序[8]鉴定条斑紫菜绿斑病致病菌,使用固体培养基分析该致病菌的生长曲线,并利用K-B纸片法进行药敏试验[9]。本实验可为条斑紫菜绿斑病病原防治提供一定的参考依据。
1 材料与方法
1.1 紫菜绿斑病优势致病菌的PCR扩增及测序鉴定
条斑紫菜绿斑病优势致病菌由江苏海洋大学海洋藻类生物学实验室分离保存。首先,分别制备海水固体/液体培养基以及LB固体/液体培养基(见表1),然后对分离的条斑紫菜绿斑病优势致病菌菌株进行划线培养,培养24 h挑取单菌落进行培养。
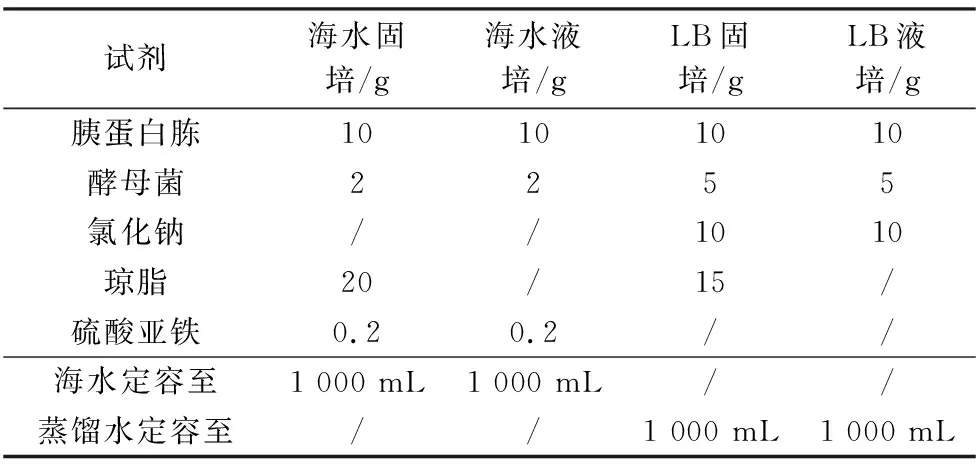
表1 培养基配方Table 1 Medium formula
获取16S rRNA基因序列进行鉴定[10]。一般来说,若所测菌株的16S rRNA基因序列与已知典型菌株基因序列的相似度小于97%,则认为该菌株可能是新种;若两者相似度大于97%,则仍不能确定是这个已知种,只能认为最接近于该种。如果需要更准确的结果,还需要进行DNA-DNA杂交等。
采用TIANGEN公司细菌基因组DNA提取试剂盒(离心柱型)提取细菌总DNA,所有操作步骤按试剂盒说明书进行。提取的总DNA通过琼脂糖凝胶电泳和紫外分光光度计分别检测浓度与纯度。以提取的总DNA为模板,进行细菌16S rRNA基因(27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-TACGACTTAACCCCAATCGC-3′)的PCR扩增,并利用质量分数1%的琼脂糖凝胶电泳分析条带大小,将PCR产物送上海迈浦生物科技有限公司进行测序分析。
1.2 深海微小杆菌生长曲线制作
1.2.1 制备深海微小杆菌菌种 先制作深海微小杆菌固体培养基,然后在培养基平板上面用接种环进行平板划线。培养18 h后,在超净工作台里面挑取单菌落接入到海水液体培养基以及LB液体培养基中。每种液体培养基各5 mL,于37 ℃ 170 r/min培养15 h后测量其OD600,并用于下一步接种。
1.2.2 分组及标记编号 取灭完菌之后的2 mL离心管共108支,分为4组每组27支,每3 h为一个时间节点,共测9个时间节点(0,3,6,9,12,15,18,21,24 h),每个时间节点测3个重复的OD值,并计算平均值。海水培养基28 ℃组标记为dH,海水培养基37 ℃组标记为H;LB培养基28 ℃组标记为dL,LB培养基37 ℃组标记为L。
1.2.3 接种培养 根据分组,分别在每个2 mL离心管中加入1 mL海水液体培养基或LB液体培养基,随后在每支离心管中分别加入10 μL深海微小杆菌菌种,按照分组分别在28 ℃或37 ℃条件下振荡培养。然后,分别按对应时间节点将离心管取出,于4 ℃贮存备用。
1.2.4 生长曲线制作 分别测定各组9个时间节点的深海微小杆菌OD600吸光值,并据此计算和制作生长曲线。
1.3 深海微小杆菌药敏试验方法
使用K-B纸片扩散法[11]进行药敏试验。先用平板画线法对深海微小杆菌进行培养,之后挑取单菌落接种到LB液体培养基中,在37 ℃ 180 r/min振荡培养12 h。随后,将菌种稀释40倍后在每个平板上均匀涂布200 μL,涂布完成后干燥3~5 min。然后,将20种抗生素(青霉素、氨苄西林、头孢曲松、链霉素、卡那霉素、庆大霉素、妥布霉素、新霉素、四环素、氯霉素、麦迪霉素、多粘菌素B、林可霉素、复方新诺明、呋喃唑酮、诺氟沙星、氧氟沙星、罗红霉素纸片、恩诺沙星、磷霉素)药敏纸片放到固体培养基中央,每个药敏纸片做3个重复,标记并用封口膜封好后置于37 ℃恒温培养箱中培养。分别在培养6,18,和24 h后使用游标卡尺[12]测量抑菌圈直径并记录数据。
1.4 数据分析
实验结果以平均值±标准误(Mean±SE)来表示,并用软件SPSS 17.0的单因素方差分析(One-way ANOVA)进行显著性分析。其中,统计学上的显著性水平设置为P<0.05,极显著水平设置为P<0.01。
2 结果与分析
2.1 绿斑病优势致病菌鉴定结果分析
图1是绿斑病优势致病菌16S rRNA基因序列扩增结果,PCR条带单一,送上海迈浦生物科技有限公司进行测序。获得序列通过美国国家生物技术信息中心(NCBI)官网进行BLAST比对分析,结果表明该紫菜绿斑病优势致病菌与深海微小杆菌同源性达97.94%。
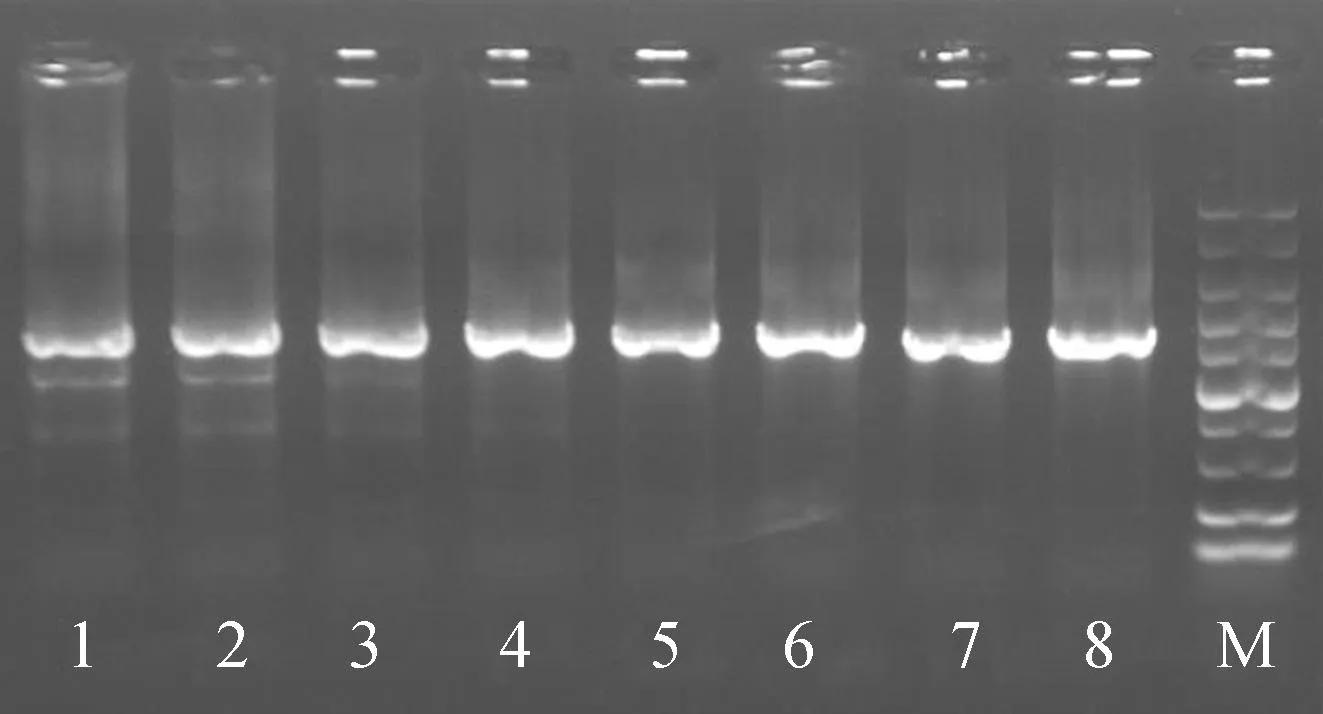
注:1~8表示16S rRNA基因在退火温度为50~64 ℃梯度下的扩增结果,M为DNA marker。图1 紫菜绿斑病优势致病菌16S rRNA扩增结果Fig.1 Results of 16S rRNA amplification of the dominant pathogen of Porphyra green spot disease
2.2 深海微小杆菌生长曲线分析
如图2所示,深海微小杆菌在海水培养基中不同温度下的生长曲线整体呈上升趋势。在28 ℃条件下,深海微小杆菌在0~6 h内生长较为缓慢,OD600吸光值在9 h和15 h出现2次波动,在24 h达到峰值。与28 ℃相比,深海微小杆菌在37 ℃条件下生长曲线更加平缓,并在21 h达到峰值。
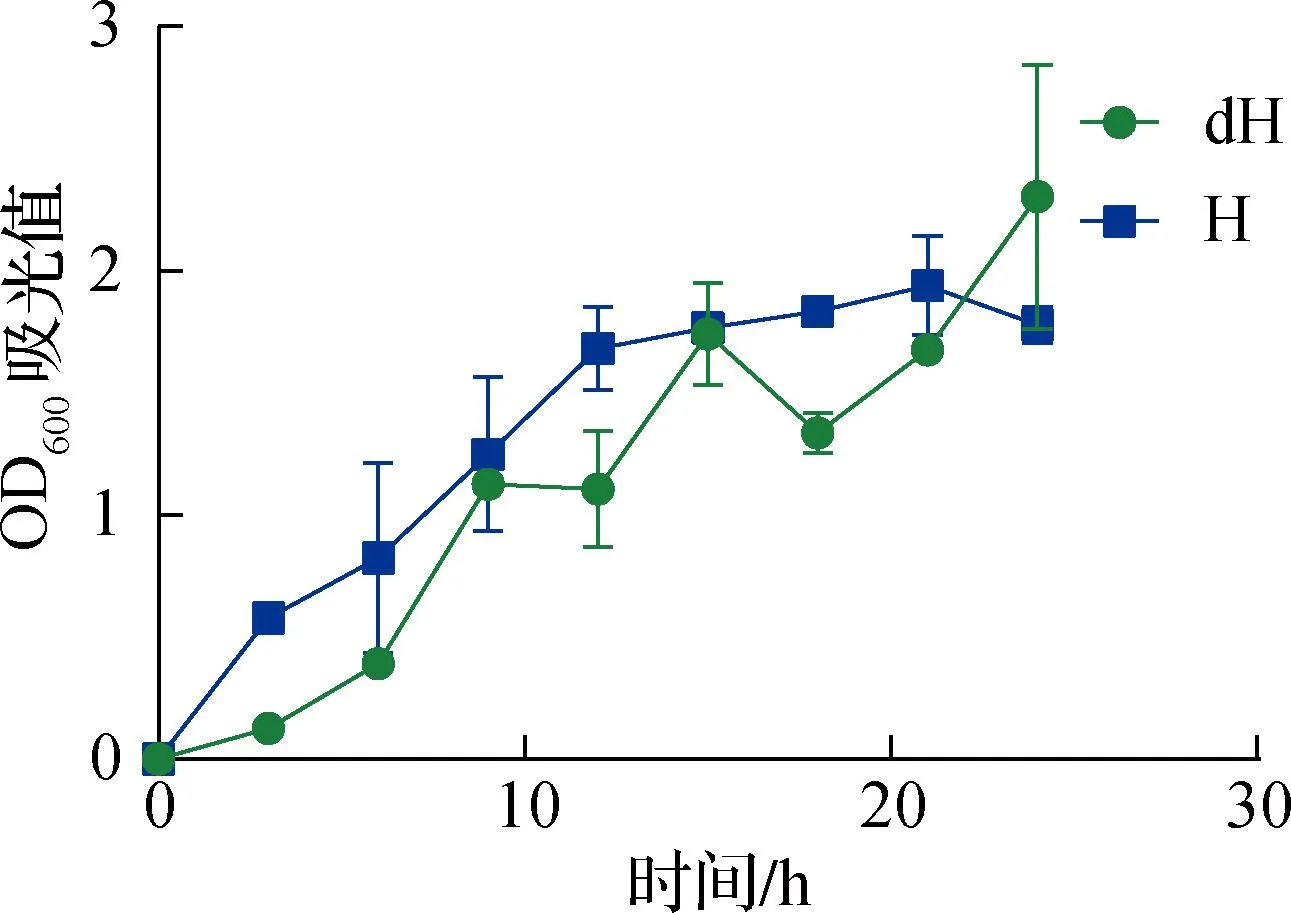
图2 深海微小杆菌在海水培养基中不同温度下的生长曲线Fig.2 Growth curve of Microbacter bathyae at different temperatures in seawater medium
如表2所示,在海水培养基中,条件为37 ℃时OD600吸光值明显高于 28 ℃时的OD600吸光值。而在LB培养基中,在3,6,12 h时,37 ℃的OD600吸光值高于 28 ℃;在9,15,18,21,24 h时,28 ℃吸光值明显高于37 ℃,并且在24 h时,条件为28 ℃的OD600吸光值达到最大。

表2 深海微小杆菌在不同培养基各时间节点OD600吸光值Table 2 OD600 value of Microbacter bathyae at different time points of various medium
如图3所示,深海微小杆菌在LB培养基中28 ℃条件下生长曲线同样出现波动。主要表现为6~9 h之间生长速度显著加快,随后持续生长,并在24 h达到峰值。在37 ℃条件下,深海微小杆菌在12 h的OD600吸光值最高,随后下调。总体而言,深海微小杆菌在两种培养基中37 ℃条件下生长情况均比在28 ℃条件下更加稳定,且在海水培养基中深海微小杆菌的菌种丰度普遍要高于LB培养基。
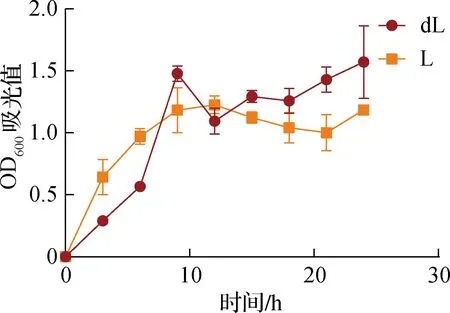
图3 深海微小杆菌在LB培养基中不同温度下的生长曲线Fig.3 Growth curve of Microbacter bathyae on LB medium at different temperatures
2.3 药敏实验结果分析
本实验初步探索了深海微小杆菌对常见抗生素的敏感性。表3为各种抗生素纸片在6,18,24 h抑制深海微小杆菌生长所形成的抑菌圈直径。结果表明,同一种抗生素在3个不同时间节点形成的抑菌圈大小无显著差异,且深海微小杆菌对20种抗生素均表现出较高的敏感性,其中青霉素、氨苄西林、头孢曲松、麦迪霉素和四环素的抑菌效果更加显著。
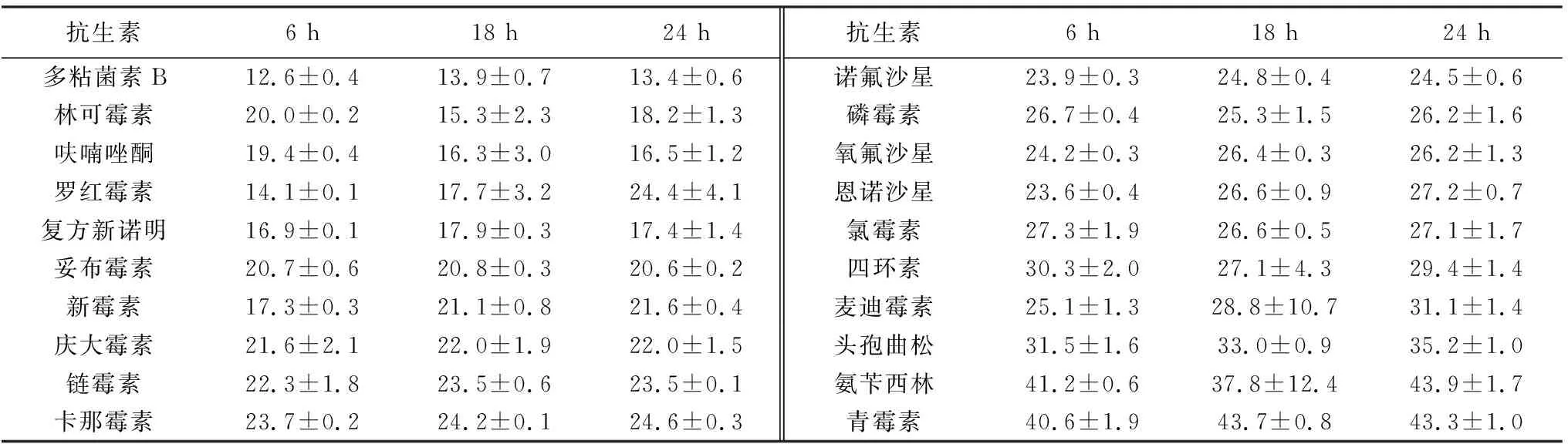
表3 各种抗生素不同时间节点抑菌圈直径Table 3 Diameter of bacteriostatic zone at different time points of various antibiotics mm
根据药敏性判定标准:抑菌圈直径20 mm以上为极敏,15~20 mm为高敏,10~14 mm为中敏,10 mm以下为低敏,0 mm为不敏,所以可以判断出各种抗生素的药敏性。从表4可以看出,每种抗生素产生的抑菌圈的透光度也有区别。例如氯霉素(图4a)产生的抑菌圈较小,并且圈内较为模糊。麦迪霉素(图4b)比氯霉素(图4a)圈内更为模糊,并且其边界更加不清晰。四环素(图4c)抑菌圈虽然小但是透亮。而青霉素(图4d)抑菌圈大并且透亮。表4中有少许抗生素有圈内模糊的情况,模糊的原因可能是此种抗生素具有抑菌效果,却无法做到完全杀灭这种细菌,因此在圈内依然有少许深海微小杆菌在生长。从表4中还能看出其他异常情况。如青霉素(图4d),其抑菌圈内可较明显地分为内圈和外圈,而且在圈内可以发现有些许菌落,此种属于特殊情况。造成的原因可能是实验误差问题导致深海微小杆菌在其抑菌圈内生长,但并不能表明深海微小杆菌对青霉素会产生耐药性。

b 麦迪霉素

c 四环素

d 青霉素图4 深海微小杆菌药敏试验代表性图例Fig.4 Representative examples of antibiotic susceptibility test of Microbacter bathyae
3 讨论
绿斑病首次发现于日本,其病原较为广泛,从患病紫菜中可以分离出微球菌[13]、假单胞菌[14]以及弧菌[15]。中国已报道柠檬假交替单胞菌(Pseudoalteromonascitrea)引起的条斑紫菜绿斑病[16]。目前报道的绿斑病病原菌大部分具有较强的胞外酶活性,这些胞外酶导致的宿主损伤可能是引起紫菜叶片绿斑的重要原因。近年来研究发现,叶绿体病毒也可以引起条斑紫菜绿斑病的发生[17]。而在本文实验中经过若干次实验与条件变换,发现绿斑病优势致病菌经过16S rRNA基因序列扩增结果与深海微小杆菌同源性达97.94%。这说明绿斑病的优势病原菌最接近深海微小杆菌,但是到目前为止对深海微小杆菌的研究报道较少。
本文研究采用了光密度(OD)测量[18]结果反应深海微小杆菌的生长情况。该方法通过检测培养基浓度,以培养基浓度代表其中菌的数量。培养基的浓度与OD值成正比,OD 值越大表示菌数量越多。该方法的优点是能够快速方便地了解菌的生长情况,但是由于测的是OD值,得到的是培养基里面的总菌数,活菌和死菌都包含在内,就导致了菌的生长曲线[19]衰亡期测量不准确,本研究绘制的生长曲线衰亡期表现就不太明显。但是本研究绘制的延迟期、对数生长期与稳定期曲线都可以看出结果。
由于本种细菌为深海微小杆菌,其未在美国临床实验室标准委员会(clinical and laboratory standard institute,CLSI)里面建立参考数据,并且CLSI里面的标准以及讨论多针对于临床,更多的是给人用药,所以CLSI里面的标准对于本种细菌药敏实验的结果参考性不大。但是数据结果仍以表4作为判断标准,抑菌圈透明度数据仅为参考数据。李纯等[20]与曾世祥[21]的研究表明,抑菌圈大小仍然是临床上判断细菌对药物敏感性的主要依据。本药敏实验出现某些抗生素抑菌圈模糊的情况,根据重复组实验结果判断可以排除pH、盐度等的影响,有可能是某些抗生素对深海微小杆菌有一定抑制作用,但是无法彻底杀灭该菌。
大量研究表明,紫菜叶状体的病害[22]是由多方面因素引起的,致病原因十分复杂。除了本身的生理不适应、种质退化和环境条件不适宜等因素外,微生物也是不可忽视的一个重要因素[23]。绿斑病病症只是一种表观特征,多种因素造成的藻体破坏、藻红素溶出,均可呈现绿斑病症状。海水温度异常升高、降雨或有机质污染引起藻体代谢失常都可能引起紫菜绿斑病[24],但环境胁迫条件下导致的附生微生物菌群失控是引起紫菜发生病害的主要原因[25]。通过环境因子实验,发现高温、高密度养殖是引起紫菜绿斑病发生的主要因子,而海水密度的变化在一定程度上可以减缓病烂速度,这也与海区栽培情况相印证[26]。每年11、12月份,海区紫菜进入快速生长期,此时网帘上紫菜密度较大,为致病菌提供了丰富的营养和良好的环境。在正常养殖条件下,条件致病菌数量一般维持在一定范围内,不具备致病力。当出现升温或降雨等环境变化,条件致病菌的致病性可能增强[27],造成紫菜绿斑病的发生。合理控制养殖密度,及时疏苗,密切注意水温等气象环境的变化,充足的干出以改变紫菜表面海水密度等,可以有效抑制绿斑病的发生。
本文研究通过16S rRNA测序进行菌种鉴定,建立快速检测的LAMP技术[28],并进行生长特性及药敏实验分析,得到深海微小杆菌为绿斑病的优势病原菌,但其具体感染和致病机制有待进一步深入研究。
4 结论
本文以绿斑病优势致病菌为研究对象,对其进行了16S rRNA鉴定,并且绘制了该菌的生长曲线,研究了其对药物的一般敏感性,最终对该菌的LAMP方法进行了探索。实验主要结论如下:
(1) 该菌株为深海微小杆菌(E.profundum),革兰氏阳性菌。
(2) 该菌株在海水培养基(盐度为30)中生长情况比在LB培养基(盐度为10)中好。
(3) 该菌株在37 ℃时对环境适应速度比在28 ℃时快。
(4) 该菌株对青霉素、氨苄西林等20种抗生素均有敏感性,即该菌株对常见的抗生素均无抗药性。
