工业大麻转录组学研究进展
2024-01-12李紫薇李洪超王晓楠赵越曹焜王盼朱浩肖湘
李紫薇,李洪超,王晓楠,赵越,曹焜,王盼,朱浩,肖湘
(黑龙江省科学院大庆分院,黑龙江大庆 163316)
工业大麻(CannabissativaL.)是大麻科、大麻属(CannabisL.)一年生直立草本植物,其四氢大麻酚(Tetrahydrocannabinol,THC)含量小于0.3%,不具有毒品利用价值,可进行种植加工及利用[1]。工业大麻作为最早种植的经济作物之一,在中国已有六千多年的栽种历史[2],根据其用途,可将大麻分为纤用、籽用、药用、籽纤兼用和纤药兼用等类型[3]。据统计,世界上由大麻衍生出的产品达2 万多种,涉及纺织、造纸、食品、医药及复合材料等领域,如:麻皮可制成服装、纸张、绳索等,其叶、花、根可以入药,也可以用作土壤肥料;茎秆可制成密度板等新型复合材料,具有极高的经济价值[4]。
转录组测序技术(RNA-Seq),是指将高通量测序方法应用到由mRNA 逆转录生成的cDNA上,能够迅速准确获得特定物种组织或器官在特定生理状态下几乎所有转录本序列信息和表达信息[5],该技术具有速度快、准确度高、操作成本低等优势[6]。随着测序技术的发展,转录组测序技术在工业大麻的基因转录组、新基因挖掘、抗胁迫机制、分子育种及其纤维发育调控等研究领域获得重大突破,在缺少参考基因组的条件下,转录组测序技术不仅能获得样本中的序列信息,还能对序列的表达量进行定量分析,研究差异基因的表达情况[7-8]。由于工业大麻产业的蓬勃发展以及创新性应用如火如荼,当下产业发展对种质资源提出更高的要求,同时工业大麻种植也逐步由耕地向条件恶劣的非种植地扩大转移,这使培育多功能、抗逆性强工业大麻品种迫在眉睫[9],因此精准鉴定、深度发掘优异基因和特色品种资源并解析其分子机理,对工业大麻品种遗传改良及产业创新发展至关重要。伴随着转录组技术和生物信息的迅速发展以及测序成本的减少,转录组测序技术在工业大麻中广泛应用。因此,本文阐述了转录组测序技术在工业大麻上的研究现状,并展望了其在工业大麻中的应用前景。
1 转录组测序分析相关概念
转录组的概念最早于1995年由Velculescu 提出,广义上指特定生理条件下,细胞内所有转录产物的集合,主要包括mRNA 和非编码RNA,狭义上指所有编码蛋白质的mRNA 的总和[10]。转录组测序在有参考基因的条件下,可以进行序列可变剪切的调控[11-13]、转录图谱的绘制[14-15]、基因家族筛选及验证分析[16];在没有参考基因组的条件下,转录组测序也可以进行新基因的深度挖掘[17-19]、代谢途径的确定[20]和低丰度转录本的发掘[21-22]。转录组学研究涉及的方法多样,如杂交技术、cDNA 芯片、高通量测序等。现阶段转录组学研究主要使用高通量测序技术,通过高通量测序技术反映某一物种的mRNA 特定情况和时间点下基因的表达情况[8]。
高通量测序技术(High-throughput sequencing)又称为“下一代测序技术”,指能够一次同时对大量核酸分子进行平行序列测定的技术[23]。自1953年沃森、克里克通过双螺旋结构认识核酸的空间结构后,人们开始探究其序列信息,测序技术发展也由此拉开序幕。1977年生物化学家Sanger 发明了链终止测序法,至今仍被人们认为是第一代测序技术。随着测序需求日益增多,第一代测序法费时费力、成本高,已不能满足人们的需求,因此开发出第二代测序技术。第二代测序技术以更低的成本实现了高通量和自动化,同时还提升了测序的分辨率,优化了RNA 剪切修饰功能[24]。目前,在二代测序平台中,454 测序技术平台最早实现商业化[25-26]。但存在的问题是,第二代测序技术需要从头组装并且拼接过程比较复杂,且只能对基因的局部结构进行检测,具有一定的局限性[27],因此,第三代代表性测序技术中的单分子实时测序技术,其通量高且测序读数长,测序过程无须进行PCR 扩增和打断,能直接获得完整的转录本,但正因为在测序时没有经过模板扩增,其测序信号的检测与边合成边测序的二代测序技术相比较弱,易在碱基识别时产生随机错误[28],因此第三代测序准确度比前两代低,且测序成本较高,目前更多研究还是以二代测序技术为主[29]。
现如今,转录组测序技术已发展成为重要的分子生物学分析方法,被广泛应用于各研究领域。近年,工业大麻转录组学测序是比较活跃的领域,了解其基因表达、分析其功能和调控机制、挖掘功能基因以及开展次生代谢产物途径等研究,有助于在其遗传育种理论与技术途径领域获得新突破,为育种研究提供有益指导。
2 工业大麻转录组测序研究进展
2.1 工业大麻基因组及关键活性成分研究
从2011年工业大麻基因组草图发表到2020年5月公安部物证鉴定中心发表了一个高质量染色体水平的野生大麻参考基因组,标志着工业大麻逐步进入了基因组时代[30]。Van 等[31]利用转录组和基因测序技术对高含量四氢大麻酚酸(Tetrahydrocannabidiol acid THCA)的大麻品种Purple Kush(PK)及低含量THCA 品种“Finola”和“USO-31”进行对比分析,得到一个534 Mb 的PK 基因组草图,同时也发现THCA 合成酶(Tetrahydrocannabinol synthase THCAS)在大麻素合成通路显著上调,且在PK 中表达远高于Finola 品种,该研究不仅进一步明确了大麻转录组的特征,同时也为后续培育具有大麻素特征的品种及揭示工业大麻基因型和化学型的遗传关系奠定了基础。
大麻素类化合物作为工业大麻活性成分具有多种功效,目前已从大麻中分离鉴定150 余种,其中大麻酚(Cannabinol,CBN)、大麻二酚(Cannabidiol,CBD)和THC 在医药领域应用广泛[32]。CBD具有抗菌、消炎以及抗肿瘤等多种价值。为了探究通过栽培手段合成CBD 的环境影响机制,严江涛[33]利用RNA-Seq 对室外和室内两种培育环境下工业大麻品系C4 的CBD 合成分子机制进行分析,发现在室外培育条件下,BDAS、CYP86B1和ALDH2C4这些基因表达量比室内条件明显增加,也发现苯丙酸生物合成途径主要调控CBD 的合成,该研究明确了调控CBD 合成的主要代谢通路,并推测BDAS、CYP86B1和ALDH2C4这些基因参与CBD 的合成,同时除了培养环境对工业大麻CBD合成有影响,施加外源激素对CBD 合成机制也有一定作用。吴珊[34]利用20 mg/L 激动素(KT)对工业大麻材料DMG227 喷施处理30 d 并进行转录组测序,与无外源激素处理比较分析,发现KT 喷施处理可调控大麻植物体内的次生代谢途径,从而使植株的CBD 与THC 含量明显升高,同时倍半萜和三萜生物合成次生代谢途径富集到许多萜烯合酶基因家族,且这些萜烯合酶基因显著表达。因此猜测,CBD 和THC 含量增加与KT 处理调控萜烯合酶的表达有关。为进一步探究大麻素生物合成途径中基因的表达水平,Braich 等[35]利用雌性工业大麻的根、茎、花等组织构建和注释了基因表达的转录组图谱,并与雄性工业大麻营养组织和生殖组织进行基因差异比较分析,挖掘出大量与大麻素合成相关的候选基因CsTPS5FN、CsTPS9FN和CsTPS12PK。
在继利用转录组测序技术挖掘工业大麻活性成分合成酶及关键基因后,Varaerg 等[36]基于来自不同谱系的69 个大麻品种的全基因组序列,通过对数据进行组装及从头测序分析,发现大麻素合成途径编码CBDA/THCA 合成酶基因在基因拷贝数(CN)上存在差异,并获得多个CBDA/THCA合成酶基因家族的同源基因,该研究验证了转录组研究结果,并从基因组水平上解释了大麻素含量变化的调控机理。同时,Zager 等[37]通过对9 个不同品种工业大麻的腺毛进行转录组和代谢组分析,利用加权基因共表达网络分析方法揭示了一个与大麻素和萜类化合物生物合成相关基因的共表达网络,鉴定出之前未曾报道过的基因:编码橙花醇的TPS18VF、编码芳樟醇合成酶的TPS19BL、编码大根香叶烯B 合酶的TPS16CC和编码四甲基环癸二烯甲醇合酶的TPS20CT(表2)[38]。这些研究为进一步利用转录组测序技术挖掘工业大麻活性成分关键基因,提取次级代谢产物以及联合多组学数据阐述大麻素合成机制提供了参考。
2.2 工业大麻纤维相关转录组研究
2.2.1 工业大麻纤维发育转录组研究
“国纺源头,万年衣祖”,工业大麻纤维强度高,耐磨性好,具有天然抑菌和防紫外线等特性,因此以工业大麻韧皮纤维为原材料的食药、日化、纺织、新材料等产业蓬勃发展,其产品广受人们追捧[39]。
工业大麻下胚轴韧皮纤维存在由伸长到增厚的过渡阶段,因此工业大麻是研究二次生长过程的最佳模型[40]。在纤维发育方面,Guerriero 等[41]对雌雄同株工业大麻的3 个不同韧皮部位进行RNA-Seq 分析,通过对不同纤维发育时期基因富集转录本的分析,发现每个茎区的纤维具有特定的转录组特征,细胞壁沉积等相关过程主要发生在茎折断点的节间,还发现了调控细胞周期和光合反应的相关基因如CAB1(叶绿素结合蛋白1)、LHCB4和LHCA5(光合复合物),以及与次生代谢物即萜类化合物、类黄酮生物合成相关的基因,如CYP76C1(编码细胞色素P450s)和C2(参与花芳樟醇代谢),这些基因对韧皮纤维发育发挥重要作用,同时在较老的茎节部发现植物激素生物合成的相关基因(如GA20OX2和GA3OX1编码赤霉素合成酶)、次级细胞壁沉积和与木质素生物合成相关的基因(如PAL1、CesA8、EXPA8、EXPA10、EXPA11、EXPA12)表达量均较高。该研究应用转录组测序技术不仅确定了细胞壁沉积发生的部位,还挖掘出参与纤维发育和激素合成的基因,更深入地探究了工业大麻纤维发育分子机制。
植物激素作为重要的信号分子,对调节植物的生长发育和环境应答具有十分重要的作用。通过对植物进行外源激素处理,可调节植物的次生代谢物合成,不同浓度外源激素对工业大麻组织发育皆有一定程度的影响。Guerriero 等[42]对播种后16、17、18、20 d 的幼苗喷洒茉莉酸(JA),利用RT-qPCR 对其下胚轴进行基因表达分析,结果发现,JA 对下胚轴的木质素含量具有积极作用,可通过JA 对下胚轴直径的影响程度来反映其对次生生长的影响,下胚轴直径的增加会导致次生韧皮部纤维数量增多。同时,内源激素的积累对植物的生长发育也发挥着重要作用,Marc 等[40]选择工业大麻4 个具有代表性的发育阶段进行了植物激素的转录组学和定量分析,结果显示,次生生长开始有植物激素(生长素、JA 及细胞分裂素等)参与调控,尤其是JA,其含量在发育的15 d 达到峰值,而细胞分裂素则起到调节次生组织中木质素沉积的作用,这些植物激素对细胞壁生物合成都至关重要。该研究结合生理与转录组测序结果探究了大麻下胚轴从初级生长向次级生长过渡的分子机制,最终不仅证明了内源激素密切参与次生生长和细胞壁沉积,也证明了JA 和生长素调节节间部分次级细胞壁相关基因表达。在此研究基础上,Behr 等[43]通过对工业大麻茎节点3 个不同部位进行RT-PCR 分析,发现工业大麻节点处存在从纤维伸长到纤维增厚的转变,还发现了与细胞壁沉积相关的基因(如CesA6、FLA2和FLA6),同时在节点内、外部存在差异表达如:NST1 调节纤维分化因子,MYB46-1作为参与细胞壁生物合成和木聚糖生物合成的转录因子在节点内部高表达,调控细胞壁沉积的FLA3和WAT1在外部组织中高表达,因此,可推测工业大麻不同部位在纤维发育过程中存在生理和分子水平上的差异。同时,Van 等[44]利用转录组测序技术对两个不同品种的工业大麻Chameleon 和Felina 34 在不同发育阶段的不同组织进行比较研究,发现其差异基因木质素生物合成基因(THF)和甲基化循环编码酶(CCoAOMT、COMT)在秆芯组织中高表达,并调控木质素的合成,同时在工业大麻伸长期的茎韧皮组织中,也发现了与苯丙素生物合成和次级细胞壁纤维素合成酶相关的基因显著表达[39]。这些研究为逐步揭示工业大麻纤维发育的转录组学机理、挖掘功能性基因以及生物合成代谢途径提供了重要信息。
2.2.2 工业大麻纤维产量品质转录组研究
工业大麻纤维产量的差异是内因(基因型、生理)和外因(环境、农艺措施)共同作用的结果。品种的产量和品质差异是不同环境和栽培手段的最终体现[45-46]。关于不同品种纤维产量和品质差异,Musio 等[47]将传统的绿茎品种与黄茎品种在两个收获时期(花期和工艺成熟期)进行比较,发现黄茎品种的纤维提取效率均比绿茎品种的高,该研究为挑选高纤维工业大麻品种提供了思路。即使在相同生长环境下,品种间的产量也被证实存在明显差异[48-49]。因此提高纤维产量,选育高产、优质的品种,并探索和规范高效配套种植技术至关重要。
工业大麻纤维发育可分为3 个阶段:发育起始阶段、伸长阶段、细胞壁增厚阶段,经过这3 个阶段逐步过渡可实现工业大麻从产量到品质的转变[39]。Koziel 等[50]利用RNA-Seq 对工业大麻韧皮纤维木质化及次生壁发育进行遗传分析,发现大麻纤维转变的最佳靶基因是咖啡酸甲基转移酶Ⅱ(COMT2)、阿魏酸5 羟基化酶(F5H)和β-D 半乳糖苷酶(BGAL)。也有研究者利用RNA-Seq 和全基因组关联分析协同对123 份大麻材料的纤维品质相关性状进行遗传分析,对不同纤维品质性状的16 个QTL 进行定位(葡萄糖、木质素、韧皮纤维含量等),推测这些物质对纤维品质起着重要作用[51]。上述研究挖掘出纤维产量及品质相关基因及生物代谢途径,除遗传因素外,有研究表明,工业大麻性别可影响其纤维产量和品质[52],工业大麻多为雌雄异株,而雄麻纤维品质优于雌麻,因此,Prentout 等[53]采用概率性方法SEX-DETector 对工业大麻所有基因进行分离和分析,鉴定出约500 多个与性别连锁的基因,再通过RNA-Seq 技术将这些基因映射,组装获得了大麻性染色体,从而了解了工业大麻性染色体系统。作为迄今为止记载最为久远的植物性染色体系统,推测其具有很大及高度分散的非重组区域,该研究通过了解工业大麻性染色体系统,相当于了解了其基因组信息。
通过上述转录组测序对工业大麻纤维发育及产量品质进行研究,挖掘出许多相关基因(表1)。在工业大麻下胚轴次生生长过程中,也有研究者利用转录组测序技术陆续发现了与韧皮纤维伸长相关的XTH基因(如XTH5 和XTH8)[54-58]和转录因子NST1、MYB46和WLIM1,参与纤维素生物合成的COBRA家族[7](COB和COBL4基因),以及次生细胞壁纤维素合成酶基因(CesA4、CesA7和CesA8)[42-45]。
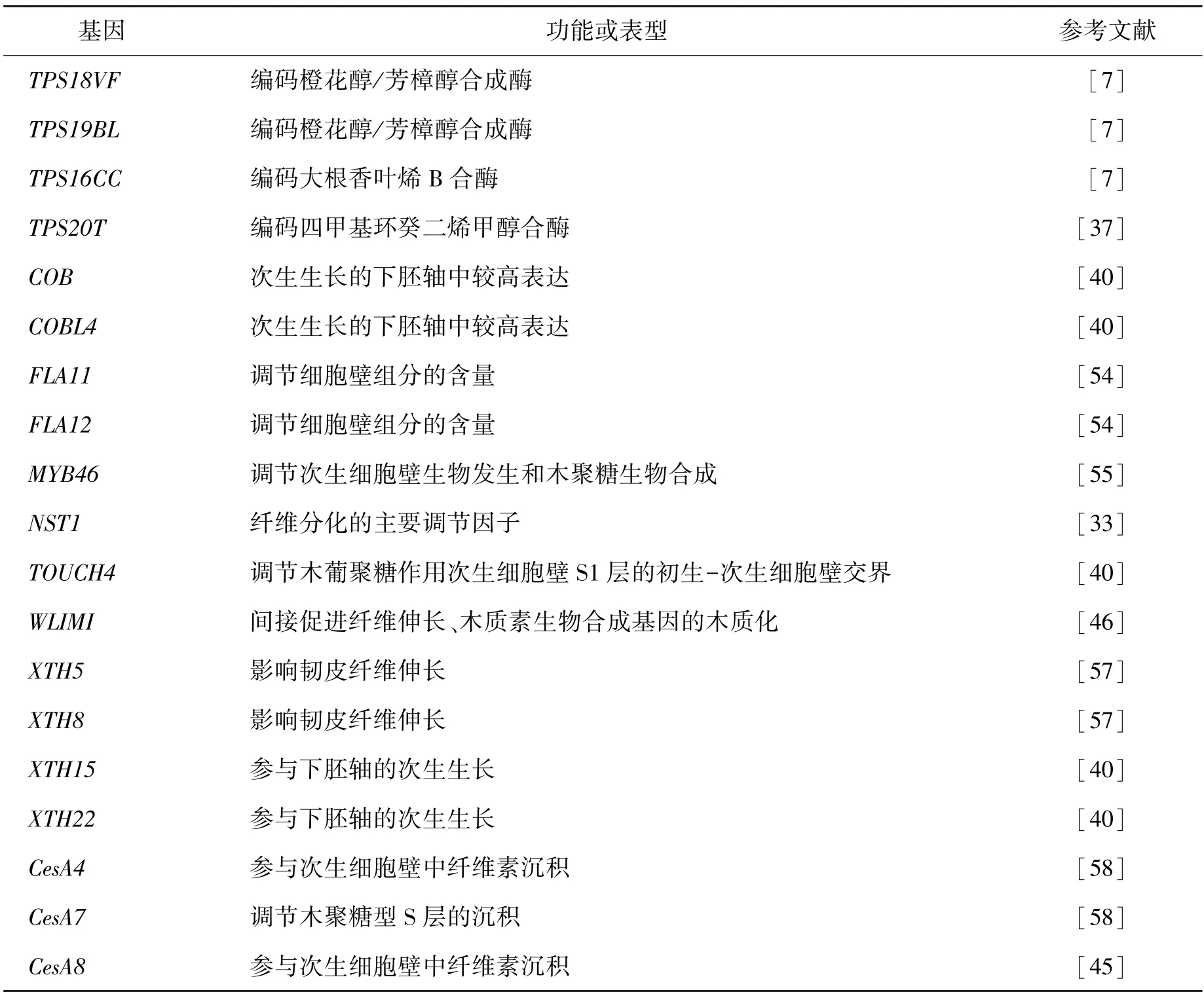
表1 转录组测序筛选出的部分已知工业大麻基因Table 1 Some Cannabis stiva L genes screened by transcriptome sequencing
3 工业大麻非生物胁迫转录组研究
3.1 盐胁迫
盐害是一种常见的非生物胁迫,土壤盐分过多会破坏土壤溶液渗透压平衡,抑制植株细胞呼吸等生命活动,从而影响植物的生长发育,严重时可导致植株死亡。我国盐碱地逐年增长且分布范围逐渐扩大,随着我国人口增加和耕地不足矛盾日益凸显,筛选抗性品种、加强盐碱地利用以及开展边际土壤改良是今后农业可持续发展的重要方向,开展工业大麻耐盐碱性研究、培育耐盐品种具有重要应用价值。工业大麻不同品种和不同生育期对盐的敏感程度不同,在重度盐环境下不能生长[59]。苏文君等[60]首次利用7 个工业大麻品种通过水培法对其萌发期和幼苗期进行NaCl胁迫研究,筛选不同条件下大麻幼苗期耐盐性评价指标,综合比较品种的耐盐性发现:皖麻1 号耐盐性最强,巴马火麻耐盐性最弱,并且筛选出株高、茎粗、鲜重和干重等6 个衡量耐盐性指标。在此基础上,另有研究者[61]以不同浓度NaCl 水溶液模拟盐胁迫,对上述7 个工业大麻品种在萌发期和苗期的耐盐性进行对比研究:140 mmol/L NaCl 是大麻品种进行耐盐性鉴定的适宜浓度,且不同大麻品种在不同发育时期的耐盐性存在较大差异,如在萌发期,晋麻1 号是耐盐品种,巴马火麻是不耐盐品种,而在苗期,晋麻1 号是不耐盐品种,巴马火麻是耐盐品种,研究者推测可能是大麻品种在不同时期具有不同耐盐机理,萌发阶段更多是通过抵抗渗透胁迫来维持生长发育,而苗期则是启动抵抗离子毒害程序。为了解工业大麻不同品种耐盐性相关基因,刘家佳等[62]利用500 mmol/L NaCl 对2 个工业大麻品种植株叶片分别处理0、2、4、6 d,结合生理指标测定及转录组测序结果,发现2 种大麻生理反应在胁迫2 d 时最激烈,并在2 个大麻品种中鉴定出都显著上调的与耐盐相关的转录因子(MYB、NAC、GATA和HSF)。目前,NAC 转录因子已被大量证实响应植物盐胁迫,胡华冉等[63]基于刘家佳的研究基础,筛选出4 个盐胁迫应答基因(CsNAC1、CsNAC2、CsGDH2和CsNAC3)。植株根部会采取不同的耐盐策略响应盐碱胁迫,Cao 等[64]以耐受型品种火麻一号根部组织为材料,利用RNA-Seq 开展了NaHCO3胁迫下根部基因表达机制研究,发现在NaHCO3胁迫下植物可能通过调控激素信号转导与合成、苯丙素生物合成、淀粉、蔗糖、氮、氨基酸等代谢途径响应胁迫,并发现关键通路的枢纽基因与GTP 结合蛋白、谷氨酸合成酶、海藻糖磷酸、糖基转移酶和木质素合成相关。该研究利用转录组测序技术与共表达网络分析联合阐明了工业大麻对NaHCO3胁迫的分子响应机制。此外也有研究者从蛋白质组学角度,利用相对和绝对定量同位素标记技术(iTRAO)开展耐盐性品种的盐胁迫蛋白应激机制研究,结果表明,耐盐型工业大麻能够通过提高能量代谢、调节光合代谢来促进有机物的渗透及合成,并通过调节细胞物质的进出稳定细胞内外物质平衡来适应胁迫[58,65]。上述研究,转录组学与蛋白质组学结果相互呼应,为下一步综合解析组学数据进行工业大麻盐碱适应机制研究提供了基础参考。
3.2 干旱胁迫
水分作为植物的生命之源,也会对植物造成胁迫,可分为两种情况,第一种是干旱胁迫,是指植物在缺水的环境中生长,本质是因缺水抑制植物光合作用等生长发育活动;第二种是淹水胁迫,则是由于水分过多从而抑制植物根部的细胞呼吸,降低光合速率,进而干扰植物正常生长。工业大麻干旱胁迫的研究更多采用不同生理指标参数进行抗旱性评价,从而筛选抗旱能力强的品种[66-69]。另外也有研究者通过转录组测序技术研究外源物质对干旱胁迫下工业大麻胁迫的应答机制,如杨志晶等[70]采用盆栽称重控水法模拟干旱胁迫(50%基质含水量)对“云麻1 号”进行不同浓度的维生素C、甜菜碱、CaCl2和赤霉素处理,结合转录组测序结果分析其抗旱生理响应结果,发现外源物质可通过调节大麻的叶绿素、脯氨酸和可溶性糖的含量来缓解干旱损伤。烯效唑(S3307)作为一种高效低毒的三唑类植物生长延缓剂,在植物抗逆和增产方面效果显著,通过外源喷施S3307及干旱胁迫协同处理,姜颖等[67]通过对工业大麻品种汉麻2 号进行RNA-Seq 分析发现,S3307通过调控植物激素信号转导、光合作用、卟啉与叶绿素代谢等代谢通路中DEGs的表达来缓解干旱胁迫对工业大麻生长发育的损害,同时鉴定出S3307诱导调控干旱胁迫的差异基因IINV、TREH、PYG(3)、GBE1(2)、TPS(7)和β-淀粉酶。此外,Gao 等[71]通过RNA-Seq 分析筛选出与工业大麻抗旱性有关的过氧化物酶、扩展蛋白、肌醇加氧酶、NAC和B3的转录因子。上述研究通过转录组测序技术,发现工业大麻外施S3307等外源生长调节剂可调控光合作用、叶绿素等代谢途径,以此来提高工业大麻的干旱适应能力。
3.3 重金属胁迫
重金属主要指汞、镉、铅、铬、铜和锌类金属砷等,重金属对作物的影响从种子萌发阶段开始,而种子能否萌发和是否正常萌发是决定作物产量和品质的关键[72]。李增强等[73]研究发现,红麻幼苗通过调节自身生命活动过程及代谢物来应对铅胁迫,该结果为研究分析麻类作物应对重金属胁迫提供了重要参考信息。为了明确工业大麻在重金属胁迫下的研究机理,黄玉敏[74]对镉胁迫处理12 h 下的工业大麻“Yuma 1”(Ym)和“Neimengguxiaoli”(Nx)的根部组织进行RNA-Seq 分析,发现在镉胁迫处理下,Ym 品种比Nx 品种耐镉能力强,还发现在镉胁迫时,工业大麻会启动光合作用系统,并通过加快谷胱甘肽代谢等生物合成途径来抵抗镉毒害。在该研究基础上,研究者在镉处理条件下对两个镉耐受性不同的工业大麻进行差异基因表达分析,发现Ym 耐受品种比Nx 敏感品种具有更强的运输和累积能力,Ym 显示了更强的解毒能力,同时通过RNA-Seq 分析也在两个品种间鉴定出调控重金属运输和氧化还原过程的且与镉耐受相关的基因(WRKY、Myb和NAC转录因子)[75]。通过上述两个研究可知,Ym 品种抗镉性强,从基因水平揭示分子机制,挖掘抗镉相关基因。同时,在探讨缓解镉胁迫对工业大麻影响技术方法方面,尹明[76]在有无原花青素的不同处理下协同镉胁迫进行转录组测序,发现外源原花青素与镉离子会同时作用于EDS1 基因。因此推测该基因具有降低大部分植物激素相关基因表达量的功能,从而使植株利用原花青素与水杨酸,并通过光合作用、次级代谢物合成和抗氧化物质合成等相关途径来缓解镉胁迫带来的影响。
4 问题与展望
工业大麻用途广泛,而国内工业大麻产业主要围绕纤维和籽实开展相关产品开发,且采用的原料几乎不含有THC,医药用途目前也仅利用CBD 成分[77]。随着转录组测序技术的发展,研究者通过工业大麻的基因组序列和表达信息开展调控关键性状基因位点及代谢物合成途径挖掘研究,将为解析调控优异性状分子机理奠定重要基础[7]。然而相对其他麻类作物,工业大麻转录组研究大多集中于纤维发育基因表达调控及活性成分合成途径,对于影响纤维和籽实等产量性状关键调控因子、抗逆作用机制的研究还有很大的空间,同时,随着工业大麻药用价值日益提升,围绕CBN和大麻萜酚(Cannabigerol,CBG)等稀有成分的生物合成途径研究也将成为重点。近两年,单细胞转录组测序技术和空间转录组技术发展快速[78],并已开始应用到不同作物的研究中,接下来可以结合上述技术,弥补常规转录组技术方法研究的不足,并通过多组学联合、生物工程等不同分子生物学方法共同阐明工业大麻重要性状的表达调控策略,挖掘功能基因及揭示其遗传多样性。
