肺癌免疫治疗患者呼吸道症状变化轨迹及影响因素研究
2024-01-12彭娜娜陆箴琦陈凤珍张晓菊
彭娜娜 陆箴琦 陈凤珍 张晓菊
(复旦大学附属肿瘤医院护理部/复旦大学上海医学院肿瘤学系,上海 200032)
目前,肺癌的免疫治疗主要指免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗。ICIs联合化疗已成为晚期驱动基因阴性的非小细胞肺癌的一线标准治疗方案[1],也是广泛期小细胞肺癌的首选治疗方案[2]。免疫检查点抑制剂相关肺炎(checkpoint inhibitor pneumonitis,CIP)是免疫治疗的不良反应中的之一,可导致免疫治疗延迟或终止,是免疫相关不良反应中最常见的致死原因,发病时间在治疗开始后9 d~19个月不等,肺癌患者CIP的平均发病时间为2.1个月[3]。因此,对CIP的早期识别和及时处理显得尤为重要。咳嗽、呼吸急促等呼吸道症状是CIP的主要症状[4]。与其他经免疫治疗的肿瘤患者相比,肺癌免疫治疗患者呼吸道症状的发生率更高。一项以接受PD-1/PD-L1抑制剂治疗的黑色素瘤和非小细胞肺癌患者为研究对象的观察性队列研究结果显示,非小细胞肺癌患者比黑色素瘤患者更经常报告咳嗽(63% vs 11%,P≤0.001)和呼吸急促(37% vs 4%,P≤0.001)[5]。然而目前涉及肺癌免疫治疗患者呼吸道症状的研究多为CIP临床特征的回顾性分析[6-8],观察性队列研究也仅描述不同时间点症状的发生情况和症状负担等,忽略了症状发展的个体差异[5]。此外,呼吸道症状的发生规律尚不明确、影响因素也不确定,急需探索肺癌患者免疫治疗期间呼吸道症状的纵向变化机制,以帮助医护人员发现CIP的早期征兆,便于进一步确诊和治疗。因此,本研究采用前瞻性纵向研究设计,基于增长混合模型(growth mixture model,GMM)探索肺癌患者免疫治疗期间呼吸道症状的变化轨迹类别,同时分析轨迹类别的影响因素,根据个体差异形成有效的人群症状特征类别,以期为重点人群的早期识别和症状管理提供依据。
1 对象与方法
1.1研究对象 采用方便抽样法,选取2022年3月—2023年3月复旦大学附属肿瘤医院胸部肿瘤内科的肺癌免疫治疗患者为研究对象。样本的纳入标准:(1)年龄18岁以上,病理明确诊断为肺癌。(2)首次接受ICIs治疗。(3)能独立阅读书写,无认知功能障碍。(4)对自身诊断及病情知情。(5)自愿参与本研究,并签署知情同意书。排除标准:(1)处于疾病终末期,病情危重。(2)语言沟通障碍。(3)患有自身免疫疾病或合并其他严重疾病影响参与者。样本脱落的处理:(1)若研究对象拒绝继续随访、主动退出研究,则其所有数据均不纳入分析。(2)若研究对象因疾病进展等治疗因素而更换治疗方案或停止治疗的,则停止随访,作为截尾数据纳入分析。本研究属于单组重复测量设计,样本量估计采用查表法,参照Barcikovski和Robey提供的单组重复测量设计的样本含量估计表[9],平均相关系数取0.50,效应值f取0.14,α取0.05,查表得样本量n=106例,加上纵向调查10%~15%的失访率,本研究共纳入120例患者。本研究已通过复旦大学附属肿瘤医院伦理委员会审批(审批号:2001213-37-NSFC)。
1.2研究工具
1.2.1影响因素的调查问卷/量表 本研究以Brant和Beck改良的改良动态症状模型(revised dynamic symptoms model,RDSM)[10]为理论框架,指导肺癌免疫治疗患者呼吸道症状的纵向测量,为患者的症状轨迹类别提供潜在的影响因素。RDSM将症状体验和轨迹的影响因素总结为4类:(1)社会人口学因素:年龄、性别、社会经济状况、教育水平等。(2)生理因素:肿瘤有无远处转移、治疗方法、合并症、生物标志物等。(3)心理/社会因素:自我照顾、社会支持、心理状况等。(4)环境因素:生理功能、文化和生活方式等[11]。结合可测量、可干预原则,本研究设定以下问卷或量表作为影响因素的调查工具。
1.2.1.1一般资料调查表 由研究者自行设计,以人口学及疾病生理资料为主,包括患者的年龄、性别、文化程度、吸烟史、家庭人均月收入、有无合并症、肿瘤有无远处转移、治疗方案、谷丙转氨酶、谷草转氨酶、中性粒细胞与淋巴细胞比值、单核细胞与淋巴细胞比值。
1.2.1.2自我护理能力测定量表(exercise of self-care agency scale, ESCA) 该量表为Kearney和Fleischer于1979年开发的一种用于测量个人自我护理能力的工具[12]。我国台湾学者Wang等[13]将该量表翻译成中文,并测量中国台湾地区老年女性的自我护理能力,内容效度为1.0,Cronbach’s α值为0.86~0.92,重测信度为0.91。该量表分为4个维度(自护责任感、自我护理技能、自我概念和健康知识水平),共有43个条目。采用0~4分5级评分法,0分=“非常不像我”,1分=“有些不像我,2分=“没有意见”,3分=“有些像我”,4分=“非常像我”,其中条目3、6、10、16、19、22、25、28、32、34、39为反向计分,总分为172分,得分越高表示测量对象自我护理能力越强。
1.2.1.3社会支持评定量表(social support rating scale, SSRS) 该量表由肖水源[14]编制,用于评定个人的社会支持水平。量表重测信度为0.92,各个条目的一致性为0.89~0.94。该量表包括3个维度,即主观支持4个条目、客观支持3个条目和支持利用度3个条目,共计10个条目。第1~4和8~10条目:选择1~4项分别计1~4分。第5个条目分为A、B、C、D项,每项从无到全力支持分别计1~4分,计总分。第6、7个条目:“无任何来源”计为0分,选几个来源就计几分。总分为12~66分,得分越高表明个人社会支持程度越高。
1.2.1.4医院焦虑抑郁量表(hospital anxiety and depression scale, HADS) HADS由Snaith和Zigmond[15]编制,是一种用于筛查非精神科患者焦虑和抑郁状态的患者自评量表。该量表由焦虑亚量表(HADS-A)和抑郁亚量表(HADS-D)组成,分别有7个条目,共14个条目。每个条目分4级计分(0~3分)。分别计算焦虑亚量表和焦虑亚量表的分值。亚量表分值判定标准:0~7分表示无症状,8~10表示可疑存在焦虑/抑郁,11~21分表示肯定存在焦虑/抑郁。孙振晓等[16]应用该量表对615例心血管疾病病人进行测量,总量表、抑郁亚量表和焦虑亚量表的Cronbach’s α系数分别为0.879、0.806、0.806;以抑郁自评量表(SDS)和焦虑自评量表(SAS)作为校标进行校标效度检验,各相关系数均>0.55(均P<0.001),效标效度较好。
1.2.1.5健康促进生活方式量表-Ⅱ(health promoting lifestyle profile-ⅱ, HPLP-Ⅱ) 该量表由Pullen等[17]于1996年在HPLP的基础上修订而成。量表共包含6个维度:体育活动(8个条目)、健康责任(9个条目)、压力管理(8个条目)、营养(9个条目)、人际关系(9个条目)、精神成长(9个条目),共52个条目[18]。采用Likert4级评分法:1=从不,2=有时,3=经常,4=总是。总分为52~208分,分数越高表明生活方式的健康促进水平越高[19]。总量表的Cronbach′s α值为0.943,各分量表的Cronbach′s α值为0.793~0.872,重测信度系数为0.892。
1.2.2PRO-CTCAE呼吸道症状 采用PRO-CTCAE(the patient-reported outcomes common terminology criteria for adverse events)症状项目库中呼吸道症状条目,包含咳嗽和呼吸急促2种症状,用于肺癌患者免疫治疗期间呼吸道症状的监测[10]。对咳嗽和呼吸急促的测量均由2个问题组成:严重程度和对日常活动的影响。每个问题采用5级文字描述,严重程度为:“没有”“轻微”“中度”“严重”“很严重”,对日常活动的影响为:“没有”“少许”“有些”“蛮多”“很多”,依次赋值为0、1、2、3、4。
1.3资料收集方法 肺癌免疫治疗患者不良反应的平均发病时间为2.1个月[3],结合临床的常规治疗方案的频次为3周1个疗程,本研究将跟踪随访时间定为6个月,治疗开始后的前3周以1周为单位进行连续、密集的症状数据收集,之后每3周自评1次,资料收集时间点共计11个。首次基线调查以纸质形式开展,内容包括人口学及疾病生理资料、自我护理能力、社会支持、焦虑、抑郁和健康生活方式和呼吸道症状;后续仅调查呼吸道症状,并以问卷星或电话随访的形式收集资料。本研究T0时共纳入120例患者进行随访,随访期间分别有1人(T2)、2人(T4)、3人(T5)拒绝继续随访并退出研究,其余114例患者完成6个月随访,样本流失率为5%。
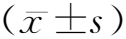
2 结果
2.1研究对象的一般资料 见表1。对6例流失样本和114例分析样本之间的年龄、性别、文化程度、家庭月收入、是否患有合并症以及自我护理能力、社会支持程度、健康促进生活方式、焦虑和抑郁得分进行基线比较,差异均无统计学意义(P>0.05),不影响本研究的顺利进行和结果的推论。

表1 研究对象的一般资料(n=114)
2.2研究对象的心理/社会和环境因素得分 见表2。
2.3肺癌免疫治疗患者呼吸道症状的严重程度 肺癌免疫治疗患者呼吸道症状的严重程度普遍较轻,以“轻微”为主。在纳入数据分析的114例患者中,有5例患者在随访期间出现免疫检查点抑制剂相关肺炎,发生率约为4.4%,会伴随咳嗽和(或)呼吸急促加重;有0.9%~21.9%的患者在T1~T10未能填写问卷,作缺失值处理。数据缺失的原因包括:(1)随访时间已到但未能联系到患者。(2)因疾病进展而更换治疗方案并停用免疫药。(3)因身体状态差而停止抗肿瘤治疗。(4)因感染新冠病毒,症状严重而未填写问卷。(5)患者去世。研究对象不同时间点咳嗽和呼吸急促的严重程度,见表3。

表3 研究对象咳嗽和呼吸急促的严重程度(n=114)
2.4肺癌免疫治疗患者呼吸道症状的变化轨迹
2.4.1咳嗽 咳嗽严重程度的模型拟合评价指标,见表4。取3个类别时,AIC、BIC和aBIC的值最小,且BLRT的P值为0.007,说明3类别模型优于2类别模型,因此最终保留3个类别的模型。

表4 咳嗽各类别模型拟合评价指标
咳嗽严重程度的变化轨迹,见图1。类别组1共7例(6.1%),截距和斜率的均值分别为2.033(P<0.01)和0.021(P=0.247),表明患者在T0时存在中度咳嗽;图中轨迹显示患者的咳嗽在首次用药后9周内随时间逐渐缓解,之后又逐渐加重,因此将类别1命名为“中度咳嗽缓解-加重组”,其中有2例发生CIP,3例在12~15周时感染新冠病毒。类别组2共83例(72.8%),截距和斜率的均值分别为0.568(P<0.01)和-0.019(P<0.01),表明患者咳嗽的初始程度较轻,治疗期间呈现缓慢下降的趋势,故命名为“轻度咳嗽缓解组”。类别组3共24例(21.1%),截距和斜率的均值分别为0.945(P<0.01)和0.003(P=0.680),结合图中轨迹变化,患者咳嗽的变化趋势较为平缓,稳定维持在轻度水平,故将类别3命名为“轻度咳嗽维持组”。
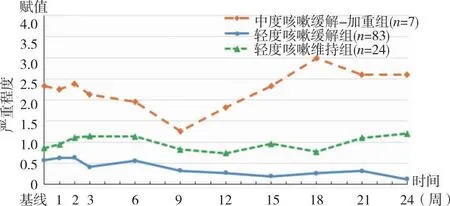
图1 咳嗽严重程度的变化轨迹
2.4.2呼吸急促 呼吸急促各类别模型拟合评价指标,见表5。结果显示,从1个类别增加到4个类别时,信息指数随着类别数量的增加而减小。4个类别模型的类别概率差异较大,最小为0.044,对应的人数为5,考虑模型的可解释性与实际意义,最终保留3个类别的模型。

表5 呼吸急促各类别模型拟合评价指标
呼吸急促严重程度的变化轨迹,见图2。类别组1共15人(13.2%),截距和斜率的均值分别为1.581(P<0.01)和-0.057(P<0.01),表明患者初始即存在轻中度呼吸急促,呈负增长趋势,因此将类别1命名为“轻中度呼吸急促缓解组”。类别组2共9人(7.9%),截距和斜率的均值分别为1.052(P<0.01)和0.080(P<0.01),表明患者呼吸急促的初始水平为轻度,呈正向增长趋势,故将类别2命名为“轻度呼吸急促加重组”,其中有2人发生CIP,1人发生免疫性心肌炎,3人感染新冠病毒。类别组3共90人(78.9%),截距和斜率的均值分别为0.295(P<0.01)和0.000(P=0.916),表明呼吸急促的初始水平很低且无增长趋势,将类别3命名为“极轻度呼吸急促维持组”。
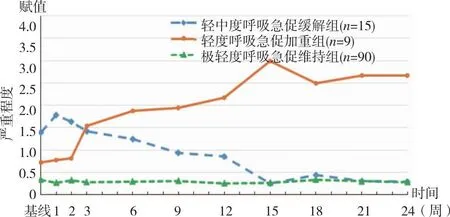
图2 呼吸急促严重程度的变化轨迹
2.5肺癌免疫治疗患者呼吸道症状轨迹类别的影响因素
2.5.1咳嗽 对咳嗽三类别组患者的一般资料以及自我护理能力、社会支持、焦虑、抑郁和健康促进生活方式资料进行单因素分析,结果有统计学意义(P<0.1)的指标为有无远处转移、谷丙转氨酶(ALT)和谷草转氨酶(AST),见表6。将这3个指标作为自变量,咳嗽3类别轨迹作为因变量纳入多分类logistic回归分析,赋值方式:中度咳嗽缓解-加重组=1;轻度咳嗽缓解组=2;轻度咳嗽维持组=3。加入自变量后,回归模型的-2对数似然值(-2LL)比只有常数项的值更小(151.73<166.536),似然比检验P值为0.022,模型拟合较好。回归结果显示:以“轻度咳嗽维持组”为参照,有远处转移的患者归入中度咳嗽缓解-加重组的概率比无远处转移的患者低93.5%(OR=0.065,P=0.010),见表7。

表6 咳嗽轨迹类别的单因素分析结果(n=114)

表7 咳嗽轨迹类别的logistic回归分析结果(n=114)
2.5.2呼吸急促 呼吸急促三类别组的单因素分析结果中,差异有统计学意义(P<0.1)的因素为中性粒细胞与淋巴细胞比值(NLR)、焦虑和抑郁,见表8。将以上因素作为自变量、呼吸急促轨迹类别作为因变量纳入多分类logistic回归分析。赋值方式:轻中度呼吸急促缓解组=1,轻度呼吸急促加重组=2;极轻度呼吸急促维持组=3。回归模型的-2LL值为130.54,小于只有常数项的值(149.10),似然比检验P值为0.005,模型拟合较好。回归结果显示:以极轻度呼吸急促维持组为参照,NLR越高的患者归为轻中度呼吸急促缓解组的概率越高(OR=1.458,P=0.003),见表9。

表8 呼吸急促轨迹类别的单因素分析结果(n=114)

表9 呼吸急促轨迹类别的logistic回归分析结果(n=114)
3 讨论
3.1肺癌免疫治疗患者咳嗽和呼吸急促的纵向变化规律 咳嗽和呼吸急促作为呼吸系统症状,其发生发展既与肺癌疾病本身有关,也与免疫检查点抑制剂治疗引发的免疫相关性肺炎有关[23]。本研究通过GMM判别出咳嗽和呼吸急促的严重程度均有3条变化轨迹,具体为“中度咳嗽缓解-加重组”“轻度咳嗽缓解组”和“轻度咳嗽维持组”,患者所占比例分别为6.1%、72.8%和21.1%;呼吸急促的严重程度有3条变化轨迹:“轻度呼吸急促加重组”“轻中度呼吸急促缓解组”和“极轻度呼吸急促维持组”,患者所占比例分别为7.9%、13.2%和78.9%。这2个症状的变化轨迹存在2个共同点:(1)大部分患者的咳嗽和呼吸急促均以轻度维持为主,说明在免疫治疗前伴有轻微呼吸道症状的肺癌患者由于疾病原因症状会长期存在,免疫治疗所导致的呼吸道症状程度在可接受范围内。(2)少数患者会在首次免疫治疗9周后出现症状加重并维持在中、重度水平,与发生免疫检查点抑制剂相关肺炎(checkpoint inhibitor-related pneumonitis,CIP)、免疫性心肌炎和新冠肺炎有关。张倩等[6]回顾性分析38例发生CIP的恶性肿瘤患者的临床资料,结果显示从使用ICIs到发生CIP的中位时间为72.5 d(约为10周),24例肺癌患者发生CIP的中位时间为54.5 d(约为8周),发生CIP时常见的伴随症状为咳嗽(29例)和呼吸困难(27例)。本研究调查的咳嗽和呼吸急促加重的时间与该研究结果基本一致。
对于“中度咳嗽缓解-加重组”的患者,其在用药前就已存在中度咳嗽,在第1个治疗周期后有所缓解,9周之后不断加重至重度水平。对于“轻度呼吸急促加重组”的患者,其呼吸急促的严重程度在首次用药后2周和12周出现较大幅度的增长。这提示对于用药前已存在中度咳嗽和轻度呼吸急促的患者,医护人员应在用药后约9周时(即3次用药之后)需要特别关注患者的咳嗽情况,及早用药干预。对于“轻中度呼吸急促缓解组”的患者,呼吸急促会在首次用药后1周出现小幅度上升,而后又逐渐减轻,这可能与首次接受免疫治疗影响其心肺功能而患者不能适应有关。建议医护人员在用药前嘱咐这类患者在用药后1~2周以休息为主,避免较为剧烈的活动,以免呼吸急促加重或出现呼吸困难。
3.2肺癌免疫治疗患者发生呼吸道症状的影响因素探索 本研究结果显示:与轻度咳嗽维持组相比,有远处转移的患者归入中度咳嗽缓解-加重组的概率比无远处转移的患者低93.5%(OR=0.065)。探其原因,分析可能与肿瘤恶性程度相关,该组患者较早出现远处转移,而肺部组织局部侵犯的范围可能与咳嗽严重程度的相关性更大。Chi等[24]对74例支气管肺神经内分泌肿瘤患者的临床和病理资料进行回顾性分析,结果发现咳嗽是初始症状,远处转移是不良预后因素(P<0.006)。因此,尚需要多中心、大样本的研究进一步验证肺部组织局部侵犯程度对肺癌免疫治疗患者咳嗽症状的影响。
本研究结果发现:中性粒细胞与淋巴细胞比值(NLR)是影响肺癌免疫治疗患者呼吸急促变化规律的因素。中性粒细胞与淋巴细胞比值为外周血中性粒细胞计数与淋巴细胞计数的比值,反映了机体的免疫系统状态,即炎症反应与免疫反应的平衡,其数值升高代表机体处于高炎症反应状态[25]。本研究多分类logistic回归分析结果显示:相较于“极轻度呼吸急促维持组”,NLR越高,患者为“轻中度呼吸急促缓解组”的概率越高(OR=1.458,P=0.003),即在首次用药后9周内发生轻、中度呼吸急促的可能性越大,尤其是会在用药后1周出现呼吸急促加重的情况。处于高炎症反应状态的患者,其呼吸道症状加重可能与免疫治疗引发的CIP有关。韩利会等[26]回顾性分析77例接受行ICIs治疗的晚期肺癌患者的临床资料,结果显示CIP组患者基线时的NLR高于非CIP组,差异显著(P=0.021),ROC曲线显示NLR对CIP的预测价值较高。一项纳入25篇文献和6 696例NSCLC患者的meta分析[27]结果同样显示,NLR升高是发生免疫相关不良反应的危险因素(OR=1.046;95%CI:1.006~1.088)。血常规是临床上患者免疫治疗前的常规检查项目,NLR容易获得,因此建议医护人员用治疗前后关注患者的NLR水平,以识别CIP和呼吸急促发生的高危人群。
本研究呼吸急促轨迹类别的单因素分析结果显示:3类别组之间抑郁评分差异有统计学意义(P=0.025),这说明抑郁对患者的呼吸急促有一定的影响,而logistic回归分析结果不显著的原因可能与样本缺失值较多有关。焦婷婷等[28]采用叙事护理方案,对16例肺癌患者的负性情绪进行干预,对照组16例患者采用常规护理方案;其研究结果表明,干预后干预组的焦虑、抑郁评分以及呼吸困难严重程度评分均低于对照组,差异有统计学意义。该研究结果在一定程度上也揭示了抑郁情绪和肺癌患者呼吸困难的相关性。由此可见,抑郁可能是呼吸急促或呼吸困难的潜在影响因素和可干预变量。建议医护人员在用药前评估患者的抑郁水平,关注有抑郁倾向患者的呼吸状况,及时给予有效治疗。
4 小结
本研究基于GMM识别出肺癌免疫治疗患者咳嗽的和呼吸急促的3条变化轨迹,绝大多数患者的咳嗽和呼吸急促均以轻度维持为主,这说明本研究中肺癌免疫治疗未普遍引起严重的呼吸道症状。本研究从人口学、疾病生理、心理、社会和生活方式等方面筛选呼吸道症状的影响因素,对癌免疫治疗患者呼吸道症状的早期识别进行了初步探索,也提供了新思路。但本研究存在以下局限性:(1)由于疫情影响,导致本研究在随访过程中有较多缺失数据。(2)因经费和时间的限制,本研究的研究对象来自于同一家三甲肿瘤专科医院,样本的代表性可能存在一定的局限性。
