两种螯合剂对钴胁迫下紫花苜蓿种子萌发及钴富集的影响
2024-01-11伏毅,王艳,高鹏,黄敏,陈浩
伏 毅,王 艳,高 鹏,黄 敏,陈 浩
(四川省原子能研究院, 四川 成都 610101)
随着工业技术的发展,重金属从采矿、冶金、制造业、农业等人类生产活动中释放到环境中,造成土壤、水体、空气污染,成为威胁全球环境、食品安全的热点问题。利用植物对重金属污染土壤进行生态恢复和植物修复是一种经济有效的环境治理技术,目前得到广泛的研究。紫花苜蓿(Medicago sativa)是豆科苜蓿属多年生草本植物,抗旱性强,具有良好的抗逆性特点,已有报道紫花苜蓿对重金属具有一定的耐性和累积作用[1],是一种具有潜力的重金属污染土壤修复植物[2-3]。然而,在重金属胁迫条件下,紫花苜蓿生长往往受到抑制,其生态恢复和修复效果受到影响。如何通过人工干预的方法降低重金属对紫花苜蓿的影响,可以使紫花苜蓿在污染土壤上正常生长,提高污染土壤生态恢复率,具有重要的研究意义。
钴(Co) 是生物体所需的有益元素,是维生素B12的重要组成部分[4],也是重金属元素之一。随着电动汽车产业的蓬勃发展,含Co 电池被大量使用,且保持快速增长趋势,导致Co 引起环境污染的风险增高[5]。此外,Co 矿开采、精炼、加工,含Co 化肥的过量使用,使释放到环境中的Co 含量逐年增加。过量的Co 进入农业环境中后,对农作物生长环境造成一定程度的污染,能够直接或间接通过食物链威胁人类的健康[6]。我国已有Co 污染的相关报道,戴燕燕等[7]研究表明黄河中段河流阶地土壤中Co 均处于重度污染状态,姚成斌等[8]报道了贵州遵义松林Ni-Mo 多金属矿区,部分旱地土壤中Co 存在重度污染,导致植物生长受抑制、农作物减产。张虎等[9]研究表明,Co 胁迫能对紫花苜蓿产生毒性效应,能显著降低紫花苜蓿种子的发芽势、发芽率、发芽指数及活力指数,使紫花苜蓿幼苗抗氧化系统活性下降,活性氧清除能力降低,膜脂过氧化程度加剧,从而抑制了紫花苜蓿种子萌发及幼苗生长。同时, Co 胁迫能降低植物体内叶绿素含量及叶绿素合成相关基因的表达,对植物光合作用产生负面影响[10-11];能抑制植物固氮和氮素同化[12]、改变植物渗透调节物质[9]等。Co 对植物的毒性作用十分显著,但如何通过外源物质减轻Co 的毒性效应的报道十分有限,值得进一步研究。
乙二胺四乙酸(Ethylene diamine tetraacetic acid,EDTA)、乙二醇双(2-氨基乙基醚) 四乙酸(ethylene glycol-bis (β-aminoethyl ether)-N, N, N', N'-tetraacetic acid,EGTA)是重要的金属离子螯合剂,能与碱金属、稀土元素和过渡金属等形成稳定的水溶性络合物,常被用于重金属污染土壤化学淋洗和重金属离子活化剂[13]。有研究表明,适当浓度的EDTA、EGTA能增加土壤中重金属的生物有效性,促进植物对重金属的吸收,降低重金属对植物的毒性,增加植物的生物量[14],也能增加植物的光合速率、谷胱甘肽、植物螯合肽的含量[15],在植物修复重金属污染土壤中,能够有效提高植物对重金属的积累量。尽管如此,在Co 胁迫条件下,外源添加EDTA、EGTA对植物生长及重金属富集的研究报道较少。鉴于此,本研究通过添加外源EDTA、EGTA,初步探讨EDTA、EGTA 对Co 胁迫下紫花苜蓿种子萌发的影响,分析EDTA、EGTA 对缓解Co 胁迫抑制植物生长的机制,为螯合剂在植物修复Co 污染环境中的应用提供理论依据。
1 材料与方法
1.1 种子萌发及处理
1.1.1 消毒
紫花苜蓿(威纳尔)种子用自来水冲洗,除去杂质和干瘪的种子,再用蒸馏水反复清洗2~3 遍后,用0.05%的次氯酸钠溶液浸泡 15 min,进行消毒处理,然后用无菌水洗净备用。
1.1.2 发芽
将两层定性滤纸铺于直径9 cm、高1.2 cm的培养皿(已灭菌)中,加入5 mL 的处理液作为发芽床,放置经过消毒的紫花苜蓿种子,于光照培养箱中(25 ℃,前2 d 为暗培养,第3 天开始光照/黑暗12 h/12 h)培养,每个培养皿中放入30 粒种子,每个处理设置3 个平行。加入处理液开始培养当天记作第0 天,于第2 天再加入5 mL 处理液,第4 天对幼苗进行收集,测定其长度、金属含量及各项生理指标。每个试验独立重复3 次。
1.1.3 材料处理
首先,采用不同浓度CoCl2溶液(0.1、0.2、0.5、0.7、1.0、2.0 mmol·L-1)处理紫花苜蓿种子,测定不同处理下种子发芽率、发芽指数、幼苗长度,选定幼苗长度为对照(无CoCl2处理)一半时的Co 浓度为半抑制浓度(0.7 mmol·L-1CoCl2),作为Co 胁迫浓度,用于下一步研究外源添加EDTA、EGTA 对Co 胁迫紫花苜蓿种子萌发的影响。其次,在Co 胁迫条件下,外源添加不同浓度EDTA (0.1、0.2、0.5、0.8、1.0、 2.0 mmol·L-1)、 EGTA (0.1、0.2、0.5、1.0、2.0、5.0 mmol·L-1),测定不同处理下种子发芽率、幼苗长度,观察EDTA、EGTA 对Co 胁迫下种子萌发及幼苗生长的影响(前期试验发现由于高浓度的EDTA、EGTA 对植物表现出毒性效应,抑制种子萌发和幼苗生长,且EDTA 的毒性作用比EGTA 更大,因此设置了不同的浓度梯度试验),筛选出具有最佳恢复效果的EDTA、EGTA 浓度分别为0.8 和1.0 mmol·L-1。最后,测定对照、Co 胁迫(0.7 mmol·L-1)、Co 胁 迫(0.7 mmol·L-1) + EDTA (0.8 mmol·L-1)、Co胁迫(0.7 mmol·L-1) + EGTA (1.0 mmol·L-1) 4 个处理下幼苗体内的超氧阴离子产生速率、超氧化物歧化酶活性、MDA 含量及Co 含量。
1.2 种子发芽率及发芽指数计算方法
种子置床后第1~4 天,每天统计发芽种子数,计算发芽率(%)和发芽指数。
式中:Gt为时间t的发芽数,Dt为相应的发芽天数。
1.3 幼苗长度测定
种子发芽4 d 后,选择每个培养皿中最高的10 株紫花苜蓿幼苗,用标尺测定幼苗的长度。
1.4 超氧阴离子产生速率、超氧化物歧化酶活性和丙二醛含量的测定
不同处理的紫花苜蓿幼苗各取0.5 g,加入2.5 mL 0.05 mol·L-1磷酸缓冲液(pH = 7.8)和少量石英砂于4 ℃研磨,离心力11 000 × g,4 ℃,离心10 min。上清备用。按照羟胺还原法,测定超氧阴离子产生速率[16]。利用SOD 抑制氮蓝四唑(NBT)的光还原作用来测定SOD 酶的活力[17],为进一步证明Co 对SOD 酶活性的影响是否直接通过与SOD 结合进而抑制了SOD的活性,采用体外试验,在提取的SOD 酶溶液中,加入不同浓度的Co (0.05、0.2、0.7 mmol·L-1) 处理20 min 后,测定SOD 酶的活性,测定方法同上。利用TCA-TBA 法测定MDA 含量[18-19]。
1.5 金属含量测定
将培养4 d 的紫花苜蓿幼苗取出,经蒸馏水冲洗6 遍,去离子水冲洗3 遍后于105 ℃烘30 min 杀青,80 ℃烘至恒重[20],称取0.2 g,按照国标GB/T14609—2008 湿法消解,消解液用火焰原子吸收分光光度法测定其金属元素含量[21]。用量筒测定取出幼苗后的残余培养液体积,并用原子吸收分光光度法测定钴浓度,按照残余钴量=残余培养液体积×钴浓度计算残余钴量,按照去除率=(添加量-残余钴量)/添加量×100%计算去除率。
1.6 数据处理
数据以平均值 ± SD 表示,选用SPSS 21.0 和Excel 2019 软件对数据进行统计分析和处理,采用Dancun 法对各测定数据进行多重比较(P< 0.05),Excel 2019 完成制图。
2 结果与分析
2.1 EDTA、EGTA 对Co 胁迫紫花苜蓿种子萌发的影响
如表1 所示,在0.1~1.0 mmol·L-1的Co 溶液中萌发的紫花苜蓿种子,其发芽率(除第3 和4 天)、发芽指数均低于对照,但在0.1~0.7 mmol·L-1Co 处理条件下,各处理间的差异并不显著,1.0 mmol·L-1的Co 溶液处理后,种子发芽率(除第3 天)、发芽指数显著低于对照(P< 0.05),而在2.0 mmol·L-1的Co 溶液处理后,紫花苜蓿种子基本上不发芽(因为数据均为0,故表1 未列出)。0.1~1.0 mmol·L-1的Co 溶液中紫花苜蓿幼苗长度,随着Co 浓度增加而逐渐降低,在0.7 mmol·L-1Co 作用下,紫花苜蓿幼苗长度为对照的一半,发芽率表现出滞后性,并且发芽率低于对照(表1),因此,选定0.7 mmol·L-1Co 为半抑制浓度,作为Co 胁迫浓度,用于下一步测定EDTA、EGTA 对Co 胁迫紫花苜蓿种子萌发的影响。
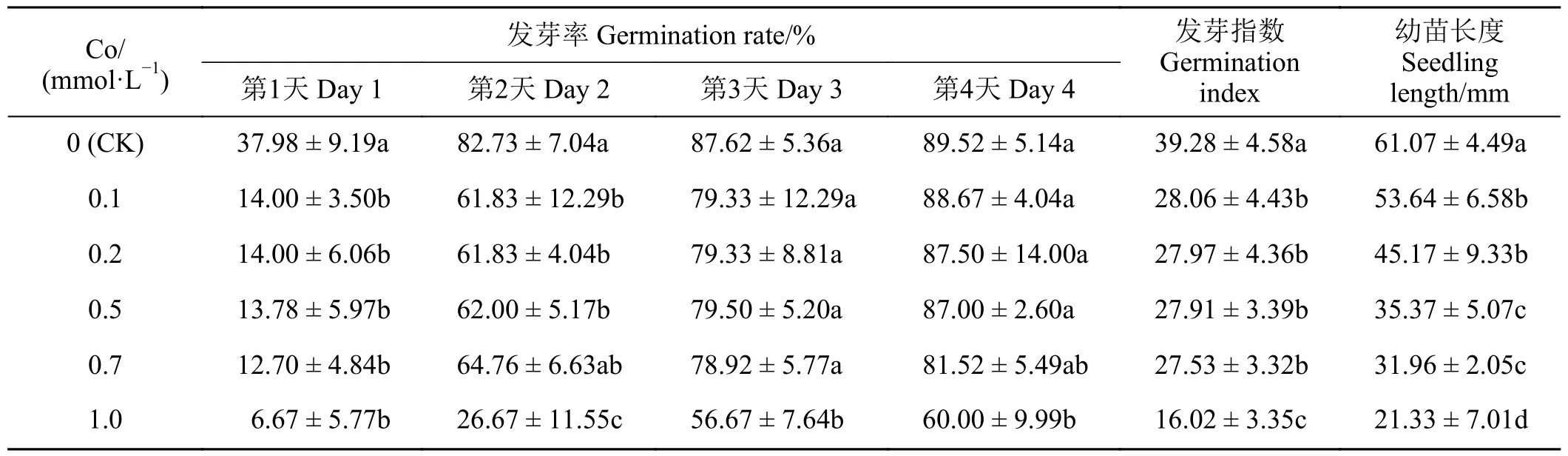
表1 不同浓度Co 对紫花苜蓿种子萌发的影响Table 1 Effects of different Co concentrations on alfalfa seed germination
如表2、表3 所列,在Co 胁迫条件下,加入不同浓度的EDTA、EGTA 对紫花苜蓿种子的萌发呈现一定的恢复效果。加入不同浓度的EDTA、EGTA的种子发芽率在发芽第1 天没有显著变化,但是从第2 天开始均表现出一定的恢复效果,且随着EDTA、EGTA 浓度的升高,种子发芽率基本上呈现出先升高后降低的趋势。其中,0.5~1.0 mmol·L-1的EDTA 对Co 胁迫种子发芽率的恢复效果较好,在0.5~1.0 mmol·L-1的EGTA 对Co 胁迫种子发芽率的恢复效果最好。随着加入的EDTA、EGTA 的浓度升高,对Co 胁迫下种子发芽指数的影响呈现出先升高后降低的趋势,其中0.8、1.0 mmol·L-1EDTA和1.0、2.0 mmol·L-1EGTA 的恢复效果最好。
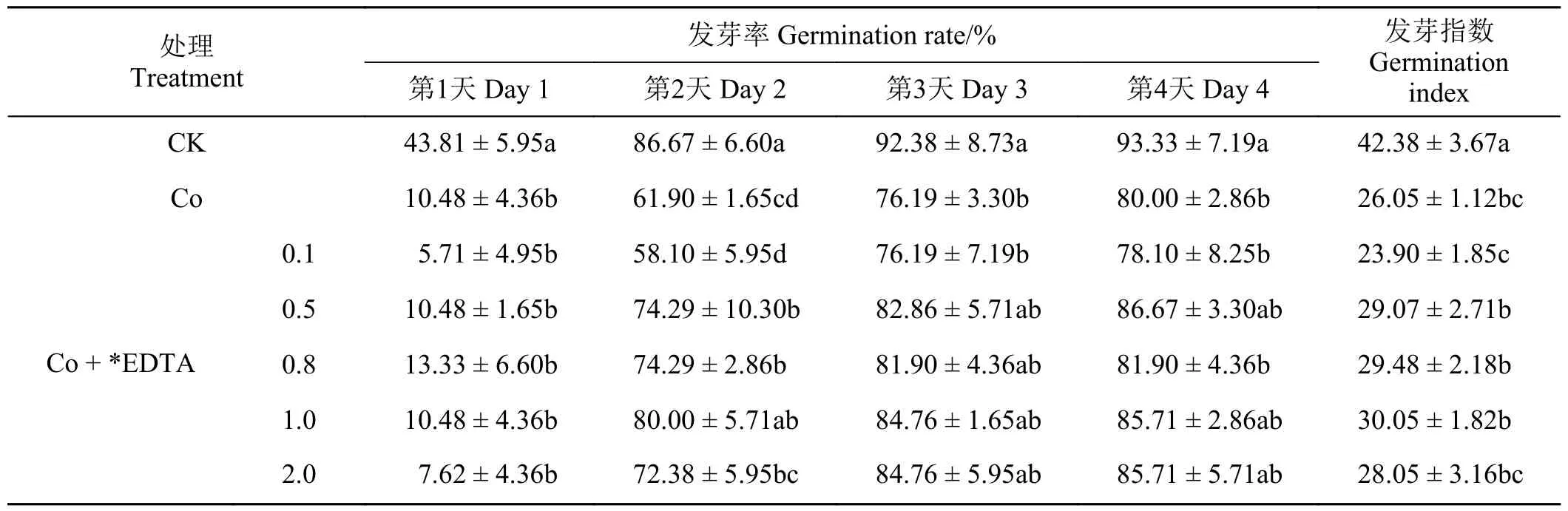
表2 不同浓度EDTA 对Co 胁迫下紫花苜蓿种子萌发的影响Table 2 Effects of different EDTA concentrations on seed germination under Co stress
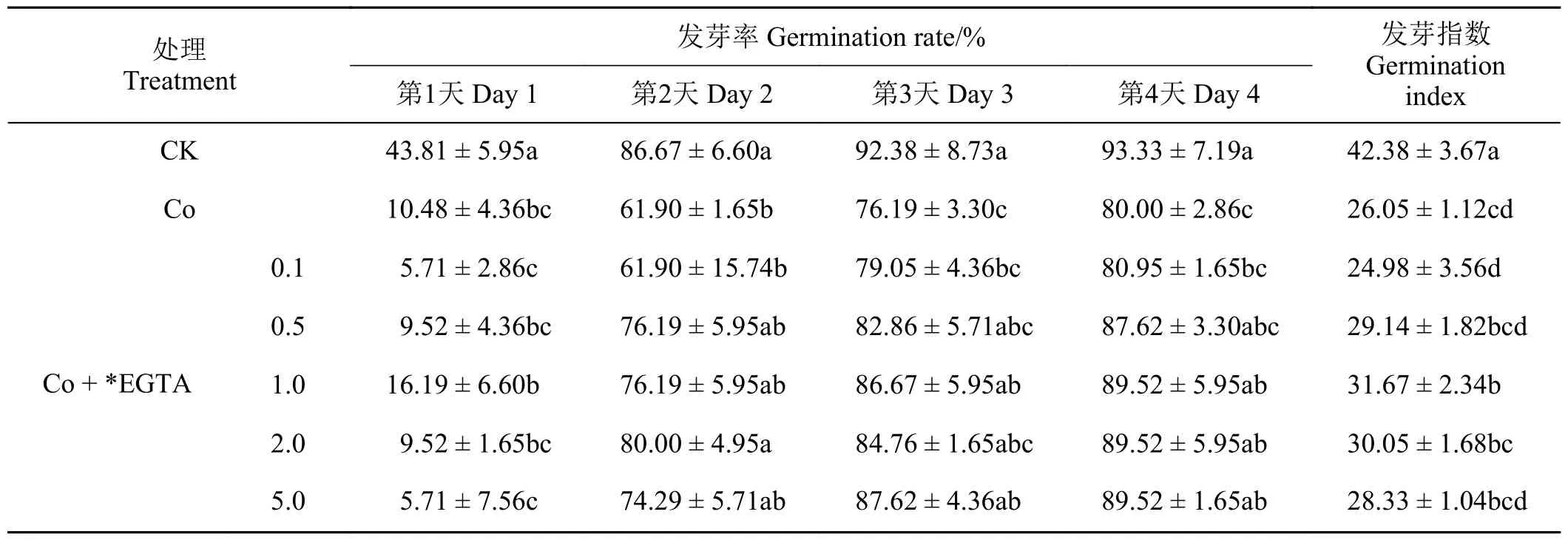
表3 不同浓度EGTA 对Co 胁迫下紫花苜蓿种子萌发的影响Table 3 Effects of different EGTA concentrations on alfalfa seed germination under Co stress
如图1 所示,不同浓度EDTA、EGTA对Co 胁迫幼苗长度的影响均呈现出先促进、后抑制的趋势,随着EDTA、EGTA 浓度的增加,幼苗长度先升高后降低,0.8 mmol·L-1EDTA 对Co 胁迫种子萌发的恢复效果最好,恢复到对照的72.4%,平均长度高出Co 胁 迫 条 件 下 幼 苗12.3 mm。1.0、2.0 mmol·L-1EGTA 对Co 胁迫幼苗长度的恢复效果较好,分别达到对照的77.4%和77.8%,平均长度分别高出Co 胁迫组15.3 和15.5 mm。综合考虑,EDTA、EGTA 对Co 胁迫幼苗的发芽率、发芽指数和长度的影响后,选择0.8 mmol·L-1EDTA 和1.0 mmol·L-1EGTA 作为恢复Co 胁迫种子萌发的最佳浓度,测定在该浓度处理下紫花苜蓿幼苗体内超氧阴离子产生速率、超氧化物歧化酶活性、MDA 含量及Co 含量。
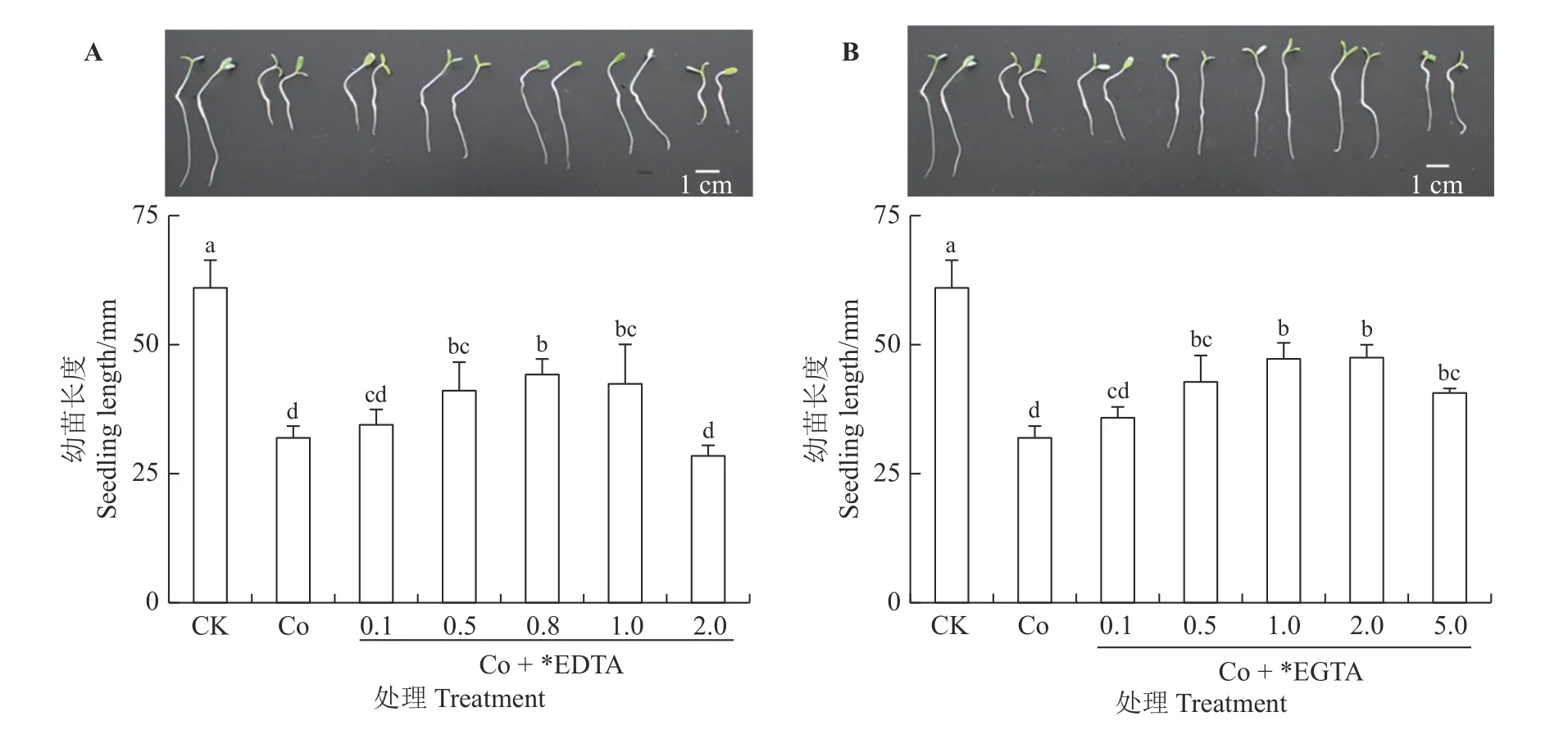
图1 不同浓度EDTA、EGTA 对Co 胁迫下紫花苜蓿幼苗长度的影响Figure 1 Effects of different EDTA, EGTA concentrations on seedling length in Co-stressed alfalfa seedlings
2.2 EDTA 和EGTA 对Co 胁迫紫花苜蓿幼苗中超氧阴离子产生速率的影响
如图2 所示,Co 胁迫较CK 显著增加紫花苜蓿幼苗中超氧阴离子产生速率(P< 0.05),增加了84%,外源EDTA、EGTA能显著恢复到对照水平。幼苗中的超氧阴离子产生速率显著降低,与Co 胁迫相比,分别显著下降41%和46% (P< 0.05)。
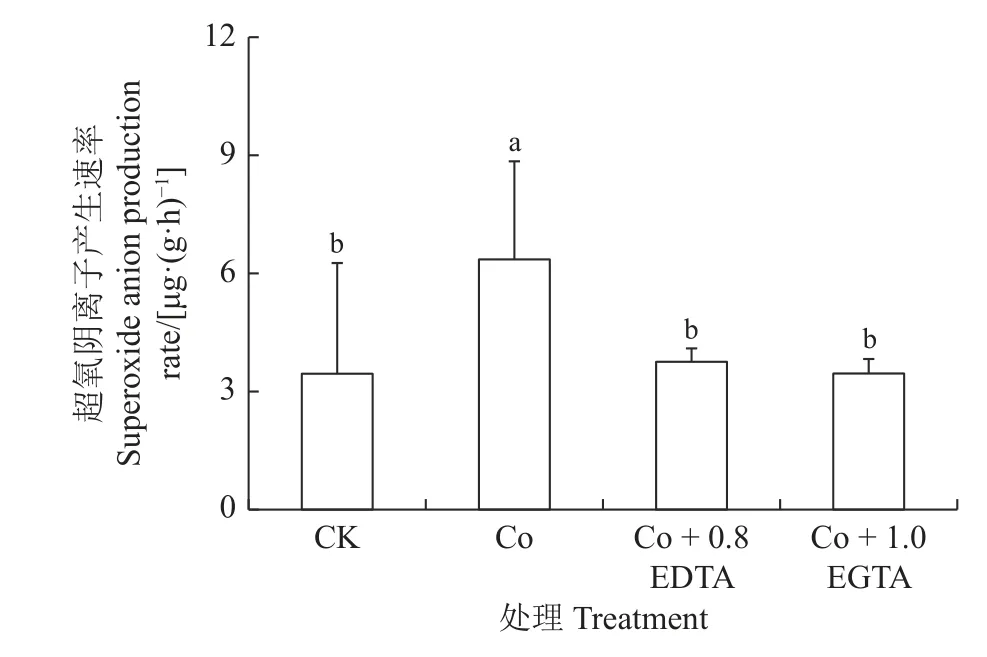
图2 EDTA, EGTA 对Co 胁迫紫花苜蓿幼苗中超氧阴离子产生速率的影响Figure 2 Effects of EDTA, EGTA on superoxide anion production rate in Co-stressed alfalfa seedlings
2.3 EDTA 和EGTA 对Co 胁迫紫花苜蓿幼苗中SOD 活性的影响
如图3A 所示,Co 胁迫较CK 显著降低紫花苜蓿幼苗中的SOD 活性(P< 0.05),仅为对照的78%。外源添加EDTA 和EGTA 较Co 处理显著增加幼苗中SOD 活性,分别增加20%和9%,与对照相比,分别达到对照的93%和85%。因此,EDTA 比EGTA 具有更好的恢复效果。
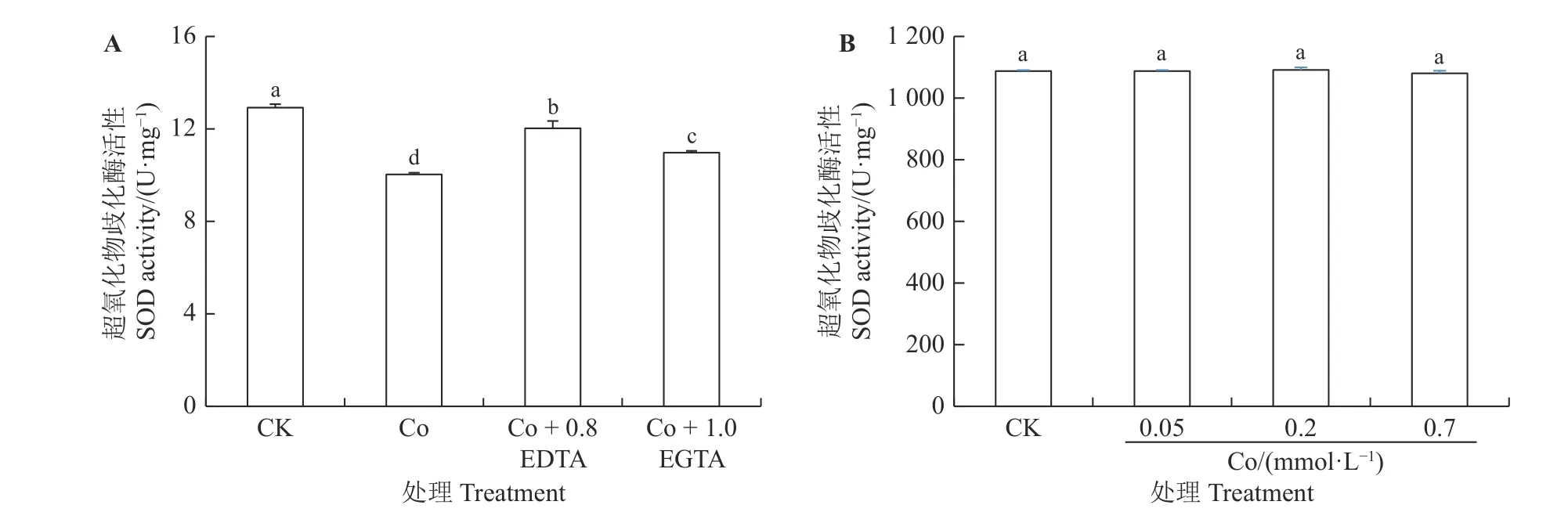
图3 EDTA、EGTA 对Co 胁迫紫花苜蓿幼苗中超氧化物歧化酶活性的影响Figure 3 Effects of EDTA, EGTA on SOD activity in Co-stressed alfalfa seedlings
采用体外试验,在提取的SOD 酶溶液中加入不同浓度Co,测定SOD酶活性的变化,如图3B所示,SOD酶溶液中加入不同浓度Co 作用后,SOD 活性没有发生变化,说明Co 抑制紫花苜蓿幼苗中SOD 活性不是Co 直接作用于SOD,而是通过其他途径抑制了酶的活性,具体作用途径有待进一步研究。
2.4 EDTA 和EGTA 对Co 胁迫紫花苜蓿幼苗中MDA 含量的影响
如图4 所示,Co 胁迫显著增加紫花苜蓿幼苗中的MDA 含量(P< 0.05),增加了30%。加入EDTA、EGTA显著降低幼苗中MDA 含量,仅为Co 胁迫条件下的65%左右,显著低于对照(P< 0.05)。

图4 EDTA、EGTA 对Co 胁迫紫花苜蓿幼苗中MDA 含量的影响Figure 4 Effects of EDTA, EGTA on MDA content in Co-stressed alfalfa seedlings
2.5 EDTA 和EGTA 对Co 胁迫紫花苜蓿幼苗中Co 含量的影响
如图5A 所示,紫花苜蓿幼苗对照组中未检测出Co含量,Co 胁迫(0.7 mmol·L-1的Co 溶液中)显著增加紫花苜蓿幼苗中Co 含量(P< 0.05),达到2 000 mg·kg-1。外源添加EDTA 和EGTA 显著降低紫花苜蓿幼苗中Co 含 量(P< 0.05),分 别 为212 和675 mg·kg-1,仅为Co 胁迫条件下的10%和31%。EGTA 处理组幼苗的Co 含量高于EDTA 处理组。Co 单独处理组残留的Co 量最低,加入EDTA 和EGTA 后残留量较CK 和Co 处理显著增加(图5B),结果与幼苗体内的含量相一致,说明紫花苜蓿幼苗对水溶液中Co 的清除能力较强,去除率达到77.46%,加入EDTA 和EGTA去除率显著降低(P< 0.05),仅有2.79%和16.61%。
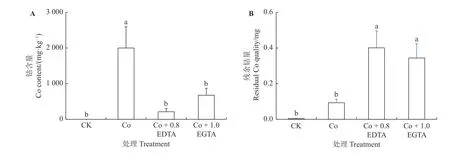
图5 EDTA、EGTA 对Co 胁迫紫花苜蓿幼苗中Co 含量的影响Figure 5 Effects of EDTA, EGTA on cobalt content in Co-stressed alfalfa seedlings
3 讨论
3.1 EDTA 和EGTA 对Co 胁迫紫花苜蓿种子萌发的影响
Co 胁迫能够抑制植物种子萌发[22]。在单子叶植物中,对水稻(Oryza sativa)种子在Co 胁迫条件下萌发的研究结果证明,Co 胁迫能够抑制水稻种子的发芽率、发芽指数、种子活力、幼苗的长度等生长指标[23]。在双子叶植物中,对绿豆(Phaseolus radiatus)种子在0.2~1.0 mmol·L-1Co浓度处理条件下萌发的研究结果证明,Co 能够延迟绿豆种子萌发、抑制幼苗生长,这种效应随钴浓度的增加而加大[24]。本研究表明,Co 胁迫对紫花苜蓿种子萌发也存在显著抑制作用(表1),0.1 mmol·L-1Co 就能引起种子发芽率降低,幼苗长度降低,0.7 mmol·L-1Co 抑制紫花苜蓿幼苗生长,长度仅为对照的一半,这与在绿豆中观察到的结果一致。
一定浓度的EDTA、EGTA 等螯合剂能够缓解重金属对植物种子萌发的抑制作用。对铜、铅复合污染黑麦草(Lolium perenne)配施2.5 mmol·L-1的EDTA 能够显著提高黑麦草种子发芽率、发芽势、根芽长,缓解铜、铅的抑制作用[25]。对铬胁迫下黄瓜(Cucumis sativus)种 子 施 加1.0 ~2.5 mmol·L-1的EDTA 可以提高种子发芽势、发芽率,缓解黄瓜种子萌发期受到的铬胁迫[26]。对镉胁迫下的鹰嘴豆(Cicer arietinum)中添加0.1 mmol·L-1的EGTA,能够有效改善鹰嘴豆幼苗的生长,缓解镉的抑制作用[27]。本研究表明,对Co 胁迫条件下紫花苜蓿种子,外源添加0.8 mmol·L-1的EDTA 或1.0 mmol·L-1的EGTA能显著恢复Co 胁迫紫花苜蓿种子的发芽率及幼苗长度,缓解Co 的抑制作用。由此可见,EDTA、EGTA 能缓解Co 胁迫对紫花苜蓿种子萌发及幼苗生长的抑制作用。
3.2 EDTA 和EGTA 对Co 胁迫紫花苜蓿幼苗中活性氧代谢平衡的影响
重金属胁迫,会导致植物体内过量地产生活性氧[28],抑制抗氧化酶活性[29]。张虎等[9]研究表明,Co 胁迫条件下,紫花苜蓿幼苗体内的超氧阴离子产生速率及膜脂过氧化产物MDA 含量均显著增加,并且随着Co 胁迫浓度的增大而升高;随着 Co 胁迫浓度的增大,紫花苜蓿幼苗叶片的SOD 活性均呈先升高后降低的趋势。本研究表明,在Co 胁迫条件下,紫花苜蓿幼苗体内超氧阴离子产生速率和MDA 含量显著增加(图2、图4),SOD 活性显著降低,说明Co 胁迫引起紫花苜蓿幼苗体内超氧阴离子积累,并降低SOD 酶活性,导致活性氧代谢平衡被打破,引发脂质过氧化,这与张虎等[9]的研究结果一致。
EDTA、EGTA 能降低重金属胁迫引起的活性氧积累、提高抗氧化系统活性。铜胁迫下,芸苔属植物欧洲油菜(Brassica napus)体内活性氧含量显著增加,SOD等抗氧化酶活性降低,外源添加EDTA 能显著恢复铜胁迫引起的这些生理指标变化[30]。外源EDTA能提高镉胁迫下土荆芥(Dysphania ambrosioides)体内SOD 及其他抗氧化酶类的活性[31]。对铅胁迫下的菠菜施用EDTA,能提高菠菜(Spinacia oleracea)的抗氧化活性,并中和活性氧[32]。对镉胁迫下的鹰嘴豆(Cicer arietinum)种子外源添加EGTA,能提高SOD 酶活性[27]。本研究表明,外源EDTA、EGTA能显著降低Co 胁迫条件下的超氧阴离子产生速率和MDA 含量(图2、图4),提高SOD 活性(图3A),说明外源EDTA、EGTA 缓解了Co 胁迫引起的活性氧积累,减轻了氧化胁迫作用。
超氧化物歧化酶含有能够与金属辅基进行结合的蛋白质结构,按照结合的金属种类可以分为CuZn-SOD、Mn-SOD、Fe-SOD、Ni-SOD[33]。由于金属离子之间可能发生替代作用,而使酶失去活性,因此本研究在体外研究了Co 对SOD 的作用,结果表明,在SOD 水溶液中加入Co 并不能直接引起SOD活性的改变(图3B),说明Co 离子不能直接作用于SOD 本身,而Co 引起的紫花苜蓿幼苗SOD 活性降低可能是其他原因引起的。韩立敏等[34]研究了在盐胁迫条件下超氧化物歧化酶基因表达出现了先增加后降低的变化,说明在一定的胁迫环境下,SOD 的基因表达受到调控,并随着胁迫程度的增加基因表达水平受到抑制,这可能是SOD 酶活性降低的原因之一。对Co 胁迫条件下SOD 基因表达水平,以及上下游调控机制需更进一步的研究。
3.3 EDTA 和EGTA 对紫花苜蓿吸收Co 的影响
目前,较多研究表明,在重金属污染土壤中加入EDTA、EGTA 等金属离子螯合剂能够促进植物吸收重金属元素,提高对土壤的清除能力。例如,对生长在重金属污染中的高粱(Sorghum bicolor)和燕麦(Avena sativa)施加EDTA,能够显著提高根、芽中的镉、铬和铅的浓度[35];对生长在镉和砷混合污染农田上的苍耳(Xanthium strumarium)施加EDTA,能提高苍耳植株对镉、砷的总积累量[36];对锌胁迫条件下的紫花苜蓿施加EDTA,有助于提高紫花苜蓿的叶片Zn 含量[37];对生长在重金属污染耕作土壤上的青葙(Celosia argentea)施加一定浓度的EGTA,能显著提高青葙对镉、铅、锌、铜的吸收富集[38]。但是,也有施加EDTA、EGTA 等螯合剂对植物吸收重金属没有影响或降低吸收量的报道。例如,对生长在镉、锌、铅和铜复合污染土壤上的鬼针草(Bidens pilosa)施加EGTA,虽能增加鬼针草不同部位锌、铅和铜的吸收量,但是对鬼针草吸收镉的影响效果不佳[39];对生长在重金属污染土壤中的东南景天(Sedum alfredii)施加EDTA,显著降低了对铅和锌的吸收,但是对镉的吸收没有显著影响[15]。本研究表明,采用溶液培养法,对Co 胁迫条件下的紫 花 苜 蓿 施 加0.8 mmol·L-1EDTA 和1 mmol·L-1EGTA,显著降低了紫花苜蓿对Co 的吸收富集(图5),缓解了Co 对紫花苜蓿种子萌发的抑制作用。
4 结论
综上,Co 胁迫条件下紫花苜蓿幼苗中大量累积Co,达到2 000 mg·kg-1干重,使种子萌发和幼苗生长受到严重的抑制。Co 胁迫条件下紫花苜蓿幼苗中的超氧阴离子产生速率增加、SOD 酶活性降低、MDA 含量增加,使幼苗中活性氧代谢失衡,这是Co 胁迫引起种子萌发、生长受抑的原因之一。通过外源添加EDTA、EGTA 能够降低紫花苜蓿幼苗中的Co 含量,减少超氧阴离子产生速率,恢复SOD 酶活性,降低MDA 含量,进而缓解Co 胁迫对紫花苜蓿种子萌发的抑制作用。
