氮磷添加下典型温带、亚热带森林土壤氮循环功能基因丰度和微生物群落属性数据集
2024-01-11贾彦茹唐玉倩张心昱于贵瑞王辉民陈伏生田大栓张雷明
贾彦茹,唐玉倩*,张心昱,于贵瑞,王辉民,陈伏生,田大栓,张雷明
1.中国地质大学,地理与信息工程学院,区域生态与环境变化重点实验室,武汉 430074
2.中国科学院地理科学与资源研究所,生态系统网络观测与模拟重点实验室,北京 100101
3.中国科学院大学,资源与环境学院,北京 100190
4.江西农业大学,林学院,南昌 330029
引 言
中国东部森林生态系统是大气氮沉降最严重的区域之一。大气氮沉降能够造成土壤氮含量变化、酸化、有机碳含量变化和磷限制[1-2]。氮和磷是调节植物和土壤微生物生长及活性的关键限制因素[3-4]。但不同于土壤氮能够通过氮沉降和生物固氮积累,土壤磷元素的增加速率远小于氮[5]。在大气氮沉降增加背景下,磷限制在森林生态系统会进一步加剧。磷限制一方面会影响植物生长、限制生态系统生产力和减少生物多样性[6];另一方面,全球变暖影响下土壤有机质分解加速,土壤氮、磷有效性增加,这将进一步影响土壤微生物及微生物驱动的土壤养分循环[3]。有关氮磷添加对森林生态系统土壤微生物影响的数据集可以为养分循环机制研究、森林管理和环境科学研究提供数据和理论支持。
温带和亚热带森林是中国东部森林中具有典型植被和土壤养分状况差异的地区。通常认为,氮沉降在亚热带森林更严重[7],土壤相对富氮缺磷,而温带森林氮沉降相对较轻,土壤相对亚热带森林富磷缺氮[8-9]。养分状况的差异导致氮循环微生物对氮和磷添加有不同的响应[10-15]。基于温带和亚热带森林长期氮磷添加野外联网控制实验已经开展了大量基础数据调查和氮循环过程研究,但仍缺乏系统的氮循环功能微生物属性的数据集,这将严重影响我们对森林土壤氮循环驱动机制及其对全球变化响应机制的深入理解。
氮循环是陆地生态系统最重要的养分循环之一,直接影响生态系统服务和功能的稳定性[16]。土壤氮循环是由微生物驱动的相互联系的网络过程,主要包括生物固氮、矿化、硝化和反硝化。这些过程由一系列氮循环功能基因编码的酶催化[17-18]。固氮微生物可以将大气中的N2固定成NH3,这个过程是由nifH基因编码的固氮酶催化[17]。几丁质是含氮量最丰富的天然大分子之一,其分解是由chiA基因编码的几丁质酶催化[19]。硝化过程通常认为包括两个过程,即氨氧化和亚硝酸氧化[20]。氨氧化过程是自养硝化过程的限速步骤,其涉及的功能基因是氨氧化古菌和氨氧化细菌的amoA基因[20]。反硝化过程涉及一系列连续异化还原过程,逐步将NO3-还原为N2[21]。NO3-通过narG和napA基因编码的硝酸盐还原酶还原为NO2-[22]。NO2-主要通过nirK或nirS基因编码的亚硝酸盐还原酶转化为NO 或N2O[17]。NO 通过氧化氮还原酶转化为N2O。N2O 通过nosZ基因编码的氧化亚氮还原酶转化为N2[23]。靶向氮循环功能基因能够为氮循环的研究提供更直接的证据。
土壤环境和养分含量是影响氮循环微生物群落和活性的重要因素[17,24-25]。森林生态系统中,土壤理化性质和养分含量沿土壤剖面差异显著。相对于亚热带森林,温带森林土壤质地稠密、渗透性弱,溶解性养分难以从土壤表层渗透到下层,导致下层土壤养分含量远低于表层[18]。因此,氮循环微生物在表层土壤的分布可能不同于下层土壤。同时,受不同气候和植被状况的影响,氮循环微生物沿土壤剖面的分布模式在亚热带和温带森林也是不同的。
本数据集测定和整理了中国东部典型温带和亚热带森林土壤氮循环功能基因的丰度和群落属性,涉及氮磷添加联网控制实验样地和无养分添加土壤垂直剖面的样品。具体数据指标包括氮循环功能基因丰度、群落多样性和结构以及微生物活性。本数据集的创建和共享将为全球变化氮沉降和磷增加背景下森林土壤氮循环的微生物驱动机制及其模拟研究提供支持,为森林生态系统温室气体N2O的排放、氮素淋失和养分管理提供数据和依据。
1 数据采集和处理方法
本数据集涉及3 个森林样地,即长白山、千烟洲和鼎湖山,分别代表温带原生针阔混交林、亚热带杉木人工林和亚热带次生常绿阔叶混松林3 种典型森林类型。采样点基本信息、氮磷添加处理及土壤样品采集过程见表1。所有氮磷添加样地设置为完全随机区组设计。鼎湖山、长白山和千烟洲的最高氮添加量相同,均为100 kg N hm-2yr-1,旨在模拟未来氮沉降持续增加的可能影响。长白山和鼎湖山的磷添加量(100 kg P hm-2yr-1)高于千烟洲(50 kg P hm-2yr-1),但基于之前的研究结果,两个水平磷添加均显著改变了土壤理化性质和微生物丰度[11-12,25]。同时,氮磷添加样品采集时,长白山、千烟洲和鼎湖山三个样地均已施肥3 年,且三地的施肥样地采样时间均为距上次施肥30 d 左右。因此认为三地的氮磷添加设置具有可比性。
土壤样品过2 mm 筛后分小份保存。其中一份样品放于4 ℃,用于测定土壤含水量、pH、土壤NO3-、NH4+、速效磷和溶解性有机碳含量;第二份样品烘干后研磨,过0.25 mm 筛,用于测定总有机碳、总氮和总磷含量;第三份样品保存于-80 ℃,用于DNA 提取及后续的分子实验;第四份存放于4 ℃,并尽快用于测定微生物活性。
1.1 土壤理化性质测定
每个样品重复三次测定土壤理化性质。土壤pH 值使用玻璃电极测定体积比为2:5 的土:水悬浮液。土壤含水量用烘干法测定。用2 mol/L KCl 溶解提取NO3-和NH4+,并且用0.025 mol/L HCl-0.03 mol/L HN4F 溶液提取速效磷,然后用连续流动自动分析仪(Bran Lubbe, AA3, Germany)测量NO3-、NH4+和速效磷的浓度[26]。使用总有机碳分析仪(Liqui TOC II, Elementar, Germany)测定溶解性有机碳浓度。总碳和总氮的浓度使用CN 分析仪(Vario Max, Elementar, Germany)测定。土壤总磷使用H2SO4和HClO4消解,在700 nm 处用自动分光光度仪测定。土壤N2O 排放的测定采用静态箱法。气体采集时间为当日8:00–11:00,在40 min 时段内,用100 mL 注射器在0, 10, 20, 30, 40 min 时分别抽取1次气体样品,每个样方共采集5 个气样,并于采集后24 h 内完成浓度测定。施肥一周后连续采样。
1.2 氮循环功能基因丰度测定
采用Power Soil DNA Isolation Kit 试剂盒(Mo Bio, Carlsbad, CA, USA)进行土壤总DNA 提取,所提取的DNA 用微量紫外分光光度计(Nanodrop Technologies, USA)检测其浓度和纯度。DNA 保存于-20 ℃备用。利用SYBR Green Premix (TaKaRa Bio Inc.)荧光试剂,通过Eco Real-Time PCR System(Illumina)对土壤氮循环功能基因进行定量分析。氮循环各过程功能基因nifH、chiA、氨氧化古菌amoA、氨氧化细菌amoA、qnorB、narG、nirK、nirS、nosZ扩增特异引物和退火温度等信息见表2。

表2 氮循环各功能基因的功能和PCR 扩增引物信息Table 2 Functions and primer pairs for nitrogen-cycling functional genes used in PCR
1.3 氮循环功能基因高通量测序
根据表2 对功能基因进行扩增,通过琼脂糖凝胶电泳检测PCR 产物。利用QIAEX II®Gel Extraction Kit (Qiagen)对扩增产物进行回收并测定浓度,然后将PCR 产物混合,使各样品用于高通量测序的DNA 浓度一致。高通量测序委托北京新科开源基因科技有限公司完成。对测序的初步数据通过next generation sequencing toolkit (NGS version 2.3.1)进行过滤[36]。然后对干净的序列进行注释,除chiA注释信息来自NCBI 数据库(http://www.ncbi.nlm.nih.gov)外,其他功能基因注释信息来自FunGene 数据库[37]。用Vsearch 软件在97%相似度划分分类单元(OTU)[38],并舍掉数目少于2 个的OTU。通过Mothur 计算各功能基因的香浓多样性指数[39]。所有测序序列上传至NCBI Sequence Read Archive (SRA)数据库。长白山施肥样地氨氧化细菌amoA、氨氧化古菌amoA、nirS、nirK、nifH和chiA对应的序列号分别为SRR5621828、SRR5621829、SRR5621826、SRR5621827、SRR5621833、SRR5621832;千烟洲施肥样地氨氧化古菌amoA和nirK对应的序列号为SRR3342862-SRR3342865和SRR3310928-SRR3310931;鼎湖山施肥样地氨氧化细菌amoA、氨氧化古菌amoA、nirS、nirK、nifH和chiA对应的序列号分别为SRR5621830、SRR5621831、SRR5621824、SRR5621825、SRR5621835、SRR5621834;土壤剖面样品的chiA、nifH、氨氧化古菌amoA和nirS基因对应的序列号分别为SRR5533727、SRR5533729、SRR5533730、SRR5533726。
1.4 氮循环微生物潜在活性测定
土壤净硝化速率利用室内培养法测定[40]。鲜土10 g 置于100 mL 的聚乙烯瓶中,在20 °C 培养箱中培养14 d。通过最终和最初单位干土中NO3-的变化量计算土壤的净硝化速率,单位为μg NO3--N g-1soil d-1。
硝化潜势的测定采用悬浆培养法[41]。鲜土2.5 g 中加入35 mL 含1 mmol/L (NH4)2SO4的培养液,并置于30 ℃,200 rpm 震荡,黑暗中培养48 h。每隔12 h 开瓶通风20 min 保证有氧环境。在培养的第20 min、48 h 分别取5 mL 悬浆用于测定NO2-、NO3-含量。硝化潜势用μg N-(NO3-+NO2-)h-1g-1表示。
反硝化潜势的测定采用乙炔抑制法[42-43]。鲜土4 g 置于150 mL 含培养液(含KNO3:50 μg N g-1干土,葡萄糖:0.5 mg C g-1干土和谷氨酸钠:0.5 mg C g-1干土)的厌氧瓶中,震荡混匀。将厌氧瓶抽真空后持续通入N2-C2H2(90:10 体积比)的混合气,以制造厌氧环境并抑制N2O 的还原。分别在培养的初始时刻和培养后2 h 抽取气体样品,利用气相色谱仪(Agilent 7890A, USA)测定N2O 浓度。反硝化潜势用ng N-N2O h-1g-1干土表示。
固氮微生物活性的测定采用乙炔还原法[44]。鲜土10 g 置于120 mL 血清瓶中,滴加葡萄糖溶液,使土壤中的C 含量保持在1 mg C g-1土壤,密封后混匀。抽取10 %瓶中空气后注入同体积的乙炔。在28 °C 恒温黑暗培养2 d。培养结束后,抽取50 μL 气体样品,用气相色谱仪(Agilent, 7890A, USA)测定培养瓶中乙烯(C2H4)气体浓度。固氮酶活性单位用乙炔还原速率表示,单位nmol C2H4h-1g-1。
有机氮分解潜势采用MUB 底物结合微孔板荧光法测定β-1,4-乙酰基-葡糖胺糖苷酶(β-1,4-Nacetyl-glucosaminidase, NAG)活性[45]。具体操作为:取1 g 鲜土,用醋酸缓冲液充分混匀,制备土壤悬浮液,吸取200 μL 土壤悬浮液和50 μL 4-甲基伞形酮酰-乙酰基-β-D-氨基葡萄糖苷(4-MUB-Nacetyl-β-D-glucosaminide)底物于96 孔板。20 °C 黑暗中培养4 h,加入10 μL 1 mol/L 的NaOH 终止反应。标准物质是4-甲基伞型酮(4-MUB, 4-methylumbelliferyl),在365 nm 波长处激发,450 nm 波长处测定。NAG 活性的单位是nmol h-1g-1。
2 数据样本描述
本数据集集合了东部典型温带(长白山)和亚热带森林(鼎湖山和千烟洲)联网控制实验氮磷添加样地和无氮磷添加样地土壤垂直剖面中氮循环功能基因丰度、群落多样性和组成、氮循环微生物潜在活性和土壤理化性质的数据。
数据集由2 个Excel 文件组成:Excel 1 为氮循环微生物属性相关数据,Excel 2 为土壤理化性质数据。Excel 1 由7 个Sheet 组成,具体内容及字段含义见表3。
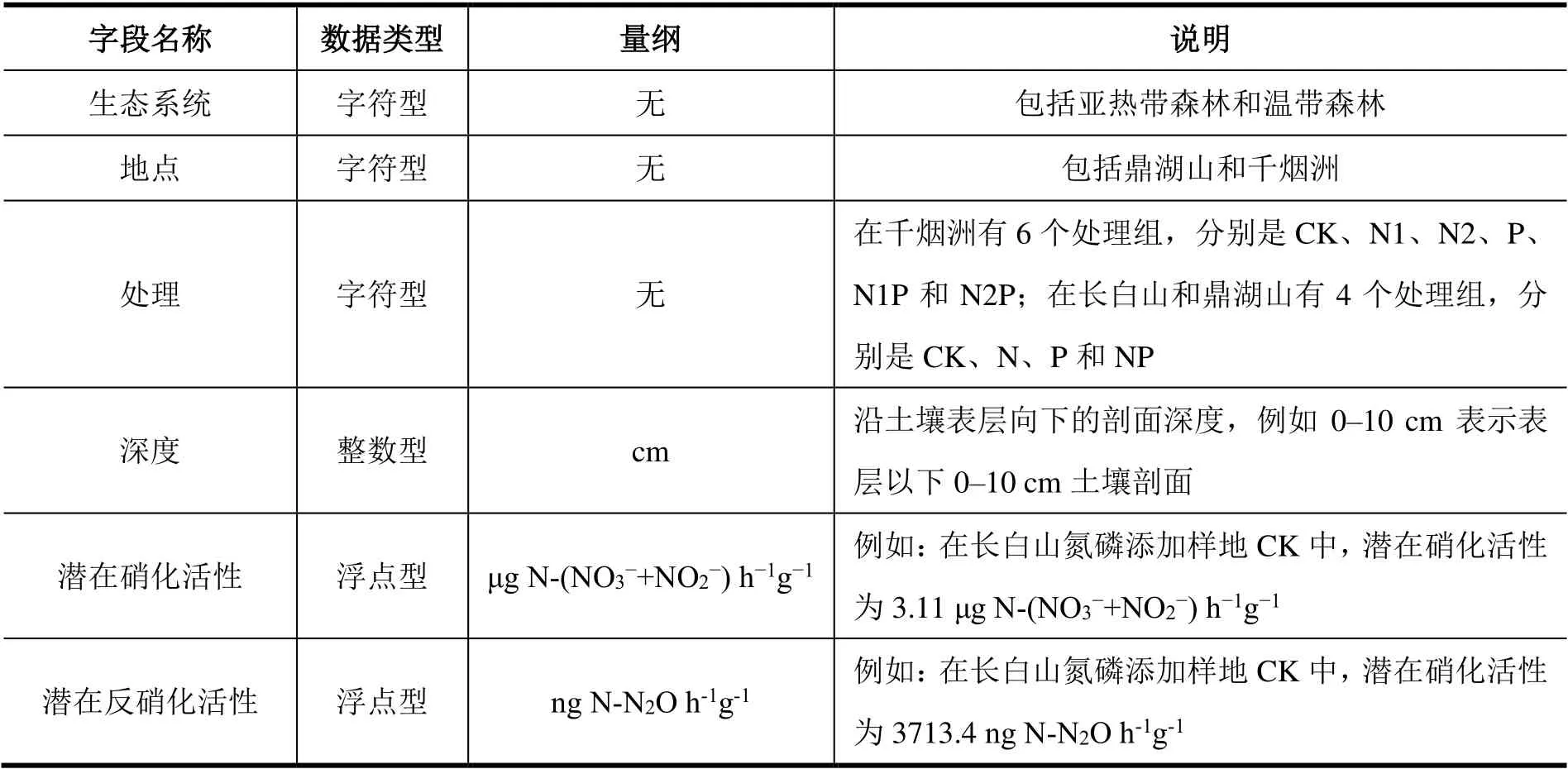
表3 本数据集Excel 1 内容及字段含义Table 3 Data content and descriptions in Excel 1
Excel 2 为土壤理化性质数据,由2 个Sheet 组成,具体内容及字段含义见表4。Excel 中的空白项为未测定数据。
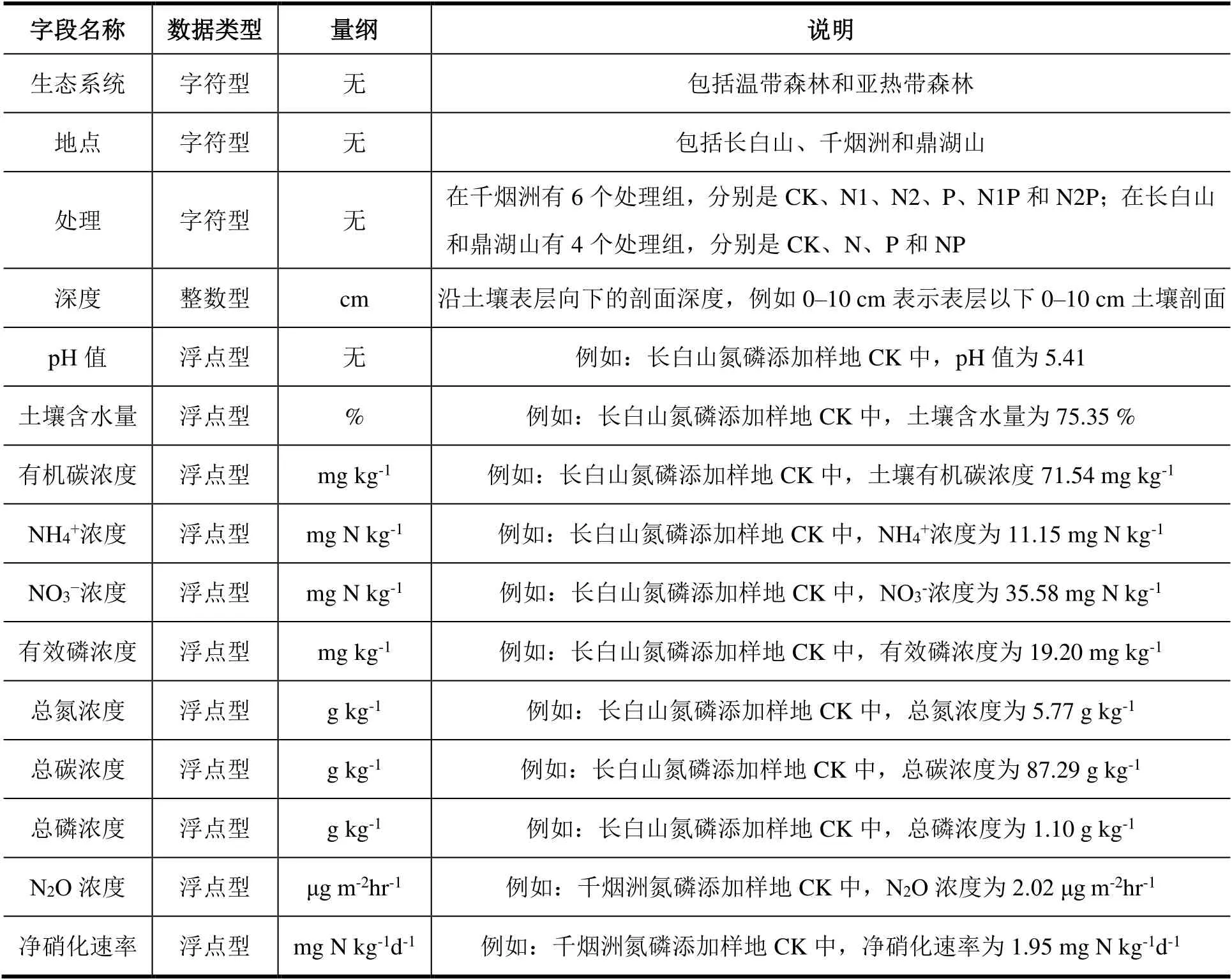
表4 本数据集Excel 2 内容及字段含义Table 4 Data content and descriptions in Excel 2
3 数据质量控制和评估
3.1 季节差异、采样和样品测试误差控制
长白山温带森林和鼎湖山亚热带森林采样时间为8 月,为植物生长季;千烟洲亚热带森林土壤采样时间为4 月,尽管季节上存在差异,但是也基本进入了亚热带的生长季。因此,所采样品能够代表氮磷添加影响下典型温带和亚热带森林土壤。
所有土壤样品的采集均采用五点采样法,以保证样品的均匀性和代表性。同时,采样均在无降水天气晴好的时间进行。此外,除测序外,土壤理化性质和微生物属性的测定均在中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室严格按照标准流程进行,以降低测试误差。
3.2 功能基因丰度数据质量控制
氮循环功能基因丰度测定时,阴性对照、样本和标准品一式三份同时扩增,优化扩增条件确保扩增效率达到90%–110%,R2值达到0.996–0.999。定量PCR 扩增产物的特异性通过溶解曲线估计,扩增片段的大小使用琼脂糖凝胶电泳法确定。
3.3 功能基因高通量测序数据质量控制
原始序列通过Next Generation Sequencing toolkit (NGS version 2.3.1) 进行质量筛选[36],其中短于200 bp 的序列、长于6 bp 的均聚物、包括模糊碱基或者超过50 %的低质量碱基数(average Q value<15)的片段被移除。为获得高质量的测序序列,通过Mothur 软件移除条形码和错误序列,通过UCHIME 算法移除嵌合体序列,通过pre.cluster command (diffs=2)对序列进行降噪处理。
3.4 气体样本N2O 数据质量控制
气体N2O 的采集采用施肥后一周连续采样,减少N2O 通量日波动的影响。样本采集后,在一天内完成样本浓度测定,避免其他气体的污染。每个样方重复测量5 次,减少测量误差。
4 数据价值
目前已有数据集提供中国森林生态系统的土壤性质、土壤微生物分类和大气氮沉降数据。然而还没有基于中国典型森林生态系统氮磷添加联网实验平台的氮循环功能微生物属性数据集,也没有系统的数据集展示氮循环微生物在土壤剖面的分布模式。本数据集选取中国东部具有代表性的典型森林生态系统,以温带针阔混交林,亚热带杉木人工林和亚热带次生林作为研究对象,旨在对比不同森林类型中土壤氮循环微生物的不同分布模式,及其在全球变化氮沉降和磷添加影响下的不同响应。本数据集既可以与之前发表的温带、亚热带森林生态系统碳水通量[46-48]和土壤理化性质[49]等数据协同使用,也对缺乏的温带、亚热带森林土壤微生物数据做了补充。
本数据集的各项指标测定均基于全国联网氮磷添加实验平台,保证了各台站之间数据的有效性和可比性,能够为温带和亚热带森林氮循环过程对全球变化氮沉降和磷添加的响应机制提供数据基础。鉴于功能微生物在调节氮循环过程中的重要生态作用,本数据集提供的氮循环功能基因丰度和氮循环微生物活性等数据有助于深入理解森林生态系统中氮循环的微生物驱动机制,为研究陆地生态系统养分周转和温室气体排放机制提供数据支撑,为降低森林土壤养分损失的管理措施提供数据和依据。
致 谢
感谢中国生态系统研究网络(CERN)长白山、千烟洲和鼎湖山野外台站和样地负责老师以及样地维护人员对本项目取样和指标测定提供的便利和帮助。
数据作者分工职责
贾彦茹(1998—),女,河南濮阳人,硕士研究生,研究方向为土壤微生物生态学。主要承担工作:数据汇编、整理和论文撰写。
唐玉倩(1985—),女,山东烟台人,博士,研究方向微生物生态学。主要承担工作:数据测定、汇编、整理和论文撰写。
张心昱(1973—),女,辽宁桓仁人,研究员,研究方向为地球环境化学。主要承担工作:鼎湖山站数据检测和技术指导;数据质量控制,技术指导和论文修改。
于贵瑞(1959—),男,辽宁大连人,研究员,研究方向生态学。主要承担工作:项目统筹和论文修改。
王辉民(1967—),男,吉林长春人,研究员,研究方向生态学。主要承担工作:千烟洲站数据检测和技术指导。
陈伏生(1973—),男,江西永丰人,教授,研究方向生态学。主要承担工作:千烟洲站杉木林施肥样地建立和维护,数据检测和技术指导。
田大栓(1985—),男,内蒙古呼和浩特人,副研究员,研究方向生态学。主要承担工作:长白山站数据检测和技术指导。
张雷明(1974—),男,河南开封人,副研究员,研究方向生态学。主要承担工作:数据和技术指导。
