贵州普定土壤酶活性和氮循环功能基因数据集
2024-01-11李丹丹张心昱杨洋刘霜张雷明郭志明刘烁彭韬
李丹丹, 张心昱, 杨洋, 刘霜, 张雷明, 郭志明, 刘烁,彭韬
1.中国科学院地理科学与资源研究所,生态系统网络观测与模拟重点实验室,北京 100101
2.中国石油集团安全环保技术研究院有限公司,石油石化污染物控制与处理国家重点实验室,北京 102206
3.河北建筑工程学院,市政与环境工程系,河北省水质工程与水资源综合利用重点实验室,河北张家口 075000
4.中国科学院大学,资源与环境学院,北京 100190
5.普定喀斯特生态系统观测研究站,贵州普定 562100
引 言
由于人为活动的影响,我国西南喀斯特地区石漠化及土地退化问题极其严重。为了应对严重的土地退化问题,我国自上世纪末开始实施生态恢复工程措施。在退耕还林的政策下,西南喀斯特地区将坡度>25°的农田逐步进行退耕,形成了不同的植被类型,有效改善了喀斯特地区的生态环境[1-2]。
微生物在土壤养分循环中发挥着重要作用,可以作为衡量土壤健康或肥力的综合指标,成为评价生态系统土壤功能恢复的重要组成部分[3-5]。土壤酶是由含特定功能基因的微生物所编码的,其活性不仅可以反映土壤理化性质、生物量和生物多样性的变化,也可以反映土壤养分循环情况[6-10]。不同植被类型下,植被的凋落物数量和质量以及根系分泌物数量和化学成分存在着显著的差异,这将影响土壤中微生物群落动态,从而影响土壤养分循环[11-16]。因此,加强喀斯特地区不同植被类型下参与土壤养分循环的相关微生物酶活性及群落动态监测,不仅能加强我们对退化生态系统土壤功能恢复的理解,也有助于为喀斯特地区土壤养分管理促进生态恢复提供理论依据。
贵州普定喀斯特生态系统国家野外科学观测研究站(以下简称普定站)位于南方喀斯特典型区域,是我国南方喀斯特石漠化和生态破坏最为严重的代表性地区。已有大量研究指出植被恢复有利于该区域土壤养分的提升和微生物功能的恢复。然而,关于喀斯特地区土壤养分含量及其土壤微生物丰度和活性研究中还未有公开的数据集。本研究依托普定站,以陈旗流域的农田、弃耕地、次生林和灌丛以及天龙山的近顶级植被的常绿落叶阔叶混交林土壤为监测对象,汇总了5 种植被类型下剖面土壤、根际土壤关于参与碳、氮、磷转化的微生物酶活性、氮循环微生物功能基因、活体和残体微生物量和土壤理化性质的数据,形成了1 个含有8 个数据表单Excel 文件数据集,为喀斯特地区退耕还林对土壤养分循环影响的微生物调控机制研究提供数据支撑。
1 数据采集和处理方法
1.1 采集样地描述
数据采集样地位于普定站的陈旗流域典型集水区(26°15'36″–26°15'56″N,105°43'30″–105°44'42″E)和天龙山(26°14′48″ N,105°45′51″ E)。陈旗流域海拔为1140–1523 m,三面环山,属于典型的喀斯特峰林洼地地貌(图1)。天龙山海拔为1421–1503 m,是喀斯特峰丛中的一座孤山。两个小流域相距1.2 km,属于亚热带季风气候,年平均降雨量为1390 mm,年平均气温为15.1 ℃。土壤多为石灰土和黄壤。土壤母质以可溶性的碳酸盐类岩占优势,主要是中三叠纪关岭组形成的石灰岩和泥灰岩,岩溶作用强烈[3-4]。

图1 普定站陈旗流域和天龙山地貌(A)、不同植被类型的植被群落照片(B)和土壤剖面照片(C)Figure 1 Physiognomy of Chenqi Catchment and Tianlong Mountain at Puding Station (A), photographs of various vegetation types (B) and the photo of a soil profile (C)
二十世纪六十年代,陈旗流域的植被遭到严重破坏,大面积土地被开垦为农田。直到二十世纪末我国政府实施退耕还林政策,陈旗流域大面积的坡耕地陆续从坡顶到坡下进行退耕,逐渐恢复成灌丛,最终演替为次生林,形成了不同的植被类型[3-4]。灌丛和林地主要分布在山腰至山顶区域,耕地主要分布在沟谷及缓坡地带。天龙山山顶由于长期以来有佛教寺庙的存在,森林植被保存较好,在黔中高原面已属于近顶级植被的常绿落叶阔叶混交林[3]。因此,农田、弃耕地、灌丛和次生林4 种植被类型位于陈旗流域,近顶级植被的常绿落叶阔叶混交林位于天龙山。
1.2 样方设置及样品采集
(1)不同植被类型下不同发生层土壤样品采集:2016 年6 月,在陈旗流域选取岩性、海拔和地形等条件相似且相邻的3 个独立的、彼此面对面的喀斯特峰丛山丘用于设置农田、弃耕地、次生林样地。在每个山丘,依照海拔从下到上分别在农田、弃耕地、次生林设置3 个重复样方,每个样方大小为5 m×5 m,样方之间距离10 m 以上。在天龙上从山脚到山顶,设置了4 个5 m×5 m 重复样方,样方之间距离超过10 m。在每个样方内挖掘1 个从地表至基岩的土壤剖面(图1),参照《中国生态系统研究网络观测与分析标准方法-土壤理化分析与剖面描述》[17],根据剖面特征将土壤发生层次分淋溶层、淀积层和母质层,分别采集各个发生层次的土壤样品。分析不同发生层土壤样品的氮循环微生物功能基因丰度及氮转化速率、微生物酶活性。
(2)不同植被类型下不同土层深度样品采集:2016 年7 月,在陈旗流域选取农田、弃耕地、灌丛、次生林,在天龙山选取近顶级植被的常绿落叶阔叶混交林,共5 种不同的植被类型。每个植被类型下依照海拔从下往上设置4 个重复样方,每个样方大小为5 m×5 m,样方之间距离10 m 以上,采集0~10 cm、10~30 cm、30~50 cm、50 cm 以下深度的土壤剖面样品。分析不同土层深度土壤样品的微生物酶活性、活体微生物量和微生物残体碳含量。
(3)喀斯特陈旗流域精细调查样品采集:2016 年7 月,在陈旗流域选择400 m×400 m 大小的集水区,沿着东北坡和西南坡分别布置4 条样带,沟谷布置1 条样带,共布置9 条样带开展精细调查。每条样带内设置4 个距离大致相等的样方,共计36 个样方。其中11 个样方所在研究区的植被类型为次生林,15 个样方为弃耕地,10 个样方为农田。每个样方范围为5 m×5 m,在样方范围内随机取0~10 cm、10~30 cm、30~50 cm、50 cm 以下深度的土壤样品,分析土壤样品的水解酶活性。
(4)天龙山根际土壤样品采集:2018 年5 月,在天龙山近顶级植被的常绿落叶阔叶混交林中从山顶到山脚随机设置了三条样带,每条样带的长和宽分别为50 m×10 m,每条样带之间的距离大于100 m。沿着这三条样带,采集了成熟且健康生长的优势木本植物根际土壤及一级根(距离根轴最远端的吸收根)。分析根际土壤样品的水解酶活性,并鉴定植物菌根类型。
土壤采集方法参考《土壤样品的采集、处理和贮存)》(NY/T 1121.1-2006)标准[18]执行。具体来说,去除地表凋落物层,用直径为2 cm 土钻在样方范围内随机取8–10 个土芯,混匀后作为1 个土壤样品。植物的根际土壤采用“追根法”确定每棵目标树种的根系,利用“抖土法”采集根际土壤。在采样时,对样地植被类型、优势物种及生态系统干扰历史进行调查,记录采样地点位置及地形信息(表1),并拍摄样地景观照片(图1)。将采集的鲜土过2 mm 的土筛,一份直接保存在4 ℃冰箱用于微生物酶活性及土壤理化性质分析,另一份保存在-80 ℃冰箱冷冻用于功能基因分析。此外,利用“追根法”和“抖土法”确定每棵木本植物的根系,采集每棵植物100~200 个一级根,置于FAA固定液中,在4 °C 冰箱内保存,用于菌根类型鉴定[11]。

表1 不同植被类型植物种类的特征和样地信息Table 1 Characteristics of plant species of different vegetation types and information of the sampled farmlands,abandoned farmlands, shrublands, secondary forests and primary forests
1.3 观测方法
(1)土壤水解酶活性:参与土壤碳氮磷循环的6 种水解酶活性参考Saiya-cork 等[19]方法,采用微孔板荧光法利用多功能酶标仪(SynergyH4, BioTek)。称取1 g 鲜土置于250 mL 烧杯内,向烧杯中加入125 mL 与土壤样品pH 值相近的醋酸钠缓冲液(浓度为50 mmol L-1),在涡旋振荡器上震荡1 min,制备成土壤悬浮液;样品孔中分别加入200 μL 的土壤悬浮液和50 μL 的底物(浓度为200 μmol L-1);土壤控制孔中分别加入200 μL 的土壤悬浮液和50 μL 醋酸钠缓冲溶液;底物控制孔中分别加入50 μL 底物和200 μL 醋酸缓冲液;标准物质孔中分别加入50 μL 的标准物质(浓度为10 μmol L-1)和200 μL 的醋酸钠缓冲液;在黑暗避光条件下,置于20 ℃恒温培养箱中培养4 h;随后,每个孔中加入10 μL 浓度为1 mol·L-1的NaOH 溶液终止反应;荧光值在365 nm 波长处激发,450 nm 波长处进行测定。每个样品孔、土壤控制孔、底物控制孔、标准物质孔均设置了8 个平行重复。亮氨酸氨基肽酶(LAP)的标准物质为7-氨基-4-甲基香豆素,其他5 种水解酶的标准物质为4-甲基伞型酮。土壤水解酶活性测定的反应底物及功能详见表2[20]。

表2 水解酶和氧化酶的功能及反应底物Table 2 Functions and substrates of the soil hydrolase and oxidase
(2)土壤氧化还原酶活性:土壤氧化还原酶活性采用微孔板吸收光法,通过多功能酶标仪(SynergyH4, BioTek)测定[4,19]。土壤悬浮液制备方法同上述水解酶测定方法中的土壤悬浮液制备方法一致,称取1g 鲜土置于250 mL 烧杯内,加入125 mL 与土壤样品pH 值相近的醋酸钠缓冲液(浓度为50 mmol L-1),在涡旋振荡器上震荡1 min,制备成土壤悬浮液;吸取土壤悬浮液600 μL 于96深孔板中,加入150 μL 的底物(浓度为200 μmol L-1),测定过氧化物酶(PER)的深孔板中再加入30 μL 10% H2O2,所有深孔板在20℃的黑暗条件下培养5 h,停止培养后进行离心2 min,吸取250 μL 上清液至透明的96 微孔板中,在460 nm 下进行吸收光检测。每个样品均设置了8 个平行重复。土壤氧化还原酶活性测定的反应底物及功能详见表2[20]。
(3)氮循环微生物功能基因丰度:通过已知浓度的质粒DNA 进行连续10 倍稀释用以制作标准曲线,利用实时定量PCR 仪(Eco™, Illumina, USA)分析氮循环功能基因(nifH、chiA、AOAamoA、AOBamoA、napA、narG、nirK、nirS、norB、nosZ)的拷贝数。同时将无DNA 的模板设置为阴性对照,每个样品设置3 次重复。溶解曲线为单一峰用以鉴定产物的特异性,且PCR 产物经琼脂糖凝胶电泳进一步检测无非特异性扩增和引物二聚体的生成。标准曲线R2≥0.999、扩增效率为90%~110%之间的数据被接受。各基因所负责的功能及扩增通用引物信息见表3。
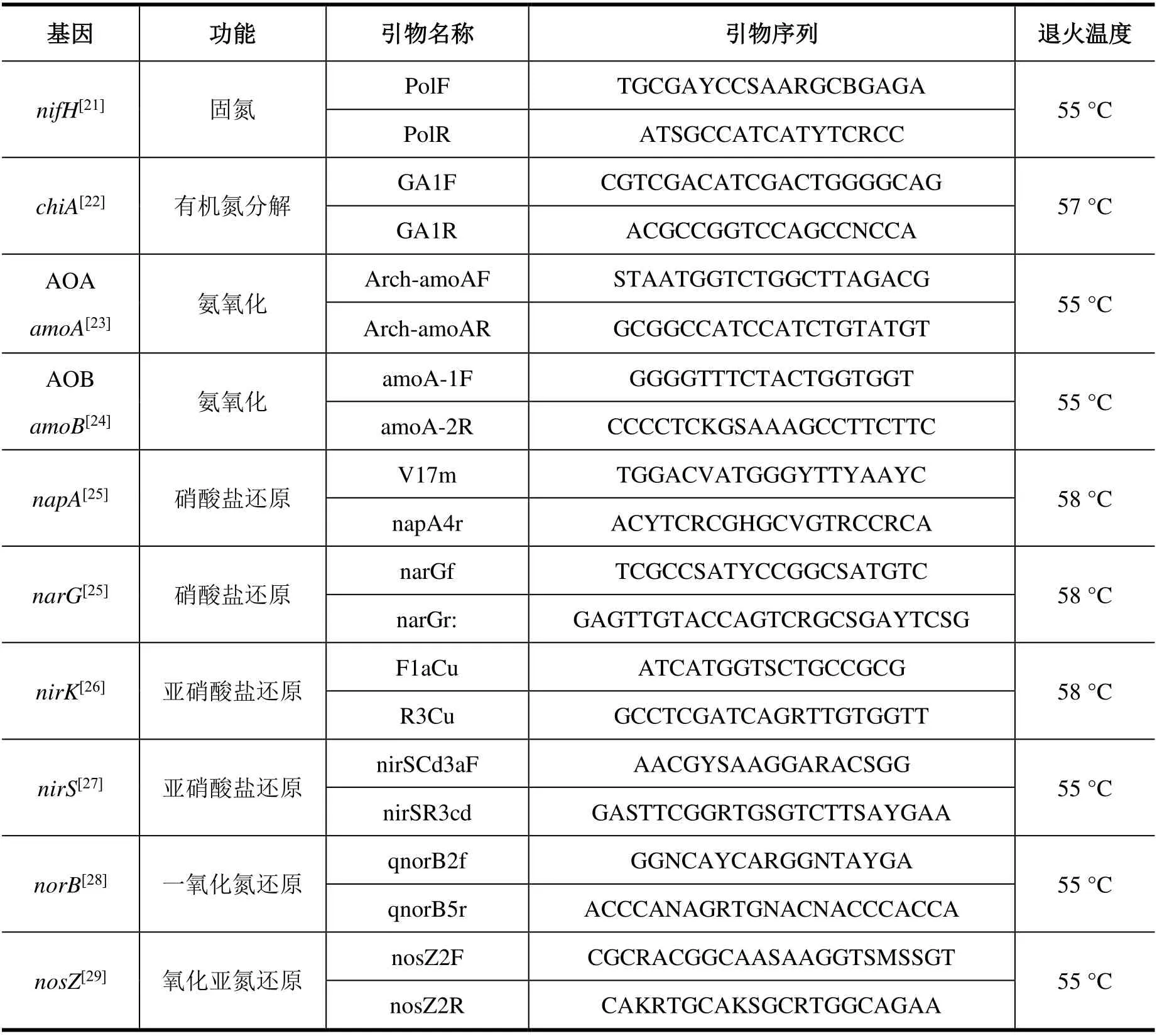
表3 各功能基因的主要功能和PCR 扩增引物信息Table 3 Functions and primer pairs of the nitrogen-cycling functional genes used in PCR
(4)氮转化速率:氮转化速率包括固氮速率和反硝化速率。固氮速率参照Li 等[30]方法,通过室内培养实验,利用乙炔还原法测定28 °C 条件下乙炔(C2H2)还原生成乙烯(C2H4)的量。潜在反硝化速率和基础反硝化速率参照Shrewsbury 等[31]的方法,利用乙炔抑制法通过室内培养实验进行测定。潜在反硝化速率测定厌氧培养条件下微生物在可利用性碳和氮源供应充分情况下产生N2O 的最大量;基础反硝化速率测定厌氧培养条件下微生物在田间养分状态下产生N2O 的量。C2H4和N2O 的浓度均采用气相色谱(Agilent GC 7890A, Agilent, USA)测定。微生物固氮速率和反硝化速率分别用单位时间内每克干土产生的C2H4和N2O 的量表示。在培养过程中,每个样品设置3 次重复,同时将仅添加土样和乙炔设置为对照。
(5)活体微生物量:磷脂脂肪酸(PLFA)是微生物活体细胞膜的成分,可作为活体微生物生物量的指标。采用脂肪酸19:0 作为内标,参考Frostegard 等[32]和Bossio 等[33]方法,利用气相色谱通过MIDI 软件系统(Version 4.5)分析微生物细胞膜PLFA 各组分含量。称取相当于8 g 干重的鲜土,依次加入3.0 mL 磷酸缓冲液、6.0 mL 氯仿、12 ml 甲醇,避光震荡2 h 后,在3000 r min-1下离心10 min,将上清液转移到装有12 mL 三氯甲烷,12 mL 磷酸缓冲液的分液漏斗中,摇动分液漏斗2 min,避光条件下,静置过夜。次日,用50 mL 试管收集分液漏斗下层溶液,收集的液体在30 ℃水浴中用氮气吹干以获得浓缩磷脂样品,用1000 uL 三氯甲烷将试管内浓缩的样品分两次转到萃取硅胶柱上。采用5 mL 三氯甲烷、10 mL 丙酮、5 mL 甲醇依次对硅胶柱上磷脂样品进行洗脱,收集甲醇相,并用氮气吹干。在吹干后的样品中加入1 mL 的1:1 甲醇甲苯及1 mL 0.2 mol L-1氢氧化钾,在37 ℃水浴加热15 min,最后用正己烷萃取,再用氮气吹干储存在4℃冰箱待上机测定。用于指示革兰氏阴性菌、革兰氏阳性菌、细菌、真菌、放线菌种群的磷脂脂肪酸标志物见表4[34-36]。

表4 用于表征微生物类型的磷脂脂肪酸(PLFA)标志物Table 4 Common phospholipids biomarkers representing different types of microbes
(6)微生物残体碳:根据Indorf 等[37]方法,采用邻苯二甲醛柱前在线衍生-高效液相色谱法测定土壤中氨基胞壁酸(MurN)、氨基甘露糖(GalN)、氨基葡萄糖(GluN)三种氨基糖的含量。利用氨基胞壁酸和氨基葡萄糖分别计算细菌和真菌残体碳,利用三种氨基糖的总和计算土壤中微生物残体碳[12,38]。标准样品平行样、土壤样品平行样和重复样的相对标准偏差均<5%,且标准曲线性R2>0.999 时获得的数据被接受。
(7)菌根类型鉴定:在90 °C 条件下,将一级根用10%的KOH(w/v)溶液透明化30 min;在室温条件下,用2%的HCl 溶液(v/v)酸化30 min;再用0.1%的酸性品红溶液分别在90 °C 和60 °C条件下进行染色30 min 和60 min;染色结束后,用等体积的乳酸-甘油-水混合溶液脱色。利用显微镜(DM500, Frankfurt, Germany)观察根系解剖结构。根系皮质细胞中若出现线圈或丛状的结构被认定为内生菌根,根系根尖若有黄棕色或金棕色的菌丝鞘且肿胀认定为外生菌根。
(8)土壤的基本理化性质:土壤容重、含水量、pH、有机碳、全氮、全磷、溶解性有机碳、铵态氮、硝态氮、速效磷的测试方法参照《土壤农化分析》进行测定[39]。
2 数据样本描述
本数据集的数据储存于1 个Excel 文件中的8 个数据表单中,包含了采样点信息,2016 年不同土壤发生层土壤酶活性、氮循环功能基因丰度、氮转化速率、土壤理化性质数据,2016 年不同土层深度土壤酶活性、活体微生物量、微生物残体碳数据,2016 年陈旗流域精细调查土壤水解酶活性、理化性质数据和2018 年天龙山近顶级植被的常绿落叶阔叶混交林根际土壤样品采样点、理化性质和酶活性数据。采样点信息涵盖了样品编号、采样深度、采样时间、采样点坐标、优势种、海拔、坡度和坡向等;土壤酶包括水解酶(βG、βX、CBH、NAG、LAP 和ALP)和氧化酶(PPO 和PER);氮循环功能基因包括nifH、chiA、AOAamoA、AOBamoA、napA、narG、nirK、nirS、norB和nosZ,氮转化速率包括固氮速率、基础反硝化速率和潜在反硝化速率;活体微生物量包括革兰氏阴性菌、革兰氏阳性菌、细菌、真菌和放线菌生物量;土壤理化性质包括土壤容重、含水量、pH、有机碳、全氮、全磷、溶解性有机碳、铵态氮、硝态氮、速效磷。具体的字段名称、类型及示例见表5、表6。

表5 本数据集Sheet 1 内容及字段含义Table 5 Data content and description in Sheet 1
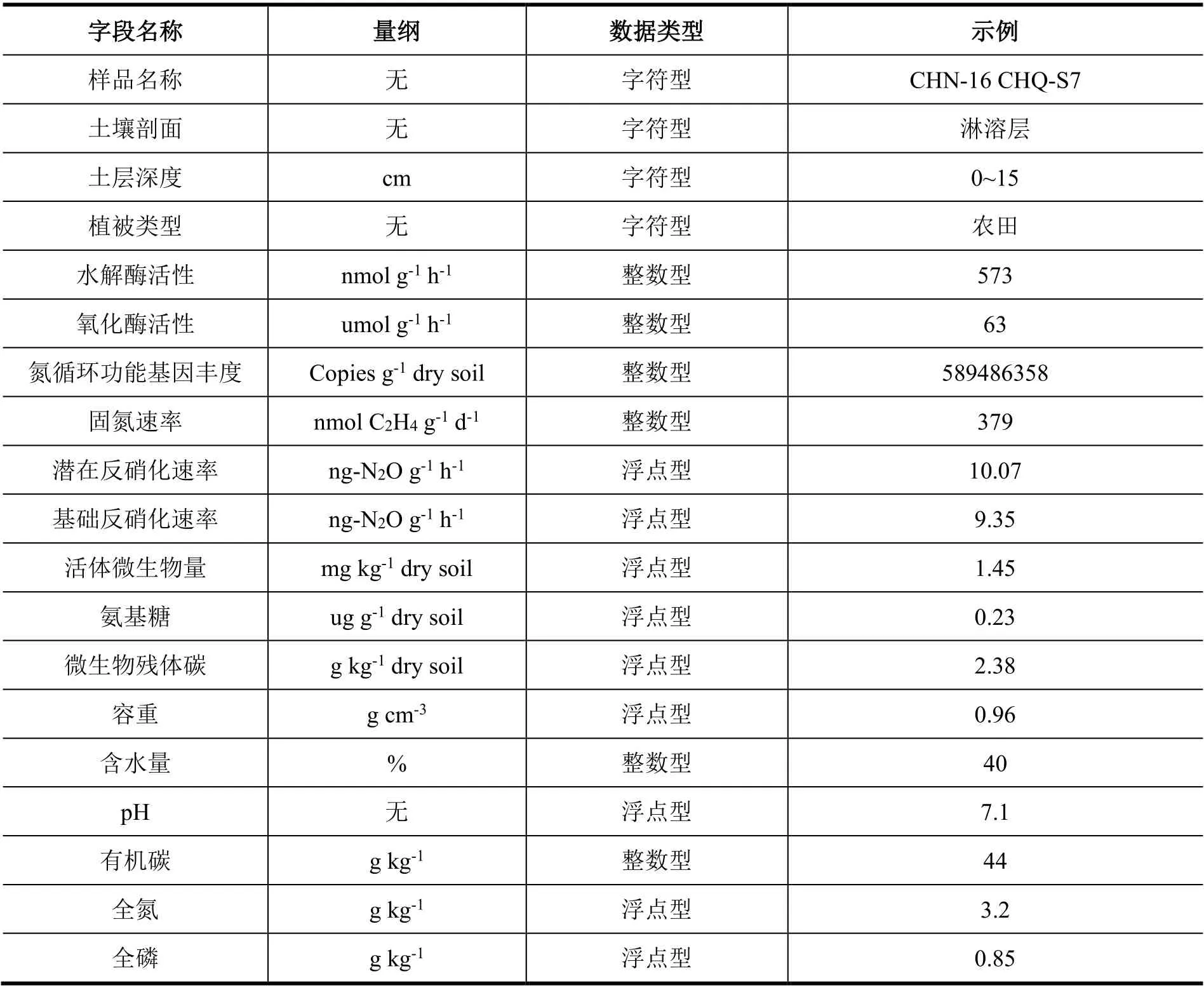
表6 本数据集Sheet 2-Sheet 8 内容及字段含义Table 6 Data content and description from Sheet 2 to Sheet 8
3 数据质量控制和评估
为确保调查数据具有代表性、准确性,本数据集在建立过程中主要从调查采样过程、样品分析与数据精度三个方面进行质量控制和评估。
3.1 调查采样过程质量控制
沿海拔梯度在陈旗和天龙山两个小流域选择研究区域内具有代表性的植被类型,涵盖了坡上、中、下以及不同坡向。由于陈旗流域和天龙山在地形上存在差异,两流域采取差异化样地设置方式。同时,在陈旗流域选择400 m×400 m 大小的集水区开展精细调查,建立地形和植被类型相结合的垂直剖面土壤取样体系。在样地设置方面综合考虑了地形和地势等环境因素,使得数据采集更加全面和具有代表性。此外,在各样方内随机设置重复样地并随机取样,在各个样地内将8–10 个土芯混匀作为1 个样品,降低空间异质性对数据结果产生的影响。在土壤样品采集时,仔细去除土壤表面凋落物层,对所不同土层土壤样品进行准确标记。采样结束后,仔细核实样品数量与样品记录信息。
3.2 样品室内分析质量控制
土壤样品带回实验室后,尽快测定相关指标,针对不同的检测指标采取特定的样品保存方式。在样品检测前,再次核实样品信息,包括样地名称、样方编号、样品数量等。在测定过程严格按照方法规范操作,在每一批次样品检测过程中,均设置独立的空白对照,并插入标样、盲样,将标准曲线R2>0.999 进行数据校正,以保证原始数据采集结果的准确性。
3.3 数据精度质量控制
完成检测后,认真记录原始数据,所有数据的原始记录不得涂抹、删改,以备数据后续核查。当数据出现异常值时,应严格核实。核对数据计算过程,如发现数据计算过程错误导致结果偏差较大时,立即溯源原始数据。此外,通过对数据离散程度分析,以组内不超过测定指标均值3 倍标准差为正常样,剔除数据的异常样本。
4 数据价值
本研究公开发表了贵州普定喀斯特区域的陈旗流域和天龙山5 种不同植被类型下参与土壤碳、氮、磷循环相关微生物酶活性及功能基因的数据。微生物酶活性数据揭示了喀斯特生态系统植被在恢复前期存在氮、磷养分限制,而在恢复后期存在磷养分限制的问题,为植被恢复过程中制定合理的养分管理策略提供参考价值[8]。氮循环微生物功能基因丰度及微生物氮转化速率数据进一步揭示植被恢复改善了土壤物理结构,实现了土壤对氮循环功能微生物在水、碳、氮和磷养分方面的可持续供给,进而提高氮循环微生物活性,为喀斯特生态系统可持续氮素管理提供科学依据[9-10,14]。利用基础反硝化速率和潜在反硝化速率的比值揭示了喀斯特地区植被恢复过程中土壤氮循环状态的变化,为“退耕还林”背景下土壤N2O 排放控制机制研究提供数据参考[13]。通过微生物量数据量化了活体微生物与残体微生物对土壤有机碳库的贡献,对提高喀斯特地区植被恢复过程中维持土壤碳库的稳定性机制的认识具有重要意义[12]。不同树种根际土壤酶活性数据揭示了外生菌根与丛枝菌根养分获取能力和途径上的差异,为喀斯特森林中物种的共存和树种多样性的维持提供数据支撑[15]。
总之,本数据集为探究喀斯特地区植被恢复对土壤碳氮磷循环过程的微生物调控机制研究提供新的认识。此外,本数据集的公开也是进一步系统性地研究脆弱生态系统在“退耕还林”背景下土壤养分循环及微生物功能活性研究的重要数据来源,为未来区域生态环境治理提供重要的数据支撑。
致 谢
感谢普定站在数据采集过程中关于样方设置及样品采集方面给予的支持。
数据作者分工职责
李丹丹(1988—),女,黑龙江哈尔滨人,博士后,研究方向为土壤氮循环过程及其微生物机制。主要承担工作:数据整理与论文撰写。
张心昱(1973—),女,辽宁桓仁人,研究员,研究方向为陆地生态系统土壤碳、氮、磷循环的微生物机制。主要承担工作:总体方案设计与组织实施,样品采集与分析的质量控制、数据质量控制与评估,技术指导与论文修改。
杨洋(1991—),女,黑龙江哈尔滨人,讲师,研究方向为土壤养分循环及微生物机制。主要承担工作:根际土壤样品的采集与分析工作。
刘霜(1995—),女,河南永城人,博士生,研究方向为土壤磷循环及微生物机制。主要承担工作:样品采集与土壤酶活性分析工作。
张雷明(1974—),男,河南开封人,副研究员,研究方向为陆地生态系统碳水交换、土壤温室气体通量、植被物候。主要承担工作:技术指导与论文修改工作。
郭志明(1992—),男,湖南醴陵人。博士生,研究方向为土壤碳生物地球化学过程。主要承担工作:剖面样品采集,土壤微生物碳标志物及土壤养分分析工作。
刘烁(1992—),男,河北南宫人。硕士,研究方向为土壤酶活性空间分布特征。主要承担工作:样品采集,土壤酶活性分析。
彭韬(1984—),男,贵州省贵阳人,研究方向为喀斯特地区生态环境研究、土壤侵蚀与水土保持、水文水资源研究。主要承担工作:采样指导与论文修改工作。
