miR-431-5p通过MAPK/ERK通路促进食管鳞癌细胞增殖和迁移
2024-01-10陈耀武李阳坤叶赛卿钱昕晔朱皓宇徐雯轩包晓红
金 戋,陈耀武,李阳坤,叶赛卿,钱昕晔,朱皓宇,徐雯轩,包晓红
(台州学院医学院,浙江 台州 318000)
0 引言
食管癌(Esophageal cancer)为常见的最具侵袭性的消化道恶性肿瘤之一,它有两种组织学亚型,即食管鳞癌(Esophageal Squamous Cell Carcinoma,ESCC)和食管腺癌(Esophageal Adenocarcinoma,EAC)。在全球癌症统计报告中,食管癌发生率排第六位,死亡率排第七位,且其5 年生存率低于20%[1-2]。中国的食管癌病例占全球的50%以上[3]。目前食管癌的主要临床治疗手段为手术切除、放化疗,但常规治疗的疗效有限且发生严重的不良反应[4]。西妥昔单抗(靶向表皮生长因子受体,EGFR)和贝伐珠单抗(靶向血管内皮细胞生长因子,VEGF)为代表的靶向治疗已被证实在食管癌的治疗中发挥着重要作用[4]。然而,食管癌的异质性,迫使研究者们寻求更多的潜在治疗靶点。ESCC 因缺乏其有效靶点,靶向治疗效果欠佳;微小RNA(microRNA,miRNA)是一种非编码小RNA,它参与包括食管癌在内的多种癌症的各个阶段[5],在肿瘤发生发展中的作用显著,有望成为肿瘤治疗的有效靶点。已有研究报道,miR-431-5p 的异常表达在肿瘤发生发展过程中发挥了重要作用[6],但其在食管癌中的作用尚不明确。本文通过检测miR-431-5p在食管癌中的异常表达,证实了miR-431-5p 参与ESCC 的细胞增殖、侵袭和迁移过程,并探索了其作用机制,为食管鳞癌的分子靶向治疗提供新的方向。
1 材料与方法
1.1 材料和仪器
人食管鳞癌细胞(ESCC)株TE-1 和TE-11 购自江阴齐氏生物科技有限公司;KYSE30、KYSE70 和KYSE450 购自南京科佰生物科技有限公司;ESCC 组织cDNA 芯片(癌/癌旁各15),上海芯超生物科技有限公司;miR-431-5p 模拟物和抑制剂,北京鼎国昌盛生物技术有限责任公司;RPMI1640 培养基,美国Hyclone 公司;标准胎牛血清,美国Gemini Bio;CCK-8 试剂,美国APExBio 公司;BCA 定量试剂盒,美国Thermo Scientific 公司;兔抗人p-ERK(1/2)单克隆抗体(#4370)和兔抗人ERK 抗体(#9102),美国Cell Signaling Technology 公司;小鼠抗人β-actin 单克隆抗体(sc-69879),美国Santa Cruz 公司;HRP 标记山羊抗兔IgG(ab6789)多克隆抗体、HRP 标记山羊抗小鼠IgG(ab6721)多克隆抗体,英国abcam 公司;ECL发光液,上海碧云天生物技公司;transwell 板、Matrigel 基质胶,美国康宁公司;Thermo CO2细胞培养箱,美国Thermo 公司;BioTek Synergy H1 酶标仪,美国BioTek 公司;GE Amersham Imager 600 超灵敏多功能成像仪,美国GE 公司。
1.2 实验方法
1.2.1 TCGA(The Cancer Genome Atlas)数据库分析miR-431-5p 表达
从TCGA 数据库(https://portal.gdc.cancer.gov)下载并整理TCGA-ESCA(食管癌)项目BCGSC 流程的miRNA-seq 数据并提取RPM 格式的数据。利用R(4.2.1)软件分析miR-431-5p 表达,采用ggplot2[3.3.6]包对数据进行可视化。
1.2.2 组织cDNA 芯片PCR 及细胞RT-qPCR
根据天根miRcute miRNA 荧光定量检测试剂盒的操作步骤进行操作。配置20 μL qPCR MasterMix体系:2×miRcute Plus miRNA Premix 10 μL,正向引物终浓度200 nmol/L,反向引物(10 μmol/L)0.4 μL,ddH2O 补水至20 μL。将cDNA 芯片置于冰上静置15 min,振荡30 s,以3 000 r/min 转速离心3 min,上机实验。PCR 程序为:一阶段95 ℃30 s;二阶段95 ℃5 s,60 ℃30 s,循环40 次;三阶段95 ℃5 s,60 ℃1 min。
细胞培养至对数生长期时trizol 法提取其总RNA,测定RNA 浓度及纯度,进行反转录。具体反应如下:配置反应液去除DNA(5×gDNA Wiper Mix 2 μL、Total RNA 500 ng、无酶水补足至10 μL,40 ℃反应2 min);在RNase-free 离心管中按说明书配置反应液,反应体系:上一步反应液10 μL、5XPrimmeScript RT Master Mix 2 μL、step-loop primer 0.2 μL、无酶水补足至20 μL。反应条件:25 ℃,5 min;50 ℃,15 min;85 ℃,5 min。PCR 反应体系:cDNA 0.5 μL,mQ primer R 0.4 μL,2×SYBR PCR Master mix 5 μL,上、下游引物0.2 μL,无酶水3.9 μL。反应条件:一阶段95 ℃,5 min;二阶段95 ℃,10 s、60 ℃,30 s 循环40 次;三阶段95 ℃,15 s、60 ℃,1 min、95 ℃,15 s。利用2^-(ΔΔCt)法分析数据。
1.2.3 细胞培养
将KYSE30、KYSE70、KYSE450、TE-1、TE-11 细胞培养于含体积分数为10%胎牛血清和青-链霉素各100 units/mL 的RPMI1640 培养基,置于37 ℃、体积分数为5% CO2的培养箱中;倒置显微镜观察细胞形态及生长情况,待细胞汇合度80%~90%时,胰酶消化,用于后续实验。
1.2.4 细胞转染
以每孔5×104个细胞接种到24 孔板中,过夜培养后进行细胞转染。50 μL Opti-MEM 稀释miR-431-5p模拟物和抑制剂(终浓度为50 nmol/L),混匀。再与50 μL Opti-MEM 稀释的LipofectamineTM 2000 混合,室温下静置20 min。将100 μL 转染复合物加入到未含血清的24 孔细胞板中,轻摇细胞板混合均匀,培养48 h。转染6 h 后换新鲜完全培养基。分组如下:①KYSE30+模拟物对照组(以下简称KYSE30-MNC);②KYSE30+模拟物组(以下简称KYSE30-M);③TE-11+抑制剂对照组(以下简称TE-11-I); ④TE-11+抑制剂组(以下简称TE-11-I)。
1.2.5 CCK-8 细胞增殖实验
接种于6 孔板的细胞培养过夜后,转染miR-431-5p 模拟物和抑制剂24 h。经胰酶消化、离心重悬后,等体积接种于96 孔板。采用CCK-8 法检测转染24 h,48 h,72 h 时的细胞增殖情况。方法简述如下:10 μL CCK-8 加入每孔中,培养板置于37 ℃培养箱孵育2 h,用酶标仪测其吸光度值(A450nm),分析其数据。
1.2.6 细胞划痕实验
5×105个细胞接种于6 孔板,培养过夜。转染miR-431-5p 模拟物和抑制剂24 h 后,用移液器吸头划痕,以PBS 清洗细胞3 次,加入无血清培养基,0 h、48 h 时分别在显微镜下拍照纪录。用Image J 计算划痕面积。迁移率(%)=[(0 h 划痕面积-48 h 划痕面积)/0 h 划痕面积]×100%。
1.2.7 Transwell 实验
将4 ℃融化的转染基质胶用OPTI-MEM 培养基稀释(1∶20),加入Transwell 小室内,37 ℃固化1~2 h;再将0.2 mL、含5×104个转染48 h 的细胞的OPTI-MEM 培养液加入到Transwell 上室。Transwell 下室中加入0.6 mL 含有体积分数为20% FBS的OPTI-MEM 培养基。将Transwell 小室细胞置于37 ℃、体积分数为5% CO2的培养箱24 h,取出小室,固定、结晶紫染色、拍照。用Image J 计算细胞数量,计算细胞侵袭率。重复实验3 次。
1.2.8 Western blot 实验
3×105个细胞接种于6 孔板,培养过夜,转染miR-431-5p 模拟物和抑制剂48 h 后,提取其总蛋白,测其蛋白浓度。在质量浓度为4%~10%的不连续SDS-聚丙烯酰胺凝胶点样孔内加入等量蛋白样品,再电泳,转膜,封闭1 h 后,加入一抗(1∶1 000)稀释液4 ℃孵育过夜。TBST 清洗3 次,每次10 min。再加二抗(1∶10 000)室温孵育1 h,TBST 清洗3 次,每次10 min;最后用ECL 显色液进行显色、拍照。使用Image J软件分析条带灰度值。
1.2.9 数据处理
转录组公共数据库采用R(4.2.1)语言,ggplot2[3.3.6]包用于数据可视化,GraphPad Prism 8.0 软件用于实验数据的可视化。两组间比较采用t检验,P<0.05 为差异有统计学意义。
2 实验结果
2.1 miR-431-5p在食管癌中高表达
miR-431-5p 在食管癌中高表达情况如图1 所示。非配对样本(正常组∶食管癌组=13∶187)和配对样本(正常组∶食管癌组=13∶13)中,肿瘤组中miR-431-5p 的表达量均高于正常组(图1A 和图1B),且具有统计学意义(P<0.01)。根据受试者工作特征曲线(ROC 曲线,图1C),ROC 曲线下与坐标轴围成的面积(AUC)值为0.870(CI:0.773~0.968),具有较好的诊断价值,说明miR-431-5p 的表达水平可能是ESCC 的潜在生物标志物。为了验证miR-431-5p 在ESCC 中的表达,我们在ESCC 组织和细胞中检测其表达情况。RT-qPCR 结果显示:与癌旁组织相比较,miR-431-5p 相对表达量高于1 的组织有5/15(30%,图1D),而在5 种ESCC 细胞系中表达量从高到低分别是TE-11、TE-1、KYSE450、KYSE70、KYSE30 细胞(图1E)。在后续的实验中,分别挑选表达量最低的KYSE30 和表达量最高的TE-11 细胞作为实验细胞。

图1 miR-431-5p 在食管癌中的高表达
2.2 miR-431-5p促进ESCC细胞增殖
采用RT-qPCR 方法验证转染miR-431-5p 模拟物后的KYSE30 细胞和转染抑制剂后的TE-11 细胞中miR-431-5p 的表达情况,结果如图2 所示。经miR-431-5p 模拟物转染,KYSE30 细胞miR-431-5p 相对表达量显著增加(图2A,P<0.05),而经miR-431-5p 抑制剂转染,TE-11 细胞miR-431-5p 相对表达量显著降低(图2B,P<0.001),说明miR-431-5p 模拟物和抑制剂有效。为了检测miR-431-5p 对ESCC细胞增殖的影响,KYSE30 和TE-11 细胞转染miR-431-5p 模拟物和抑制剂,检测其细胞增殖情况。转染72 h 时,与KYSE30-MNC 比较,KYSE30-M 组细胞吸光度值增加了24.19%(图2C);与TE-11-INC 组比较,TE-11-I 组的细胞吸光度值降低了21.43%(图2D),表明miR-431-5p 促进ESCC 细胞增殖。

图2 miR-431-5p 促进ESCC 细胞增殖
2.3 miR-431-5p有利于ESCC细胞的迁移
miR-431-5p 模拟物和抑制剂分别转染于KYSE30 和TE-11 细胞后,细胞迁移率变化如图3 所示。KYSE30-MNC 组迁移率为15.93%,而KYSE30-M 组迁移率增加至46.79%(P<0.001),TE-11-INC 组迁移率为27.37%,而TE-11-I 组迁移率降至17.85%(P<0.05),这说明miR-431-5p 与ESCC 细胞迁移呈正相关,在其发展过程中可能发挥重要的作用。

图3 miR-431-5p 促进ESCC 细胞迁移
2.4 miR-431-5p有助于ESCC细胞的侵袭
Transwell 实验用于检测miR-431-5p 对ESCC 细胞侵袭的影响。KYSE30-MNC 组只有小部分侵袭过膜,而KYSE30-M 组侵袭过膜细胞明显增加(如图4 所示,P<0.001),侵袭率增加了50.29%,这说明miR-431-5p 与ESCC 细胞侵袭呈正相关,在食管鳞癌发展过程中必不可少。
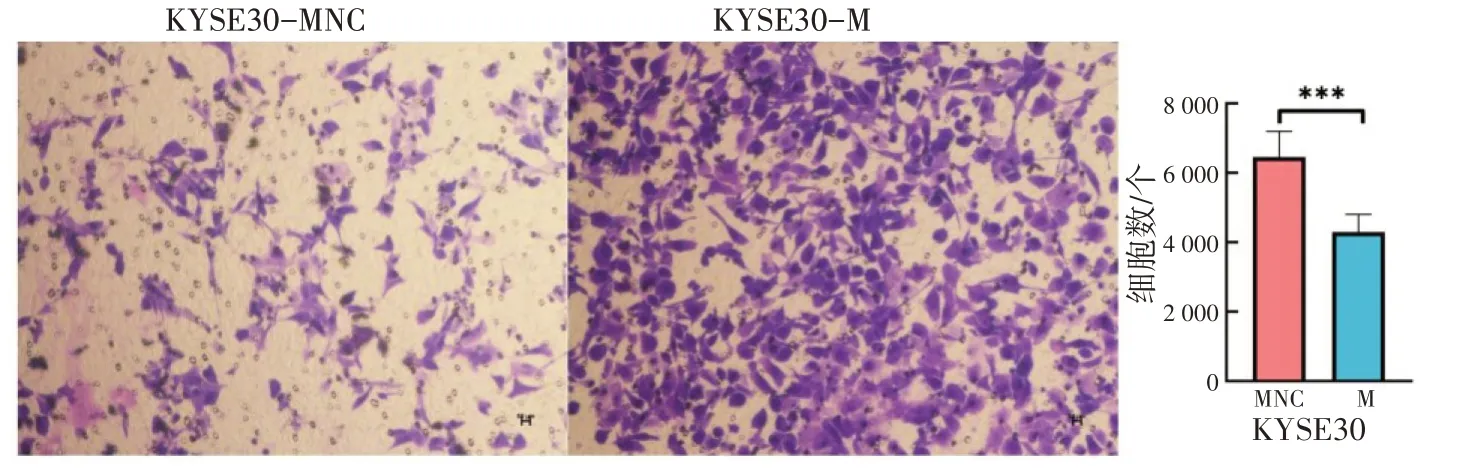
图4 miR-431-5p 促进ESCC 细胞侵袭
2.5 miR-431-5p通过MAPK/ERK通路促进ESCC细胞侵袭
为了探索miR-431-5p 对ESCC 细胞增殖、侵袭和迁移的作用机制,我们检测了p-ERK 蛋白表达(如图5 所示)。

图5 miR-431-5p 促进MAPK/ERK 信号通路
与KYSE30-MNC 组比较,KYSE30-M 组p-ERK 表达量增加11.68%(P<0.01);而与TE-11-INC 组比较,TE-11-I 组p-ERK 表达量减少45.73%(P<0.01)。以上实验表明:miR-431-5p 通过上调MAPK/ERK 信号通路,促进了ESCC 细胞肿瘤的发生发展。
3 讨论
3.1 miR-431-5p可能是ESCC潜在诊断标志物
miRNA 大小约为22 个核苷酸,其表达失调在肿瘤发展过程当中发挥重要作用。随着miRNA 研究的深入,许多潜在的癌症生物标志物被提出可用于诊断和预后,这为癌症筛查提供了新的视角[7]。本文研究发现:miR-431-5p 在食管癌中高表达,具有较高的诊断价值,因此,它可作为潜在的诊断性生物标志物;并且miR-431-5p 对ESCC 细胞增殖、侵袭和迁移具有明显的促进作用。
食管癌组织RNA 公共数据库分析结果显示,食管癌中的miR-431-5p 表达显著高于癌旁组织。为了验证数据库分析结果的准确性,我们检测了ESCC 组织cDNA 芯片上miR-431-5p 表达,结果显示,1/3(5/15)组织高表达miR-431-5p。Xu 等[8]也通过RT-qPCR 的方法检测子宫颈腺癌中miR-431-5p 表达,其结果也显示了miR-431-5p 的高表达。然而,因样本数量较少,我们未能获得统计学上的显著差异。后续的研究拟扩大样本量,进一步表达其验证,以便更准确地分析miR-431-5p 表达量和评估其诊断价值。miR-431-5p 在ESCC 中的高表达是我们以miR-431-5p 作为靶点研究的重要依据。
3.2 miR-431-5p与ESCC发生发展密切相关
为了验证miR-431-5p 的功能,我们首先选择miR-431-5p 表达量最高的TE-11 细胞和表达量最低的KYSE30 细胞,再通过功能缺失和获得进行研究,发现miR-431-5p 能促进ESCC 细胞增殖、侵袭和迁移。miR-431-5p 在宫颈腺癌中的研究结果也显示miR-431-5p 促进宫颈鳞癌细胞生长。然而,miR-431-5p 在结直肠癌中的研究发现:miR-431-5p 的上调抑制了SW620 和HCT116 细胞的增殖和侵袭[9];miR-431-5p在骨肉瘤组织中的过表达抑制了U2OS 和HOS 细胞的侵袭和迁移[10];舌鳞状细胞癌组织中miR-431-5p受到竞争性内源RNA circ_0001742 的调控而表达下调,导致ATF3癌基因的高表达,在舌鳞状细胞癌中发挥抑癌作用[11]。
以上研究结果与我们的研究结果不一致,分析其原因,可能与miR-431-5p 的靶基因有关。根据ENCORI(The Encyclopedia of RNA Interactomes,http://starbase.sysu.edu.cn/tutorialAPI.php)数据库预测的miR-431-5p 的靶基因结果,LIMCH1(LIM and calponin-homology domains 1)可能为潜在作用靶点(数据未显示)。LIMCH1 蛋白是一种细胞骨架相关蛋白,属于LIM 蛋白家族。LIMCH1 为负调控因子,可能通过调控HUWE1 和p53 参与肺癌的发生发展[12]。另外一项基于免疫组化和生物信息学的研究发现,LIMCH1的表达缺失可预测肺鳞癌手术切除患者的不良预后[13]。miR-431-5p 在ESCC 中的表达上调,可能通过抑制LIMCH1 实现,从而促进ESCC 的增殖、侵袭和迁移。因此,须进行深入的研究加以验证。
上皮-间充质转化(epithelial to mesenchymal transition,EMT)是指非运动性上皮细胞向具有侵袭能力的间充质表型转变,是肿瘤转移的重要的生物学过程[14]。深入分析miR-431-5p 促进ESCC 转移EMT分子机制尤为重要。MAPK/ERK 信号通路调控肿瘤细胞的增殖和转移,包括食管鳞癌的EMT 过程[15-16]。ERK 是MAPK 信号通路中的关键调节因子,是将信号从表面受体传导至细胞核的关键[17]。ERK 参与调节细胞骨架组织、细胞运输、细胞黏附和代谢,而在癌细胞中,ERK 的磷酸化蛋白(p-ERK)的高表达常常与增殖、侵袭和耐药性有关[18]。因此,ESCC 细胞经miR-431-5p 模拟物/抑制剂转染后,检测其p-ERK 表达量。miR-431-5p 正向调节p-ERK 是我们的新发现。在食管鳞癌发生发展过程中,miR-431-5p 可能是一个重要的正向调节分子,通过调控MAPK/ERK 信号通路,使ESCC 细胞触发EMT 进程,从而参与ESCC 细胞的增殖、侵袭和迁移等过程。此外,miR-431-5p 还可能通过ROCK1/PI3K/AKT 通路调节肿瘤细胞增殖和转移[19]。上皮表面标志物(最显著的是E-钙黏蛋白)的缺失和间质标志物(包括波形蛋白和N-钙黏蛋白)的获得是EMT 发生的标志[14]。miR-431-5p 模拟物/抑制剂处理后,检测以上EMT 标志物,详细探究miR-431-5p 通过MAPK/ERK 通路促进EMT 的作用机制也是我们今后研究的方向。
4 结语
miR-431-5p 在ESCC 中表达上调,而且miR-431-5p 通过MAPK/ERK 信号通路正向调控ESCC 细胞的增殖、侵袭和迁移。深入探索miR-431-5p 的作用靶点以及分子机制,将为以miRNAs 为靶点的食管鳞癌诊断和治疗提供更有效的参考依据。
