肺癌药物靶点与Nur77的研究进展
2024-01-10潘莉分李祯烨劳茹阳胡琼莹
潘莉分,李祯烨,劳茹阳,胡琼莹
(台州学院医学院,浙江 台州 318000)
0 引言
肺癌是对人类健康造成重大影响的重要公共卫生问题,数据显示:2020 年全球肺癌发病率约22.4%,死亡率高达18%,其死亡人数居癌症死亡人数之首[1]。我国是肺癌高发国家,2020 年肺癌患者数量达到80 万,近30 年,肺癌死亡率提高了46.5%,肺癌已经成为我国致死恶性肿瘤中死亡率排名第一的疾病[2]。非小细胞肺癌是肺癌最常见的类型,约占肺癌病例的85%[3]。肺癌的治疗手段主要包括手术治疗、放疗、化疗(包括靶向治疗)和免疫治疗等[4]。这些治疗手段各有局限性:手术治疗生存率低且易复发和转移;放疗不良反应大;以铂为基础的化疗方案毒副作用大,靶向性低且易复发[5-7];免疫治疗费用高,仅有约20%的患者能从中获益,且毒副作用较大[3,8-9]。而小分子靶向治疗是不同药物作用于不同靶点,具有药物用量少、特异性强等优点,因此小分子靶向药物的研发已成为抗肺癌药物研发的主要趋势[10-11]。孤儿核受体Nur77 能够影响肿瘤细胞的生长、凋亡和自噬等生理调控过程[12],有望成为治疗的新靶点。本文简要介绍了部分抗肺癌药物靶点,并综述了Nur77 及其相关化合物。
1 国内外抗肺癌靶向药物市场分析及发展趋势
目前报道较多的药物靶点包括间变性淋巴瘤激酶(Anaplastic Lymphoma Kinase,ALK)、表皮生长因子受体(Epidermal Growth Factor Receptor,EGFR)、肉瘤致癌因子-受体酪氨酸激酶(c-Ros oncogene 1,Receptor Tyrosine Kinase,ROS1)、血管内皮细胞生长因子(Vascular Endothelial Growth Factor,VEGF)、间质表皮转化因子(Mesenchymal Epithelial Transition Factor,MET)、鼠类肉瘤病毒癌基因同源物B1(v-Raf Murine Sarcoma Viral Oncogene Homologue B1,BRAF)、泛人表皮生长因子受体(Human Epidermal Growth Factor Receptor 2,HER2)等[13-14],各靶点以及相关药物具体情况介绍见表1。其中ALK 药物在国内市场销售额预测为96.44 亿,EGFR 药物国内市场销售额预测为226.51 亿元,具有广阔的市场前景[2]。
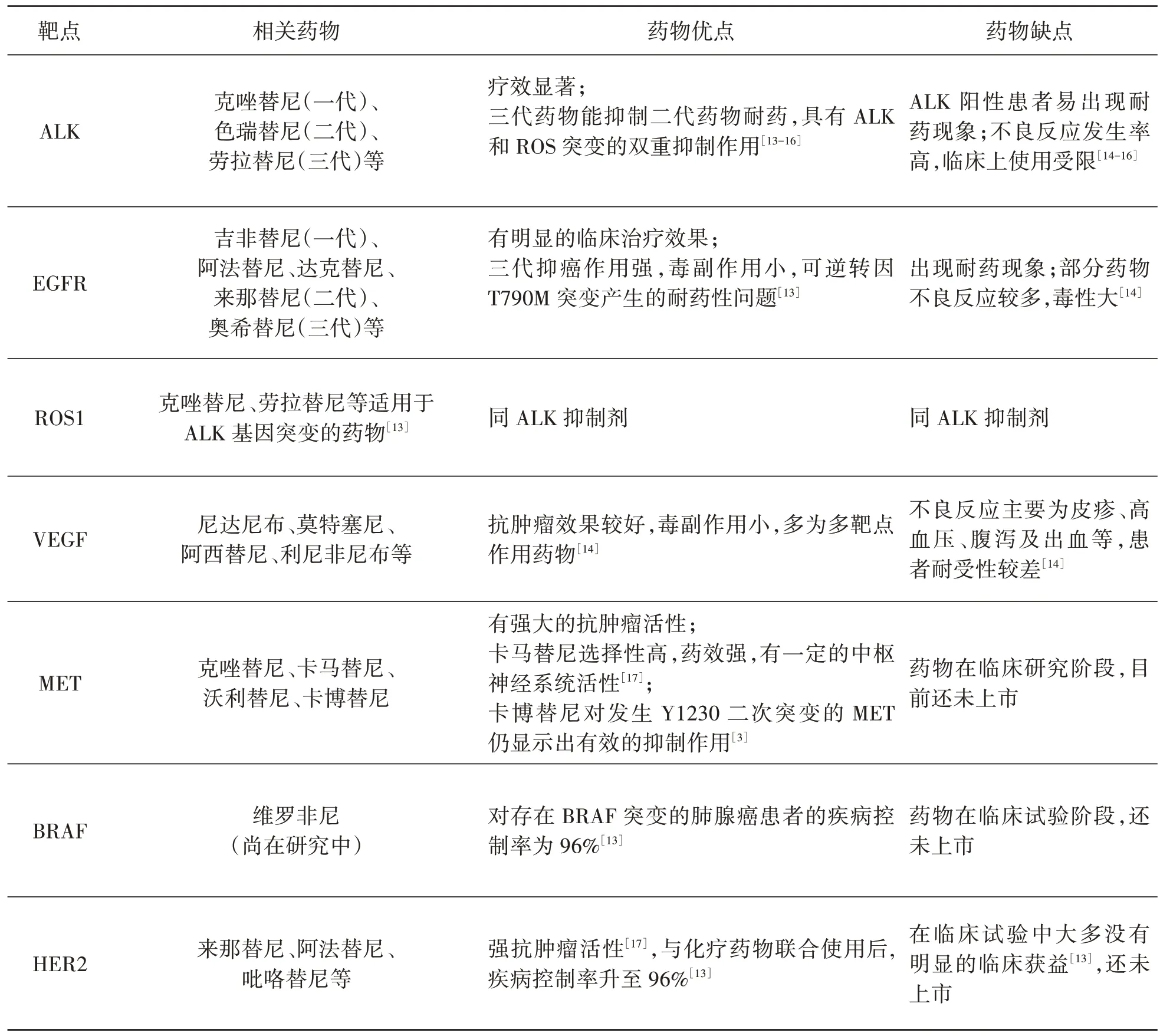
表1 抗肺癌药物靶点及相关药物
目前国外市场上靶向药物主要包括吉非替尼、埃克替尼、厄洛替尼等;国内市场上推出的治疗肺癌的小分子靶向药物主要包括吉非替尼、埃克替尼、克唑替尼等[2]。从表1 中列举的各药物特点可以看出,目前上市的肺癌小分子靶向药物仍然存在耐药及副反应较大等缺点,因此仍需进一步研究肺癌的分子机制以及开发更有效的新靶向药物[13,18]。
下面我们对在机体代谢与发育以及稳态维持等方面发挥重要功能的孤儿核受体家族成员Nur77 进行讨论[19-20],探讨其相关的作用机制与治疗前景。
2 Nur77及其靶点相关的化合物
核受体超家族至少包含48 个转录因子成员,它们通过调控靶基因的表达来影响不同的生命活动过程,是主要的药物靶点[12,21-22]。Hazel 等[18]于1988 年首次发现的一个细胞核受体超家族的孤儿成员Nur77(也称为NR4A1/TR3/NGFI-B),在维持细胞内稳态和在疾病中起着重要作用[19,21,23]。
2.1 Nur77的分子结构特点
Nur77 cDNA 序列能够编码598 个氨基酸的蛋白质[24]。Nur77 具有典型的核受体结构,包括N 端结构域、DNA 结合结构域(DNA binding domain,DBD)和配体结合结构域(Ligand binding domain,LBD)[25](如图1 所示)。其N 端区域包含配体独立的激活功能1(Activation function-1,AF-1)反式激活域(Transactivation domain,TAD),是与其他转录因子相互作用和进行反转录激活所必需的[12]。DBD 区域能够识别特定的NGFI-B 响应元件(NGFI-B response element,NBRE),Nur77 通常通过与靶基因启动子区域的NBRE 结合而起作用[26-27];而LBD 区域在转录活性和/或二聚过程中有重要作用[28]。
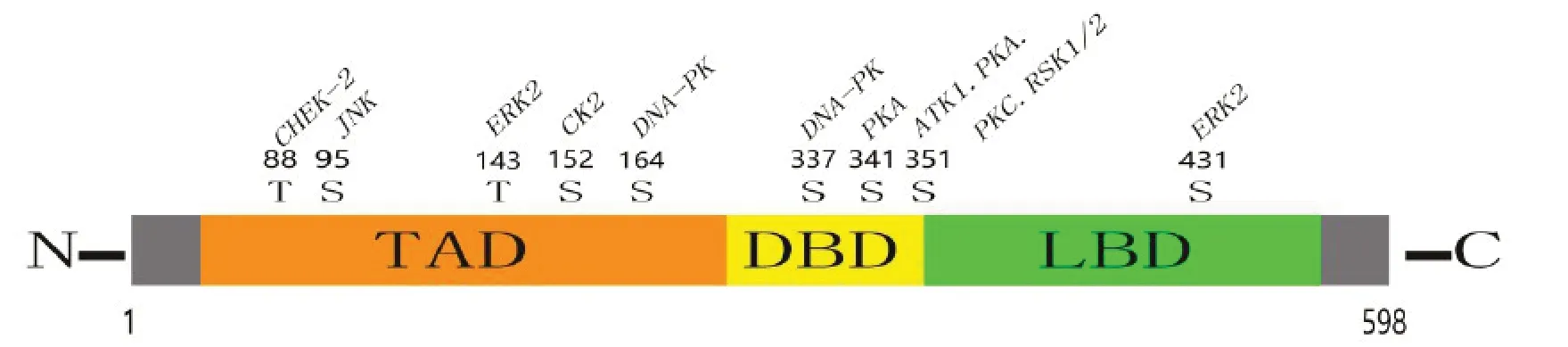
图1 Nur77 结构示意图
2.2 Nur77作为肺癌靶点的可能性
2.2.1 Nur77 在癌症中的表达及预后
有研究统计,与正常组织细胞相比,Nur77 在结肠癌、胰腺癌、乳腺癌和肺癌等多种肿瘤中过表达,其在肺癌、乳腺癌和结肠癌等中的表达水平与患者的生存或预后息息相关。Nur77 相关肿瘤的预后和功能随肿瘤类型、肿瘤环境和化合物或配体的不同效应而变化[20]。有队列研究结果显示,Nur77 蛋白高水平表达会降低患者生存期的预后[29]。也有研究发现,部分化合物如厚朴酚、马来毒箭木苷等能够通过调节Nur77 信号通路来抑制肿瘤的生长[30-31]。
2.2.2 Nur77 与肿瘤相关的生物学功能
Nur77 在肿瘤细胞的生长、凋亡和自噬等生理调控过程中发挥着重要的作用[12]。Nur77 作为转录因子能够调控多种基因的表达,也能够作为与不同细胞间的伙伴直接相互作用的蛋白质,发挥与细胞存活和死亡相关的多种功能[32]。
作为一种转录因子,Nur77 通过与其同源基因结合的特异性蛋白1(Sp1)转录因子相互作用,或通过Nur77/Sp1 共同作用发挥转激活功能来调控基因[33-34]。已有研究证明:Nur77 通过其启动子区域的NBRE调节丝氨酸蛋白酶抑制剂家族成员SerpinA3,这可能与Nur77 在炎症疾病中的作用有关[35]。Nur77 还能够招募并作用辅抑制因子SWI/SNF 复合物到CD36 和FABP4 的启动子上,来抑制它们的转录,从而阻碍脂肪酸的摄取,抑制乳腺癌细胞增殖[36]。
Nur77 磷酸化能够诱导Nur77 从细胞核转移到线粒体,进而在线粒体中通过LBD 与Bcl-2 相互作用,暴露Bcl-2 的BH3 结构域,使其从抗凋亡分子转变为促凋亡分子,并触发癌细胞中细胞色素C(Cyt C)的释放,激活Caspase-9 和Caspase-3,诱导肿瘤细胞凋亡[12,23,37]。在THPN(1(-3,4,5-trihydroxyphenyl)nonan-1-one)的诱导下,Nur77 在线粒体内膜(MIM)通过TAD 与腺嘌呤核苷酸转位酶1(Adenine nucleotide translocase 1,ANT1)相互作用,导致ANT1-VDAC1 复合物消耗线粒体膜电位并诱导黑色素瘤细胞自噬[38]。除线粒体外,在CD437 等化合物的作用下,Nur77 还可转移到内质网,并与Bcl-2 或转介子相关蛋白亚单位γ(Translocon-associated protein subunit γ,TRAPγ)相互作用,引起内质网应激诱导的细胞凋亡[39]。
在不同化合物的作用下,Nur77 在多种肿瘤细胞中过表达并诱导凋亡,如肺癌[37]、乳腺癌[36]、结肠癌[40]、胃癌[41]、食管癌[42]、胰腺癌[43]和前列腺癌[44]等。除了具有促凋亡功能以外,Nur77 还可以抑制膀胱癌[45]、子宫平滑肌瘤[46]等肿瘤细胞的生长和细胞周期。
2.2.3 Nur77 配体
Nur77 在肿瘤中的表达和功能显示,其配体作为激动剂或拮抗剂代表了一种潜在的新型选择性受体调节剂用于癌症治疗[47]。Nur77 的受体激动剂如壳囊孢酮B(Cytosporone B,Csn-B)和1,1-二(3´-吲哚基)-1-(p-取代苯基)甲烷(C-DIMs)等可与Nur77 直接结合并激活Nur77,诱导Nur77 出核,从而引发凋亡并抑制肿瘤细胞生长[48-49]。此外,而后发现的C-DIMs 衍生物BI1071 以及Csn-B 相关化合物、三萜类青藤酚和许多其他化合物,包括多不饱和脂肪酸也有类似的作用[23,50]。这几种不同类型的化合物已被证实为结合受体Nur77 的配体,由此可见Nur77 配体化合物的有效性,以及Nur77 作为肺癌治疗靶点的可能性。
2.3 调节Nur77信号通路抗肿瘤化合物
已有研究发现,某些化合物能够通过调节Nur77 信号通路来抑制肿瘤的生长[20]。课题组曾综述了某些真菌聚酮及其类似物、化疗药物顺铂、植物提取物丁烯基苯酞(BP)、模拟肽紫杉醇等Nur77 相关抗肿瘤化合物[51]。下面将综述近年来发现的氧杂蒽酮类、萜类化合物、植物提取衍生物等能够通过调节Nur77信号通路的抗肿瘤化合物,如表2 所示。

表2 调节Nur77 信号通路的抗肿瘤化合物
2.3.1 氧化性二吲哚甲烷
3,3´-二吲哚甲烷(DIM)衍生物(二(1H-吲哚-3-基)(4-(三氟甲基)苯基)甲烷)的盐形式(也就是BI1071)被认为是第一个促进Nur77-Bcl-2 凋亡途径的Nur77 结合小分子[23]。相较其他DIM 衍生物,BI1071 能够直接与Nur77 高亲和力结合,促进Nur77 的线粒体靶向及其与Bcl-2 的相互作用,从而诱导肿瘤细胞凋亡,凋亡率为对照的30 倍。BI1071 在动物体内也具有显著地抑制肿瘤细胞的生长的作用,其对正常细胞的影响较小,因此可能具有较高的治疗指数。
2.3.2 萜类化合物
角鲨烷萜类化合物是一种独特的萜类化合物,已被报道在体外或体内有出显著的抗肿瘤活性。12-deacetyl-12-epi-scalaradial 是提取自西沙海绵的角鲨烷萜类化合物,对肝细胞癌细胞、乳腺癌细胞和结肠直肠癌细胞的生长具有抑制活性[52]。12-deacetyl-12- epi-scalaradial 在HeLa 细胞中通过诱导PARP裂解与Caspase 通路激活,并抑制MAPK/ERK 通路的激活,诱导Nur77 磷酸化,以及与Nur77-LBD 的相互作用,从而触发HeLa 细胞凋亡。在12-deacetyl-12- epi-scalaradial 处理下,HeLa 细胞凋亡率可达61.4%。这进一步证明了角鲨烷萜类化合物具有抗肿瘤活性,并显示出其作为治疗宫颈癌化合物的前景。
2.3.3 氧杂蒽酮类
氧杂蒽酮是一类主要在高等植物和微生物中作为次级代谢产物发现的三元杂环化合物,具有降压降脂、清热解毒、抗血栓形成和抗癌等作用[53,56]。1,3,7-三羟基-2,4 二戊基氧杂蒽酮(CCE9)是一种从中药植物越南黄牛木的变种红芽木中分离出的氧杂蒽酮化合物,可诱导乳腺癌、结直肠癌、肝癌、小细胞肺癌等肿瘤细胞凋亡[53]。CCE9 通过p38α MAPK 依赖性的方式诱导Nur77 表达和Bcl-2 磷酸化,从而导致Nur77 与Bcl-2 相互作用和Nur77 的细胞质定位以及线粒体靶向,最终诱导癌细胞凋亡。在CCE9 处理下,HeLa229 细胞发生广泛的早期凋亡率达19.85%。
2.3.4 真菌聚酮类似物
β-1,3-葡聚糖(LNT)是一种提取自香菇的香菇多糖,具有显著的抗肿瘤生物活性[54]。在体外实验中,缺氧诱导乳腺癌细胞中缺氧诱导因子-1α(HIF-1α)和Nur77 的表达;而在无氧环境中添加LNT 能够下调HIF-1α 的表达,该过程呈Nur77 依赖性,涉及Nur77 介导的泛素蛋白酶体途径。在体内实验中,LNT对乳腺肿瘤组织的生长也有显著的抑制作用。临床研究表明:LNT 单独或与其他化疗药物联合使用可用于治疗卵巢癌、胃癌、肝癌和肺癌。作为免疫调节剂,潜在的抗肿瘤机制可能是激活免疫反应以诱导细胞凋亡。
2.3.5 其他
5-((8-甲氧基-2-甲基喹啉-4-基)氨基)-1H-吲哚-2-碳酰肼衍生物是一种有效的Nur77 调节剂[55]。其先导化合物之一10g 具有低细胞毒性,对肝癌细胞具有广谱的抗增殖活性。10g 能够与Nur77 结合,并上调Nur77 的表达,促使Nur77 向内质网(ER)和线粒体的易位。10g 诱导的内质膜应激可以促进细胞自噬,通过内质网应激和自噬途径诱导细胞凋亡。10g 处理后,HepG2 细胞凋亡率可达91.3%。体内试验证实,10g 可显著抑制异种移植瘤的生长且具有良好的耐受性,肿瘤生长抑制率(TGI)可达62.38%。
厚朴酚(Honokiol)是一种从日本厚朴木兰中提取的酚类化合物。最近有研究表明,这种天然存在的小分子在多种肿瘤细胞中发挥着抗侵袭和抗增殖活性等作用[30]。Honokiol 通过抑制IκB 激酶(Inhibitor of kappa B kinase,IKK)和c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)或干扰肿瘤坏死因子受体超家族成员1A(Tumor Necrosis Factor Receptor 1,TNFR1)对其连接蛋白受体相互作用蛋白激酶1(Receptor-interacting protein kinase 1,RIPK1)的募集来抑制TNF-α 诱导的Nur77 表达,促使MCF-7 乳腺癌细胞对TNF-α 的杀伤作用更敏感。在体内,Honokiol 有效地抑制了MCF-7 荷瘤小鼠内肿瘤的生长,治疗2 周后抑制率超过50%。这些结果表明:Nur77 是一种有潜力的乳腺癌治疗干预药物靶点,并将Honokiol 确定为有治疗乳腺癌前景的先导物。
此外,课题组研究发现,从中药见血封喉中提取出的强心苷马来毒箭木苷(Malayoside)能够通过调节Nur77 信号通路来抑制肺癌的生长[31]。Malayoside 通过激活MAPK 信号通路(如p38 和ERK1/2),促使Nur77 保留于细胞质中,定位于线粒体,并诱导Cyt C 释放,激活Caspase-3,显著抑制NSCLC 细胞的生长并诱导细胞凋亡。在NCI-H460 荷瘤小鼠中,马来毒箭木苷处理后的肿瘤生长抑制率可达55.2%。基于Malayoside 在NSCLC 发生发展中的重要作用,研究结果表明:Malayoside 可能成为一种高效、低毒的潜在抗癌化合物,为治疗非小细胞肺癌提供了新的思路和见解。
针对上述Nur77 相关的抗肿瘤化合物,我们对其所涉及的信号通路进行综合,如图2 所示。

图2 Nur77 介导的抗肿瘤信号通路
3 结语
在过去的几十年里,尽管在化疗、分子靶向治疗以及免疫治疗等方面均取得了重大进展,但肺癌仍然是全球和中国重要公共卫生负担。免疫治疗的出现使肺癌的治疗进入新时代,然而只有部分患者能够从中得到很好的治疗,且与其相关的不良反应、耐药等问题还需要未来的科研实验进一步探索和解决。小分子靶向药物治疗较其他治疗方法具有药物用量少、特异性强、低毒性以及效果明显等优点,为抗肺癌药物研发提供了方向,也给肺癌患者带来了福音。对此,我们综述了目前报道较多的药物靶点及其相关药物,得出目前上市的肺癌小分子靶向药物不可避免地存在耐药及副反应较大等缺点,因此仍需进一步研究肺癌的分子机制以及开发更有效的新靶向药物。此外,我们从Nur77 在癌症中的表达、预后、与肿瘤相关的生物学功能及其配体3 个方面重点探讨了孤儿核受体Nur77 成为肺癌靶点的可能性,对调节Nur77 信号通路抗肿瘤化合物也作了进一步阐述。在不同化合物的作用下,Nur77 在多种肿瘤细胞的生长、侵袭、凋亡和自噬等生理调控过程中发挥着重要的作用。
综上所述,研发更安全有效的新靶向药物,进一步明确肺癌药物靶点出现耐药现象的原因,研发针对不同耐药机制的新型药物,制定针对不同肺癌类型患者的实际情况与药物耐受性的治疗新方案,提高肺癌患者生存率,减轻患者痛苦,等等,这些仍是医学研究需要不断深入的课题。
