聚六亚甲基双胍对蛋白核小球藻的毒性效应研究
2024-01-10魏文志
周 颖, 魏文志
(扬州大学动物科学与技术学院, 江苏扬州 225009)
聚六亚甲基双胍(polyhexamethylene biguanide, PHMB)为阳离子聚合物,具有杀菌效果好、不挥发、水溶性好,对温度、光照不敏感,便于储存和运输等优点[1], 因此广泛应用于医疗卫生、日用化工、水产养殖等行业[2-3]。在水产养殖业中,适量使用PHMB对主要水产经济养殖品种无毒副作用,常用作杀菌消毒剂来防治水产动物疾病的暴发[4]。但欧洲化学品管理局风险评估委员会已将PHMB认定为可疑致癌物[5]。同时有研究[6-7]表明,以PHMB饲喂小鼠会导致其体重下降或绝食,出现肝细胞溶解和肾小管损伤,引起动物血液生化指标的改变和海绵状血管瘤发病率的升高,甚至有引起肝癌的风险。
随着PHMB在各行业中的大量使用,不可避免地被释放到水环境中,随着水环境中PHMB浓度的不断升高,导致其在水生动植物体内残留,影响水生动物正常生长甚至引起死亡,最终破坏水体生态环境平衡。据俞军等[8]报道, PHMG可引起异育银鲫呼吸困难,身体失去平衡,腹部朝上,最后沉入水底死亡。中国对虾受精卵经不同浓度PHMB浸泡后孵化率下降20%~32%, 变态率高达99%[9]。有研究[10]表明高浓度PHMB对球等鞭金藻(Isochrysisgalbana)和亚心形扁藻(Marinemicroalga)的生长有明显的抑制作用,肉眼可见藻液颜色逐渐变淡,按照水生生物毒性分级, PHMB对2种藻类属于中等毒性。然而, PHMB对许多其他浮游植物的毒性及作用机制尚不明确,亟需进一步研究。
蛋白核小球藻(Chlorellapyrenidosa)是水生生态系统中最常见的单细胞藻类之一,由于其对污染物的高度敏感性,是研究生态毒理学的经典模式生物[11]。本试验以蛋白核小球藻为研究对象,探讨蛋白核小球藻在不同时间和浓度PHMB胁迫下的生长状态、叶绿素含量和抗氧化酶活性变化,并探究蛋白核小球藻中光合作用相关基因光合系统基因A (psbA)、核酮糖-l,5-二磷酸羧化·加氧酶 (rbcS)和1,5-二磷酸核酮糖羧化·加氧酶(rbcL)在PHMB胁迫后的表达,为PHMB对水生植物的毒性作用机制研究提供一定的理论依据。
1 材料与方法
1.1 供试材料
蛋白核小球藻购自中国科学院水生生物研究所淡水藻种库(FACHB-9); 聚六亚甲基双胍(PHMB)购自上海高聚生物科技公司(纯度≥99%), 货号为P832584-1g。超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)检测试剂盒(南京建成生物工程研究所); 反转录试剂盒、RNA提取试剂盒(南京诺唯赞生物科技公司); Goldview核酸染料(北京赛百盛生物科技公司); 琼脂糖(北京全式金生物科技公司); DL2000TM DNA Marker、SYBR Premix ExTaq(日本TaKaRa公司)。
1.2 试验方法
1.2.1 试验设计
蛋白核小球藻用BG11培养基[12]在光照培养箱中进行培养,镜检小球藻细胞形态正常后,取处于对数生长期的蛋白核小球藻,置于1 000 mL的锥形瓶中进行PHMB胁迫试验。在半数抑制浓度的基础上, PHMB终浓度设置0 (CK)、1 (低)、2 (中)、4 (高) mg·L-14个浓度处理, 每个浓度设置3个重复。培养条件: 温度(28±1) ℃, 光照度3 000 lx, 光照周期13 h (昼)/11 h (夜)。每天定时手动摇晃3次,并及时更换各组位置,以确保每个锥形瓶受到同等的光照度。于PHMB胁迫后0、3、6、9 d取小球藻样品进行试验。
1.2.2 藻细胞密度测定
用干燥吸管从锥形瓶中吸取100 μL藻液,滴于血球计数板中,缓慢放下盖玻片,显微镜下观察并计数。
1.2.3 叶绿素含量测定
分光光度法测定小球藻的叶绿素含量[13]。用量筒量取40 mL藻液, 0 ℃下8 000 r·min-1离心10 min, 弃去上清,收集藻细胞。超声破碎仪破碎藻细胞,加入80%丙酮, 混匀后4 ℃避光浸提24 h。用分光光度计于波长663、645、440 nm处检测吸光度,并计算叶绿素含量。叶绿素a含量/mg·L-1=12.7D663 nm-2.69D645 nm; 叶绿素b含量/mg·L-1=22.9D645 nm-4.68D663 nm。
1.2.4 细胞膜通透性测定
分别于PHMB胁迫0、3、6、9 d时用JENCO3173R电导率仪测定溶液中离子的电导率,以此评估藻细胞膜通透性[14]。
1.2.5 酶活性及MDA含量测定
按照南京建成试剂盒说明书进行SOD、GSH-Px活性和MDA含量的测定。
1.2.6 细胞形态观察
1) 蛋白核小球藻细胞表面结构观察: 取藻液20 mL, 5 000 r·min-1离心10 min, 2.5%戊二醛固定, 4 ℃固定过夜,离心,丙酮(30%、50%、70%、80%、90%、100%、100%)逐级脱水,醋酸异戊酯置换过夜,真空冷冻干燥24 h, 将冻干的小球藻粉涂抹在导电胶上喷金处理[15]。在场发射扫描电镜(GeminiSEM 300)下进行样品的观察和拍照。
2) 蛋白核小球藻细胞内部结构观察: 取藻液20 mL, 5 000 r·min-1离心10 min, 2.5%戊二醛固定过夜, 0.1 mol·L-1磷酸盐缓冲液(pH 7.0)(PBS)漂洗3次; 1%锇酸溶液固定样品1.5 h; 样品用乙醇梯度脱水,丙酮处理20 min; 70 ℃包埋过夜; 超薄切片后柠檬酸铅和醋酸铀双染色[16]; 透射电镜(Hitach-600)下进行样品的观察和拍照。
1.2.7 基因表达分析
取50 mL藻液, 5 000 r·min-1离心10 min, 弃去上清液,收集藻细胞,使用Trizol一步法进行样品总RNA提取。琼脂糖凝胶电泳和微量分光光度计检测RNA质量和浓度,去基因组反转录试剂盒(南京诺唯赞生物科技公司)进行反转录得到cDNA, 以六碱基随机引物合成第1条cDNA; 随后加入DNA polymerase l、dNTPs、RNaseH等合成第2条cDNA。最后用荧光定量PCR检测样品中的基因表达水平,内参基因为18SrRNA[17]。引物合成由上海生工生物工程公司合成,序列如表2所示。采用2-ΔΔCt法定量和分析数据。

表1 定量引物序列Tab.1 Primer sequences for qPCR
1.3 数据分析

2 结果与分析
2.1 PHMB对小球藻生长的影响
由图1可见,不同浓度PHMB胁迫对小球藻生长有明显的影响。胁迫9 d内, PHMB低、中浓度组小球藻密度较对照组有不同程度的减少,但总体呈现出缓慢上升的趋势(P<0.05); PHMB高浓度组小球藻密度与对照组相比呈明显的下降趋势, 胁迫9 d时,密度降低96.7% (P<0.05)。随着PHMB浓度和胁迫时间的增加,蛋白核小球藻生长呈下降趋势,即抑制作用增强,说明PHMB对蛋白核小球藻的生长抑制呈现剂量-效应关系和时间-效应关系。

图1 PHMB对小球藻生长的影响*Fig.1 Effects of polyhexamethyl biguanide (PHMB) on C.pyrenoidosa growth* 同一时间不同小写字母处理间差异显著(P<0.05)。* Different letters in the same time represent the significant difference of data (P<0.05).
2.2 PHMB对蛋白核小球藻叶绿素含量的影响
不同浓度PHMB胁迫后,对小球藻叶绿素a含量有明显的影响(图2.A)。胁迫3 d时,低、中、高浓度组均显著低于对照组,且不同浓度PHMB组间也存在显著差异, PHMB浓度越高,叶绿素a含量越低。与对照组相比,胁迫3 d时,低、中、高浓度组叶绿素a含量分别下降11.70%、29.07%和58.64% (P<0.05); 胁迫6 d时,分别下降20.19%、39.35% 和83.88% (P<0.05); 胁迫9 d时,分别下降5.32%、45.64%和88.62% (P<0.05)。不同浓度PHMB胁迫后,叶绿素b含量的变化趋势与叶绿素a基本一致 (图2.B)。与对照组相比,胁迫3 d时,低、中、高浓度组叶绿素b含量分别下降11.70%、29.08%和58.65% (P<0.05); 胁迫6 d时,分别下降20.19%、39.35%和83.88% (P<0.05); 胁迫9 d时,分别下降5.32%、45.64%和88.62% (P<0.05)。本试验还观察到高浓度组蛋白核小球藻颜色从初始的翠绿色逐步变成淡绿色,直至变成淡白色。

图2 PHMB对小球藻叶绿素含量的影响*Fig.2 Effects of polyhexamethyl biguanide on chlorophyll content in C.pyrenoidosa* 同一时间不同小写字母处理间差异显著(P<0.05)。* Different letters in the same time represent the significant difference of data (P<0.05).
2.3 PHMB对小球藻细胞膜通透性的影响
与对照相比,暴露3 d时,低、中、高浓度组的电导率分别上升4.98%、9.63%、12.11% (P<0.05); 暴露6 d时,分别上升2.78%、7.19%、11.83% (P<0.05); 暴露9 d时,分别上升7.61%、10.98%、16.27% (P<0.05)。这说明PHMB浓度的增加,小球藻细胞膜通透性逐渐变高(图3)。
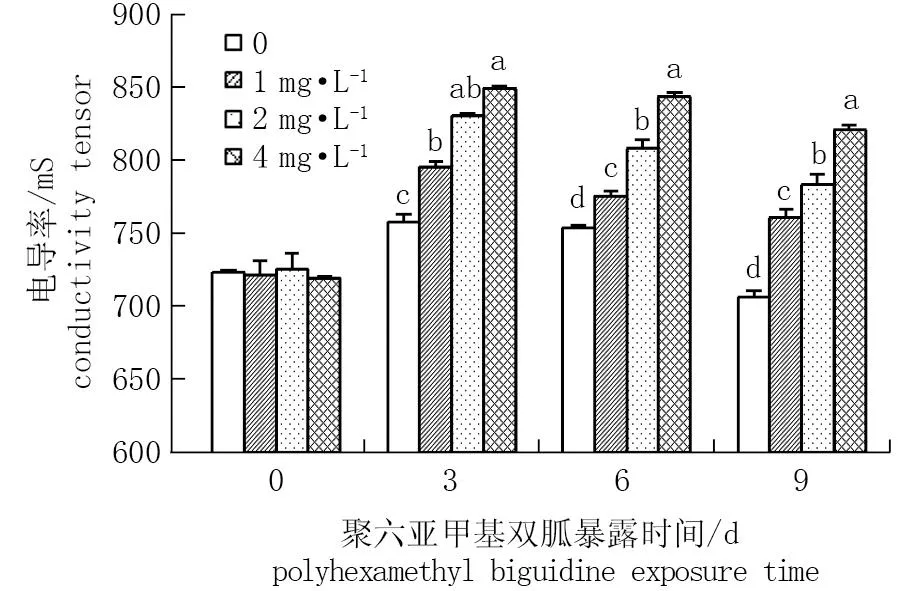
图3 PHMB对小球藻细胞膜通透性的影响*Fig.3 Effect of polyhexamethylene biguanid on permeability of chlorella cell membrane* 同一时间不同小写字母处理间差异显著(P<0.05)。* Different letters in the same time represent the significant difference of data (P<0.05).
2.4 PHMB胁迫下小球藻细胞形态的观察
由蛋白核小球藻藻细胞扫描电镜照片可见,空白对照组藻细胞呈椭圆形,表面完整(图4.A)。不同浓度PHMB胁迫9 d后藻细胞表面呈现出不同程度的损伤,尤其是高浓度组藻细胞表面细胞壁开裂,大量内含物外渗,造成细胞粘连(图4.B-D)。

图4 蛋白核小球藻的扫描电子显微镜(SEM)观察 (×8 000)*Fig.4 Scanning electron microscope observation of C.pyrenoidosa (×8 000)* A. 对照组, B. 1 mg·L-1, C. 2 mg·L-1, D. 4 mg·L-1; CW. 细胞壁, E. 渗出物质。* A. control group, B. 1 mg·L-1, C. 2 mg·L-1, D. 4 mg·L-1; CW. cell wall, E. exudate substance.
由蛋白核小球藻的透射电子显微镜照片可见,对照组蛋白核小球藻细胞呈广椭圆形,细胞壁厚且完整,细胞核中的核仁与核膜清晰可见; 细胞中可见完整的杯状叶色素体,液泡和溶酶体完整(图5.A)。不同浓度PHMB胁迫9 d后蛋白核小球藻细胞内部结构发生明显的畸形 (图5.B-D)。低浓度组蛋白核小球藻细胞壁增厚,而细胞结构保持较为完整(图5.B); 中浓度组藻体细胞壁松散,细胞核变形,细胞膜结构不完整,可观察到细胞基质的缺失,叶绿体和类囊体的完整性遭到破坏,线粒体变形,线粒体嵴减少,液泡体积和淀粉粒增大(图5.C); 高浓度组蛋白核小球藻细胞呈不规则形状,细胞壁褶皱,色素体和溶酶体萎缩,蛋白核结构被破坏,大量内含物渗出,液泡消失(图5.D)。这说明蛋白核小球藻在高浓度PHMB的持续胁迫下,细胞的表面结构和内部结构均发生明显改变。

图5 蛋白核小球藻透射电子显微镜(TEM)观察(×23 000)*Fig.5 Transmission electron microscophs observation of C.pyrenoidosa (×23 000)* A. 对照组, B. 1 mg·L-1, C. 2 mg·L-1, D. 4 mg·L-1; CW. 细胞壁, CM. 细胞膜, C. 色素体, P. 蛋白核, N. 细胞核, V. 液泡, E. 渗出物质, S. 溶酶体。* A. control group, B.1 mg·L-1, C.2 mg·L-1, D. 4 mg·L-1; CW. cell wall, CM. cell membrane, C. chromatophores, P. protein nucleus, N. nucleus, V. vacuole, E.exudate material, S. the lysosome.
2.5 PHMB对小球藻氧化应激的影响
不同浓度PHMB胁迫对小球藻SOD活性的影响如图6.A所示。胁迫3 d时,与对照组相比,高浓度组SOD活性下降22.7% (P<0.05)。胁迫6、9 d时,与对照组相比,各处理组SOD活性下降更加明显,尤其是PHMB胁迫9 d时,与对照组相比,中、高浓度组SOD活性分别下降58.6%和79.0% (P<0.05)。这说明持续高浓度PHMB胁迫会降低蛋白核小球藻的SOD活性。

图6 PHMB对小球藻抗氧化酶活性的影响*Fig.6 Effect of polyhexamethylene biguanide on antioxidant activity in C.pyrenoidosa* 同一时间不同小写字母处理间差异显著(P<0.05)。* Different letters in the same time represent the significant difference of data (P<0.05).
不同浓度PHMB对小球藻GSH-Px活性的影响如图6.B所示。其变化趋势与SOD类似,随着PHMB胁迫时间的延长和浓度的增高,各处理组GSH-Px活性较对照组均呈下降趋势,且存在显著差异。这说明高浓度PHMB持续胁迫会降低蛋白核小球藻的GSH-Px活性。
不同浓度PHMB对小球藻MDA含量的影响如图6.C所示。与对照组相比,随着PHMB胁迫时间的延长,呈现出先增加后下降的趋势,高浓度组下降更加显著。
2.6 PHMB对小球藻光合作用相关基因表达的影响
不同浓度PHMB胁迫下小球藻中光合作用相关基因的表达变化见图7。胁迫3 d时,各浓度组psbA基因表达上调,其中高浓度组改变最为显著,其psbA基因的表达量较对照组提高8.0倍(P<0.05)。随着胁迫时间的延长, PHMB对psbA的诱导作用减弱,胁迫9 d时,与对照组相比,中、高浓度组psbA基因的表达量分别下降至对照的46.7%和78.3% (P<0.05) (图7.A)。rbcL基因的表达变化与psbA表达变化趋势相似,在PHMB胁迫3 d时显示出较强烈的诱导效应,高浓度组较对照组上升4.0倍(P<0.05), 胁迫6 d时低浓度组较对照组上升4.0倍(P<0.05), 而胁迫9 d时, PHMB的诱导效应显著降低(图7.B)。rbcS基因的表达在PHMB的胁迫下,其变化不同于psbA和rbcL, 胁迫3 d时,中浓度组表达量较对照组上升4.5倍(P<0.05); 胁迫6、9 d时,除高浓度组外,其他组诱导效应均有减弱趋势(图7.C)。

图7 PHMB对小球藻光合作用相关基因表达的影响*Fig.7 Effect of polyhexamethylene biguanide on the relative expression of photosynthesis-related genes in C.pyrenoidosa* 同一时间不同小写字母处理间差异显著(P<0.05)。* Different letters in the same time represent the significant difference of data (P<0.05).
3 讨论
PHMB在诸多行业中大量使用,导致其在水环境中广泛分布,给水体生态造成一定的威胁。本试验以蛋白核小球藻为研究对象,用0、1、2、4 mg·L-1浓度的PHMB胁迫3、6、9 d后,对小球藻生长性能、叶绿素含量和抗氧化酶活性均产生明显的影响,蛋白核小球藻中光合作用相关基因表达量也发生明显变化,这进一步加深PHMB对浮游植物毒性的认识。中、高浓度PHMB显著抑制蛋白核小球藻的生长并降低叶绿素含量,细胞膜、细胞器等细胞结构均有明显的皱缩和破损现象,抗氧化酶活性和光合作用相关基因表达量也有不同程度的改变。
在PHMB的胁迫下,蛋白核小球藻的生长性能和表面结构均产生明显的变化。小球藻生长试验显示,不同浓度的PHMB对小球藻的生长有明显的抑制作用,且随着PHMB浓度的增加,抑制作用增强,即具有浓度依赖效应。在扫描电镜下可观察到藻细胞团变小,细胞壁开裂,肉眼可见藻液颜色变淡。这可能是因为PHMB表面带有正电荷,而藻类的细胞颗粒带有负电荷,通过静电吸引作用可使藻细胞形成絮团,并与细胞磷脂化合物结合,导致膜脂结构破坏和膜脂组成改变,从而抑制小球藻生长,导致其死亡[17]。
在PHMB的胁迫下,蛋白核小球藻叶绿素含量变化与其生长指标表现出相似的规律,即随着PHMB浓度的增加,叶绿素含量下降。Ikeda等[18]研究发现PHMB能改变细胞膜结构和流动性,进而对细胞器造成破坏。本试验透射电镜观察显示, PHMB同样可破坏小球藻的细胞结构,破坏小球藻的内部蛋白核、叶绿体和类囊体结构等,导致叶绿素合成减少。同时,因小球藻细胞光合作用的能力被抑制,叶绿素含量降低和功能调节紊乱,导致藻体无法维持自身生长需求,使其生长受到抑制。这表明叶绿素含量与小球藻生长密度关系密切,且在受到环境胁迫后两者之间会互相影响。
小球藻细胞在长期抵御环境胁迫过程中,进化出抗活性氧(ROS)损伤的保护系统,包括SOD、GSH-Px和过氧化氢酶 (CAT) 等抗氧化酶。在PHMB的胁迫下, SOD和GSH-Px在不同时间段呈现出随PHMB浓度的升高而下降的趋势。Cao等[19]研究发现小球藻在聚维酮碘的胁迫下SOD活性降低,这是因为小球藻受到较强的环境胁迫,本试验结果与此类似。GSH-Px以谷胱甘肽(GSH)为底物, 催化过氧化氢降解为水[20], 本试验中其活性较对照组明显下降,其原因可能是藻体受到PHMB胁迫时,抑制GSH-Px活性[21]。MDA是自由基诱导的脂质过氧化的最终分解产物, MDA含量直接反映ROS在藻类的积累和脂质过氧化程度,是评价膜系统受损程度和藻类抗逆性的重要参数[22]。MDA含量随着PHMB浓度的升高而先升高后降低,表明小球藻遇到有毒物质,其含量因机体发生脂质过氧化而不断增加,而后MDA含量下降,这可能是因为机体细胞膜的破裂,导致MDA释放至胞外水体中。
在PHMB的胁迫下,蛋白核小球藻光合作用基因的表达量在不同时间段呈现出先上升后下降的趋势。D1蛋白是光系统Ⅱ (PSⅡ)反应中心的重要蛋白,由pbsA基因编码,是高等植物和藻类叶绿体基因组中重要光调控基因[23]。pbsA在PHMB胁迫后呈先上调后下降的趋势,处理前期短时间内的上调可能与藻细胞受到一定程度的应激有关,从而提高PSⅡ活性; 但随着PHMB浓度的增加和处理时间的延长,藻细胞自身遭到破坏,其表达量也随之降低。核酮糖-1,5-二磷酸羧化酶(Rubisco)是参与植物光合作用的一种关键酶,它既能转化CO2, 又能在光呼吸中催化O2的氧化反应,因此Rubisco对植物的净光合率具有重要影响[24-25]。其中Ⅰ型Rubisco酶由大亚基(RbcL)和小亚基(RbcS)组成, RbcL具有催化作用,而RbcS发挥调节大亚基RbcL活性的作用[26-27]。在PHMB胁迫下rbcL和rbcS的表达与psbA类似,即短时间(3~6 d)胁迫显著提高RbcL和RbcS基因的表达量,表明藻体对PHMB毒害的代偿调节状态,而胁迫9 d时RbcL和RbcS基因的表达量均明显下降,进一步说明长期的PHMB胁迫使蛋白核小球藻光合作用调节失代偿。庄航等[17]研究发现小球藻rbcL、rbcS在乙草胺胁迫下表达量持续降低,光合功能持续下降,最终导致不可逆失活直至死亡,说明PHMB对小球藻光合作用相关基因的表达起着重要的作用。
4 结论
PHMB对蛋白核小球藻有较强的毒性。PHMB抑制蛋白核小球藻的生长,使细胞壁破裂,细胞器遭到破坏,影响蛋白核小球藻叶绿素含量; 并在细胞内生成大量的活性氧自由基,致使小球藻抗氧化相关酶失衡; 光合作用相关基因pbsA、rbcL和rbcS的表达量在PHMB胁迫下呈先上升后下降趋势,显示出小球藻对PHMB胁迫下的反馈调节作用。这为PHMB对小球藻的毒性效应研究提供了参考,并为PHMB的环境风险评估提供了依据。
